18.6: reaktioner af Epoksider: Ring-åbning
epoksring-åbningsreaktioner – SN1 vs. SN2, regioselektivitet og stereoselektivitet
de ikke-sematiske ringåbningsreaktioner af epoksider giver et godt overblik over mange af de begreber, vi allerede har set i dette kapitel. Ringåbningsreaktioner kan foregå ved hjælp af enten SN2-eller SN1-mekanismer afhængigt af arten af epoken og reaktionsbetingelserne. Hvis epoken er asymmetrisk, vil produktets struktur variere afhængigt af hvilken mekanisme der dominerer. Når en asymmetrisk epilte gennemgår solvolyse i basisk methanol, ringåbning sker ved hjælp af en SN2-mekanisme, og det mindre substituerede kulstof er stedet for nukleofilt angreb, hvilket fører til det, vi vil henvise til som produkt B:

omvendt, når solvolyse forekommer i sur methanol, forekommer reaktionen ved en mekanisme med væsentlig SN1-karakter, og det mere substituerede kulstof er angrebsstedet. Som et resultat dominerer produkt A.

disse er begge gode eksempler på regioselektive reaktioner. I en regioselektiv reaktion er to (eller flere) forskellige forfatningsmæssige isomerer mulige som produkter, men en dannes fortrinsvis (eller undertiden udelukkende).
lad os først undersøge den grundlæggende SN2-sag. Der er ingen syre til rådighed til at protonere iltet før ringåbningen. Det er derfor usandsynligt, at ringen åbner uden et ‘skub’ fra nukleofilen.
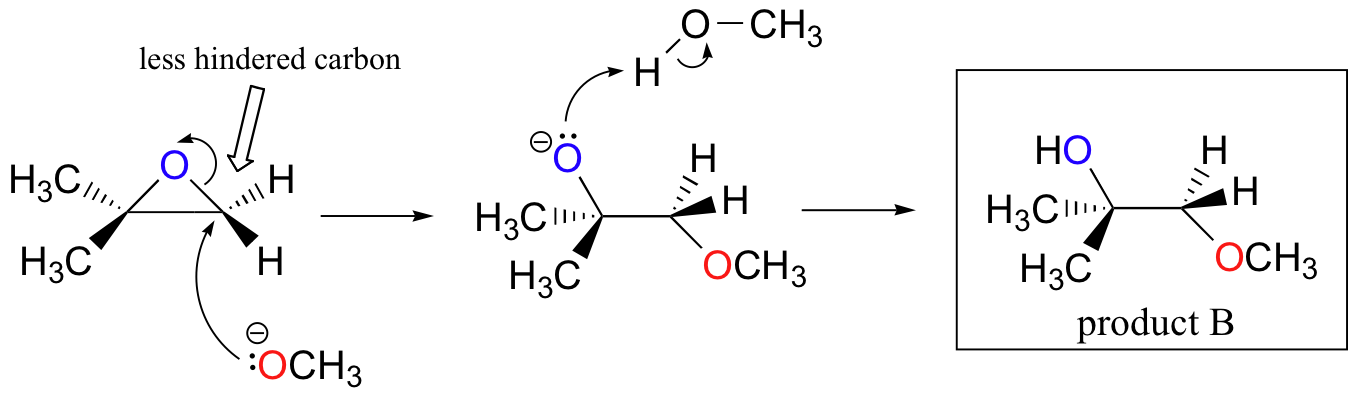
selve nukleofilen er potent: en deprotoneret, negativt ladet metsid ion. Når en nukleofil substitutionsreaktion involverer en dårlig afgangsgruppe og en kraftig nukleofil, er det meget sandsynligt, at den fortsætter med en SN2-mekanisme.
hvad med elektrofilen? Der er to elektrofile carbonatomer i epoken, men det bedste mål for nukleofilen i en SN2-reaktion er det kulstof, der er mindst hindret. Dette tegner sig for det observerede regiokemiske resultat. Som i andre SN2-reaktioner finder nukleofilt angreb sted fra bagsiden, hvilket resulterer i inversion ved det elektrofile kulstof.
sandsynligvis er den bedste måde at skildre den syrekatalyserede ringåbningsreaktion som en hybrid eller kryds mellem en SN2 og SN1 mekanisme. For det første protoneres iltet, hvilket skaber en god afgangsgruppe (trin 1 nedenfor) . Derefter begynder kulstof-iltbindingen at bryde (trin 2), og positiv ladning begynder at bygge op på det mere substituerede kulstof (husk diskussionen fra afsnit 8.4 B om carbocation stabilitet).

i modsætning til i en SN1-reaktion angriber nukleofilen det elektrofile kulstof (trin 3), før et komplet carbocation-mellemprodukt har en chance for at dannes.
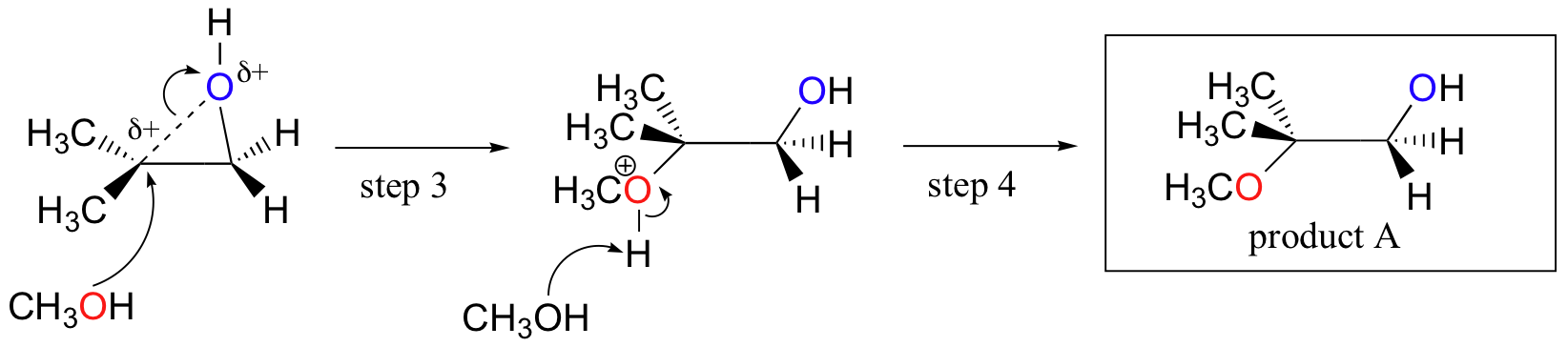
angreb foregår fortrinsvis fra bagsiden (som i en SN2-reaktion), fordi kulstof-iltbindingen stadig til en vis grad er på plads, og iltblokkene angriber fra forsiden. Bemærk, imidlertid, hvordan det regiokemiske resultat adskiller sig fra den basiskatalyserede reaktion: i den syrekatalyserede proces angriber nukleofilen det mere substituerede kulstof, fordi det er dette kulstof, der har en større grad af positiv ladning.
eksempel 18.6.1
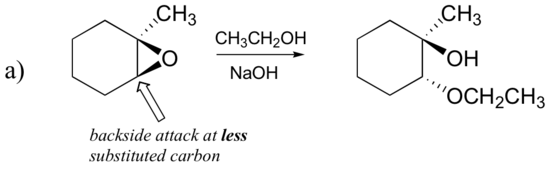
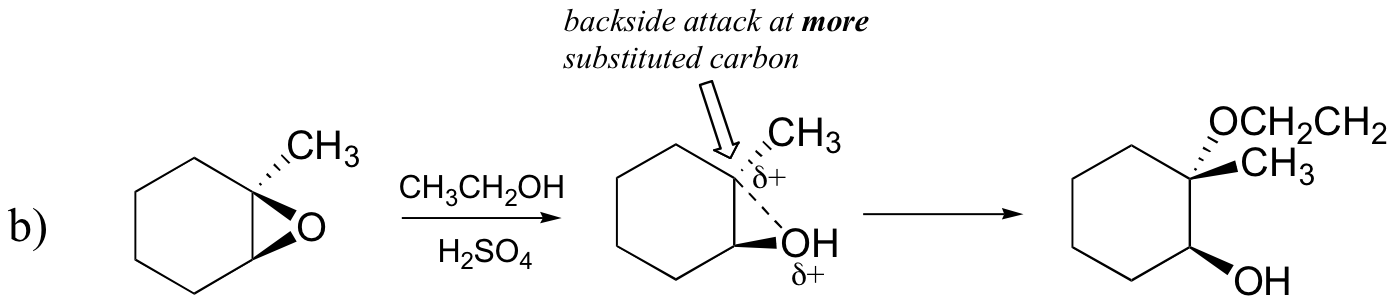
Forudsig det eller de vigtigste produkt (er) af ringåbningsreaktionen, der opstår, når:
- ethanol og en lille mængde natriumhydroksid
- ethanol og en lille mængde svovlsyre
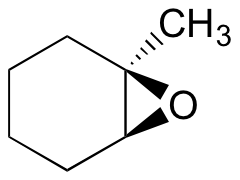
tip: Sørg for at overveje både regiokemi og stereokemi!
svar