ATrain uddannelse
selvom vi lærer mere hver dag om patofysiologien af Parkinsons sygdom, betragtes den stadig stort set idiopatisk (af ukendt årsag). Det involverer sandsynligvis interaktionen mellem værtsfølsomhed og miljøfaktorer. En lille procentdel af tilfældene er genetisk forbundet, og genetiske faktorer undersøges intensivt.
fysiologisk er symptomerne forbundet med Parkinsons sygdom resultatet af tabet af et antal neurotransmittere, især dopamin. Symptomerne forværres over tid, da flere og flere af de celler, der er ramt af sygdommen, går tabt. Sygdomsforløbet er meget variabelt, hvor nogle patienter udviser meget få symptomer, når de bliver ældre, og andre, hvis symptomer udvikler sig hurtigt.
Parkinsons ses i stigende grad som en kompleks neurodegenerativ sygdom med en sekvens af progression. Der er stærke beviser for, at det først påvirker den dorsale motoriske kerne i vagusnerven og de olfaktoriske pærer og kerne, derefter locus coeruleus og til sidst substantia nigra. Kortikale områder af hjernen påvirkes på et senere tidspunkt. Skader på disse forskellige neuronale systemer tegner sig for de mangesidede patofysiologiske ændringer, der forårsager svækkelser ikke kun til motorsystemet, men også til de kognitive og neuropsykologiske systemer (kV & Hvidhill, 2011).
Dopamins rolle
dopamin overfører ligesom andre neurotransmittere kemiske meddelelser fra en nervecelle til en anden over synapsen, et mellemrum mellem den presynaptiske celle og den postsynaptiske receptor. Dopamin udskilles i synapsen fra membranlagringsvesikler i den presynaptiske membran. Det krydser synapsen og binder til den postsynaptiske membran, hvor den aktiverer dopaminreceptorer. Ubrugt dopamin, der er tilbage i synapsen, absorberes tilbage i den presynaptiske celle; når det er tilbage i den presynaptiske celle, pakkes det overskydende dopamin om i opbevaringsvesikler og frigives igen i synapsen.
når dopamin bevæger sig fra en celle til en anden, kan det nedbrydes og gøres inaktivt af to stoffer, MAO (monoaminoksidase) og COMT (catechol-O-methyltransferase). En terapeutisk strategi introducerer en MAO-hæmmer i synapsen, som afbryder virkningen af MAO-midlet og forhindrer nedbrydning af dopamin. Dette tillader mere dopamin at forblive i synapsen og øger sandsynligheden for, at den binder til den postsynaptiske membran.
kemisk synaptisk Transmission
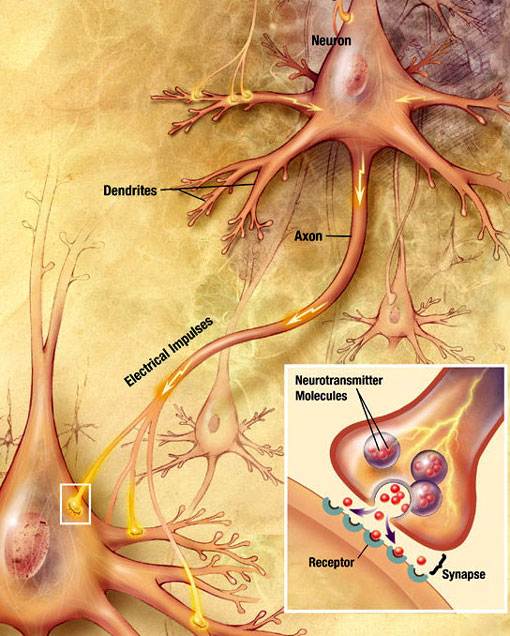
en elektrokemisk bølge kaldet et handlingspotentiale bevæger sig langs en neurons akson. Når handlingspotentialet når den presynaptiske terminal, provoserer det frigivelsen af en lille mængde neurotransmittermolekyler, der binder til kemiske receptormolekyler placeret i membranen i det postsynaptiske neuron på den modsatte side af det synaptiske kløft. Kilde:
progressivt tab af dopamin
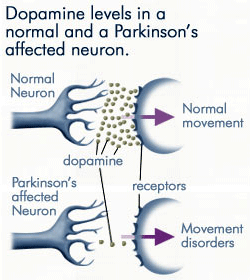
da mindre og mindre dopamin produceres af de neuroner, der er påvirket af Parkinsons sygdom, er langt mindre dopamin tilgængelig til at binde til dopaminreceptorerne på den postsynaptiske membran. Kilde: anti-agingfirewalls.com.
selvom dopamincelletab ikke kan måles direkte, afslører målinger hos neurologisk normale mennesker og hos ikke-menneskelige primater et langsomt progressivt tab af dopamin med alderen. Ved Parkinsons sygdom forekommer tabet med en meget større hastighed, og både biokemiske målinger og billeddannelsesundersøgelser antyder, at der er et signifikant fald i dopamin, når motoriske symptomer vises. I denne opfattelse er Parkinsons sygdom en accelereret version af celledød set med normal aldring (Cookson, 2009). Dette er illustreret i nedenstående graf, som viser faldet i dopaminerge neuroner under normal aldring, i idiopatisk PD, i PD forårsaget af miljømæssige eller genetiske faktorer og i tidlig debut PD.
udvikling af Dopaminudtømning i Parkinsons sygdom
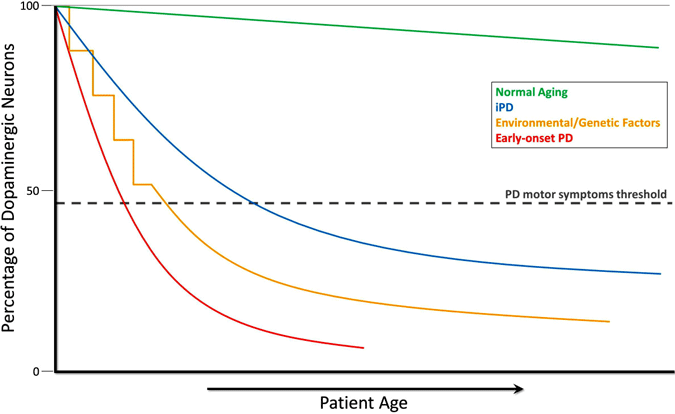
i løbet af normal aldring (grøn linje) forekommer lille, men langsom dopaminerg degeneration uden motoriske symptomer. Idiopatisk PD (IPD, blå linje) er af ukendt oprindelse, men menes at udvikle sig gradvist med en langsom degeneration af dopaminerge neuroner, der fører til de klassiske PD-motoriske symptomer senere i livet. En anden model af dopamin-neurodegeneration, der fører til PD-motoriske symptomer, involverer gentagen eksponering for miljøtoksiske stoffer over tid i kombination med en genetisk disposition for dopaminerg neurontab (gul linje). Tidlig debut PD (rød linje), som forårsaget af mutationer i PARKIN-genet, involverer et brat fald i dopaminerge neuroner, og PD-motoriske symptomer kan præsentere årtier før dem i idiopatisk PD. Et yderligere scenario (ikke vist) af PD-motorisk symptomudvikling involverer mulig in utero miljøtoksiske stoffer eller genetiske faktorer, der fører til et atypisk lavt antal dopaminerge neuroner ved fødslen og øget modtagelighed for PD-udvikling (Haas et al., 2012).
Degeneration af dopaminneuroner er især tydelig i en del af substantia nigra kaldet pars compacta. Signifikant øger tabet af dopamin i pars compacta det samlede ophidsende drev i basalganglierne,* forstyrrer frivillig motorstyring og forårsager de karakteristiske symptomer på PD. Normalisering af motorisk funktion ses oprindeligt med levodopa-behandling (Gasparini et al., 2013).
*hovedkomponenterne i de basale ganglier er striatum (caudatkernen og putamen), globus pallidus, substantia nigra, nucleus accumbens og den subthalamiske kerne.
efterhånden som sværhedsgraden af PD øges, fører udtømningen af dopamin til yderligere ændringer i de basale gangliereveje, herunder ændret funktion af andre basale ganglier neurotransmittere såsom glutamat, GABA og serotonin (Gasparini et al., 2013). Selv om der er relativ sårbarhed af dopaminproducerende neuroner i substantia nigra, påvirkes ikke alle dopaminceller i Parkinsons sygdom; i nogle dele af hjernen er de dopaminproducerende neuroner relativt skånet (Cookson, 2009).
den Nigrostriatale vej
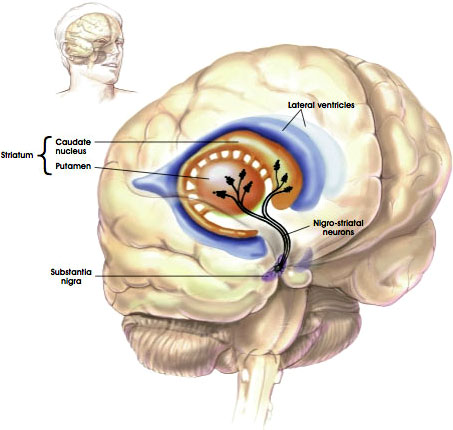
kilde: NIH, n. d.
uhyggelige kroppe og alfa-Synuclein
uhyggelige kroppe er unormale aggregater og indeslutninger af protein, der udvikler sig inde i nerveceller hos mennesker med Parkinsons sygdom. Aggregeringerne består sædvanligvis af uopløselige fibrillære aggregater indeholdende misfoldede proteiner. Et stort antal molekyler er blevet identificeret i uhyggelige legemer, men et protein kaldet alfa-synuclein er hovedkomponenten.
uhyggelige kroppe (alfa-Synuclein-indeslutninger)
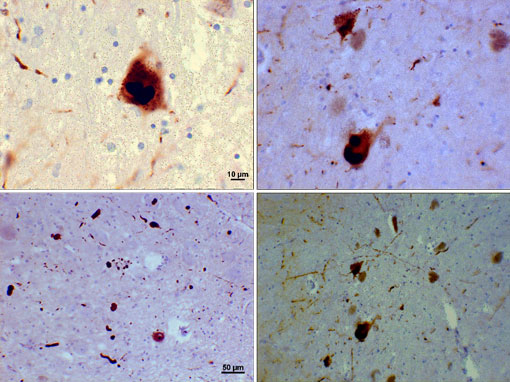
Fotomikrograf af regioner i substantia nigra hos en Parkinsons patient, der viser uhyggelige kroppe og uhyggelige neuritter i forskellige forstørrelser. Toppaneler viser en 60 gange forstørrelse af alfa-synuclein intraneuronale indeslutninger aggregeret for at danne uhyggelige kroppe. Bundpanelerne er 20 liter forstørrelsesbilleder, der viser strenglignende uhyggelige neuritter og afrundede uhyggelige kroppe i forskellige størrelser. Billeder med tilladelse fra Suraj Rajan.
uhyggelig patologi omfatter mange regioner i hjernen, og nogle rapporter har antydet, at substantia nigra ikke er det første sted, hvor uhyggelige kroppe dannes i Parkinsons sygdom. Inklusioner og aggregater symboliserer sandsynligvis slutfasen af en kaskade af komplicerede begivenheder. Et tidligere stadium kan være mere direkte bundet til patogenesen af lidelsen end selve indeslutningerne, som måske eller måske ikke repræsenterer diagnostiske kendetegn.
uhyggelige kroppe ses også i “demens med uhyggelige kroppe”, hvilket antyder, at disse tilstande er relateret til hinanden ved delt patologi og muligvis ved delt etiologi. Hverken celletab eller dannelsen af uhyggelige kroppe er absolut specifik for PD, men begge er nødvendige for en diagnose af PD under nuværende definitioner (Cookson, 2009).
Neurodegenerative lidelser som f.eks. frontal-temporal degeneration, prionsygdom, Huntingtons chorea og motoneuron sygdomme bliver i stigende grad realiseret at have fælles cellulære og molekylære mekanismer, herunder proteinaggregering og inklusion kropsdannelse i visse områder af nervesystemet (Jellinger, 2011).
Inflammation og immunrespons
udløseren af dopaminerg degeneration synes at være multifaktoriel—påvirket af både endogene og miljømæssige elementer. Inflammation og immunrespons betragtes i stigende grad som vigtige mediatorer af dopaminerg degeneration. Store befolkningsundersøgelser har antydet, at personer, der tager ikke-steroide antiinflammatoriske lægemidler (NSAID ‘ er), har mindre risiko for at udvikle idiopatisk PD, hvilket antyder, at antiinflammatoriske lægemidler kan være en lovende sygdomsmodificerende behandling for parkinsonpatienter (Barcia, 2013).
nye forsøgsfaser har involveret antiinflammatoriske behandlinger-specifikt på udkig efter en objektiv biomarkør i behandlinger, der sigter mod at reducere inflammatoriske ændringer hos patienter med PD. Forskere bruger neuroimaging-værktøjer til at udvikle en relevant biomarkør med det formål at teste dette i store kliniske billeddannelsesforsøg. Resultatet af disse forsøg vil give data til test og overvågning af progressionen af antiinflammatoriske behandlinger for PD og vil hjælpe med at identificere det rettidige terapeutiske vindue til at stoppe eller i det mindste langsom, inflammatorisk medieret dopaminerg degeneration (Barcia, 2013).
Parkinsonisme
Parkinsonisme, også kendt som “atypisk Parkinsons”, “sekundær Parkinsons” eller “Parkinsons syndrom”, er et neurologisk syndrom, hvor en patient udviser nogle af symptomerne forbundet med Parkinsons sygdom—tremor, stivhed, bradykinesi og postural ustabilitet. Men parkinsonisme er ikke Parkinsons sygdom. Parkinsonisme menes ikke at være forårsaget af Parkinsons sygdom, og patienter reagerer typisk dårligt på farmakologisk intervention. Parkinsonisme har ofte en identificerbar årsag, såsom eksponering for toksiner, methamfetamin, traumer, flere slagtilfælde, andre nervesystemforstyrrelser eller sygdom. Generelt ses uhyggelige kroppe ikke i parkinsonisme.
udtrykket parkinsonisme er også forbundet med lidelser såsom progressiv supranuklear parese, multiple systematrofi, uhyggelig kropsdemens, kortikobasal degeneration, vaskulær parkinsonisme, medikamentinduceret parkinsonisme og parkinsonisme sekundært til infektion og andre årsager (Hohler et al., 2012). En form for reversibel parkinsonisme kan forekomme ved brug af visse neuroleptiske lægemidler, især reserpin, antipsykotika (haloperidol) og metoclopramid. Eksponering for visse toksiner, alvorlig kulilteforgiftning og kviksølvforgiftning kan også føre til parkinsonisme.
udseendet i begyndelsen af 1980 ‘ erne af parkinsonismesymptomer hos en gruppe stofmisbrugere, der havde indtaget en forurenet batch af et syntetisk opiat, førte til opdagelsen af det kemiske MPTP som et middel, der forårsager parkinsonismesyndrom hos ikke-menneskelige primater såvel som hos mennesker. MPTP kan produceres, når man fremstiller en form for heroin (MPTP omdannes til et neurotoksin, der selektivt ødelægger dopaminceller i substantia nigra). Disse tilfælde er sjældne og har for det meste påvirket langvarige stofbrugere.
Metamfetaminmisbrug har også været forbundet med Parkinsonisme. Hos forsøgsdyr beskadiger eksponering for metamfetamin dopaminerge fibre i striatum* såvel som cellelegemerne i substantia nigra, hvilket gentager degenerationen observeret hos humane patienter med PD. Selektiv skade på dopaminerge terminaler i striatum er også blevet observeret hos humane metamfetaminbrugere, skønt der indtil videre ikke er noget bevis for, at metamfetaminmisbrug skader dopaminerge cellelegemer i substantia nigra (Granado et al., 2013).
*den største kerne af de basale ganglier, striatum består af caudatkernen og putamen.
det er blevet antaget, at metamfetaminbrug kan prædisponere brugerne for fremtidig udvikling af PD. Denne hypotese er blevet understøttet af det nylige epidemiologiske arbejde, der indikerer, at metamfetaminbrugere har en øget risiko for at udvikle PD. Dette er i overensstemmelse med de vedvarende neurotoksiske virkninger af methamphetamin hos forsøgsdyr (Granado et al., 2013).
patienter med parkinsonisme er ofte vanskelige at håndtere som ambulante patienter. Kompleksiteten af deres symptomer, de tilføjede kognitive og autonome underskud, den dårlige reaktion på de fleste PD-medicin og det relativt hurtige fald i status bidrager til udfordringerne ved håndtering af disse patienter, især når sygdommen skrider frem (Hohler et al., 2012).