Bioorganisk & organisk kemi
hydroborations–iltningsreaktion
cis-tilsætningen af diboran til en alkenbinding giver en yderst nyttig hydratiseringsmetode. Diboran kan genereres ved tilsætning af natriumborhydrid til bortrifluorideterat i tetrahydrofuran eller ether ved 0o-5oC. Diboran er dimeren af Boran (BH3) og er stabil form af dette reagens (Scheme1).
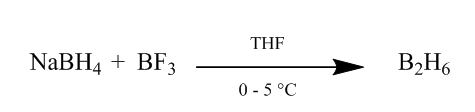
Figur 1 Obtention af Diboran fra natriumborhydrid
tilsætningen af diboran til alken er ekstremt hurtig, og generelt tilføjer reagenset fra de mindre hindrede af de to flader i kur-systemet. Cis-tilføjelsen er blevet rationaliseret af en fire Center overgangsstat. Borankomplekset, der er resultatet af tilsætningen af diboran til en alken, omdannes med tilbageholdelse af stereokemi til en alkohol ved behandling med basisk brintoverilte. 1-methylcycloheksen 1 på hydroboration-oksidering fører således til dannelsen af trans-2-methylcyclo-geksanol 2. Den mekanistiske vej er blevet afbildet i (skema 2). Metoden til omdannelse af Alken til alkohol ved hydroboration-iltning er blevet anvendt til syntese af mange naturlige produkter. Få eksempler er illustreret nedenfor.

figur 2 reaktionsmekanisme til dannelse til trans-2-methylcyclo-geksanol 2
syntese af (kurr) junenol og (kurr) acalomon
anvendelsen af hydroborations-iltningsreaktion blev observeret af Banerjee og kolleger under syntesen3 af eudesmon seskviterpener (kurr) junenol og (kurr) acalomon. For at opnå syntesen af disse sekviterpener blev Alken 3 valgt som udgangsmateriale og underkastet hydroborations-iltning for at give alkoholen 4 (skema 3). Keton 5, opnået ved iltning af alkoholen med Jones-reagens4, blev fremstillet til at reagere med diethylcarbonat. Det resulterende produkt blev behandlet med methyl lithium for at opnå ketol 6, hvis omdannelse til isopropylketon 7 blev udført ved henholdsvis dehydrering og hydrogenering. Metalhydrid reduktion af ketonen efterfulgt af iltning med blytetraacetat5 i cycloheksan gav den cykliske ether 8, som blev omdannet til ketoacid 9 ved iltning med kromsyre og eddikesyre. Decarboksylation med blytetraacetat i pyridin og pyridin efterfulgt af oprensning over 10% AgNO3 imprægneret silicagel, der ydes (liter) acolamon 10. Reduktion af acolamon 10 med natriumborhydrid i methanol efterfulgt af sublimering af det resulterende produkt gav junenol 11.
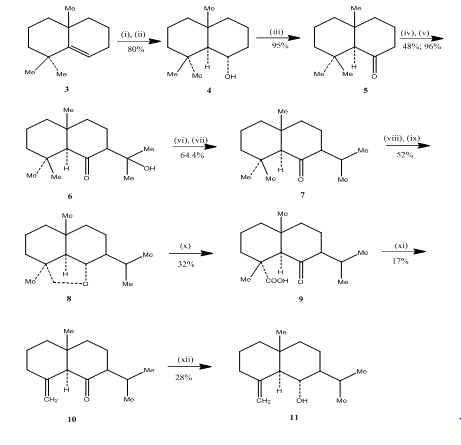
figur 3-syntese af Eudesmon seskviterpener (larr) junenol og (larr) – acalomon
reagenser: (i) BF3.Et2o, NaBH4, THF, 0-5 Karr C; (ii) NaOH (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) NaH, CO(OEt)2, DME; (v) MeLi, Et2o, refluks, 2h; (vi) HCl(Conc), meoh; (VII) H2, pto2, meoh; (viii) Na, EtOH, refluks; (ik)Pb(OAc) 4, C6H12; (C) CrO3, AcOH; (i)Pb(OAc) 4, C6H6, Py, refluks; (II) NaBH4, EtOH.
syntese af pisiferinsyre
anvendelsen af hydroboration-iltning er blevet registreret under syntesen af pisiferinsyre,6 en tricyklisk diterpen, der viser antibakterielle aktiviteter mod alle testede gram-positive bakterier.7 den syntetiske rute er afbildet i skema 4. Hydroboration-iltning af Alken 13, fremstillet ud fra den kendte8 ketoalkohol 12, blev iltet med jones-reagens4 og reduceret henholdsvis med metalhydrid for at give alkohol 14. Iltning med blytraacetat med 250V tungstenlampe gav den cykliske ether 15. Spaltningen af den cykliske ether med sinc, sinciodid og eddikesyre8 møbleret pisiferol 16. Transformationen af pisiferol til esteren 17 blev opnået i seks trin:
- methylering med dimethylsulfat
- iltning med jones-reagens
- esterificering med diasomethan
- reduktion med natriumborhydrid
- Tosylering
- Detosylering
esteren L7 blev omdannet til pisiferinsyre 18 ved opvarmning med aluminiumbromid og ethanthiol.
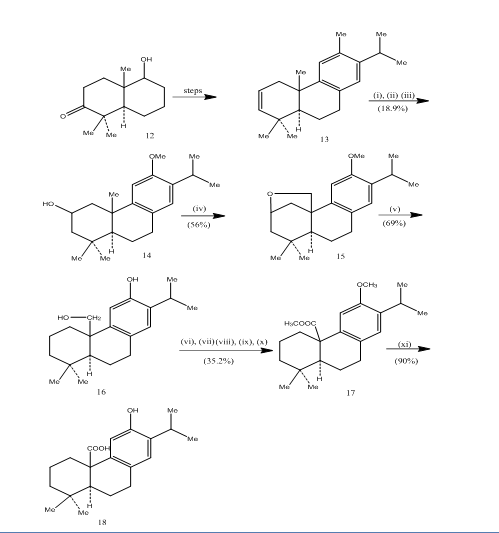
figur 4 syntese af Pisiferinsyre 18
reagenser: (i) BF3. Et2o, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv)Pb(OAc) 4, CaCO3, C6H6, 250V tungstenlampe; (v) NN, Nni, MeCOOH; (vi) MeSO4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; (i) NaBH4, MeOH; () Tscl, Py; (i) NaI, NN dust, DMF; (II)AlBr3, (CH2SH) 2.
hydroborations-iltningsreaktionen er blevet anvendt til syntese af (kurr) eudes-4(14),7(11)-Dien-8-en, 9 taksodion, 10 norditerpenalkoholer11 og mange andre terpener.12 disse eksempler viser tydeligt anvendelsen af bor tifluoridetherat ved omdannelsen af alkenerne til alkoholer og efterfølgende deres omdannelse til terpenoidforbindelserne.
spaltning af epoksider
epoksiderne kan spaltes af flere reagenser. Det er også blevet anvendt til spaltning af epoksider, og i mange tilfælde omlejres det resulterende produkt til keton. Spaltningen af epoksider ledsages også af cyklisering. I denne gennemgang er spaltningen af nogle epoksider med bortrifluoridetherat og anvendelsen af de resulterende produkter i syntesen af naturlige produkter blevet diskuteret.
syntese af 6-metoksi-2-tetralon
spaltningen af epoksid med bortrifluoridetherat er blevet anvendt13 til syntese af 6-metoksi-2-tetralon 20 (skema 5), et vigtigt udvalgt udgangsmateriale til syntese af mange organiske forbindelser. Epoksidering af alkene13 19 efterfulgt af behandling af råproduktet i dichlormethan med bortrifluorideterat gav tetralonen 20 i 36% Udbytte. Når spaltningen blev forsøgt med svovlsyre, blev udbyttet af teralonen 20 forbedret (39%) sammen med dannelsen af andre sekundære produkter, og den kromatografiske oprensning var således meget besværlig.
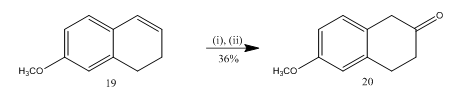
figur 5 syntese af 6-metoksi-2-tetralon 20
reagenser: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
syntese af cuprane
omlejringen af epoksider med bortrifluoridetherat viste sig at være meget nyttig under syntese14 af seskviterpene cuprane. Den syntetiske rute er beskrevet i skema 6. 6,6-dimethyl-1-p-tolylcycloheksen 21 Ved epoksidering gav epoksiden 22 i godt udbytte, som ved behandling med bortrifluoridetherat gav aldehydet 23 i lavt udbytte. Det er nødvendigt at tage hensyn til, at der ikke er nogen grund til, at der ikke er nogen grund til at tro, at der ikke er nogen grund til at tro, at der ikke er nogen grund til at tro, at der ikke er nogen grund til at gøre det. Syntesen er attraktiv på grund af dens kortfattethed i trin. De betingelser, der anvendes til omlægningen af epoken 22, er kritiske, fordi den har tendens til at gennemgå yderligere omlægning til ketonen 25.
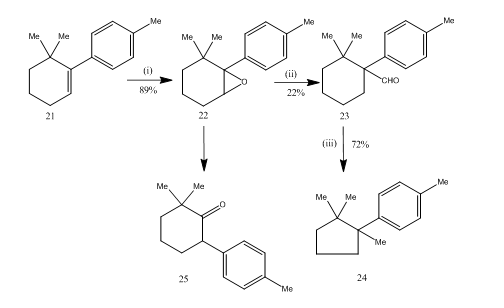
figur 6 syntese af cuprane
reagenser: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
syntese af karahana-ether
Bortrifluoridetherat blev også anvendt til spaltning af epoke15 af karahana-ether, en flygtig monoterpen, der blev isoleret16 fra Japansk humle. Den syntetiske rute er beskrevet i skema 7. 27, opnået fra Dien 26, efter at være blevet behandlet med bortrifluoridetherat, gennemgik cyklisering, hvilket gav produktet 28. Cykliseringen forekom sandsynligvis gennem mellemproduktet 27 (i). Metalhydridreduktion gav diol, som ved tosylering gav karahanaether 29. Udbyttet er uspecificeret. Spaltningen af epoksider er blevet anvendt til syntese af mange terpener som rosenolacton,17 cyperolon,18 maritimol.19
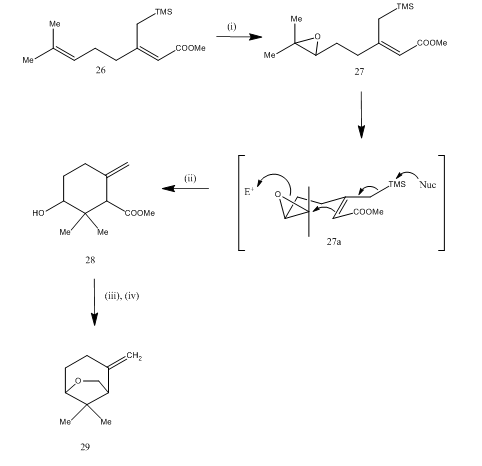
Figur 7 syntese af Karahanaether
reagenser: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
esterificering
esterificering er en hyppigt anvendt reaktion til syntese af mange organiske forbindelser. Bortrifluoridetherat-alkohol er et meget bekvemt reagens til esterificering af mange p-aminosyrer, aromatiske, heterocykliske og umættede syrer.20 i nogle esterificeringsreaktioner tilvejebragte anvendelsen af dette reagens overlegen udbytte sammenlignet med andre reagenser. Nogle eksempler er givet i skema 8. Syrerne 30-32 blev omdannet til henholdsvis esterne 33-35 i højt udbytte ved behandling med bortrifluoridetherat-alkoholreagens. Marshall og samarbejdspartnere21 brugte det samme reagens til esterificering af carboksyl syrer. Dymicky22 fremstillede flere formater i højt udbytte fra myresyre og alkohol i nærvær af en katalytisk mængde bortrifluorid-methanolkompleks. De andre katalysatorer, f.eks. svovlsyre, p-toluensulfonsyre, var ikke så effektive som bortrifluorid – methanolkompleks.
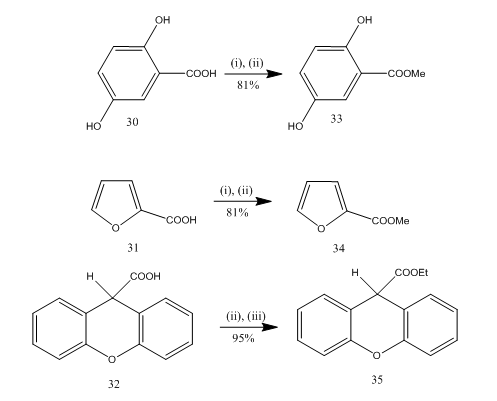
figur 8 esterificering af syrer 32-35
reagenser: (i) MeOH; (ii) BF3. Et2O; iii) EtOH
Jackson og collaborators23 har udviklet en effektiv metode til omdannelse af alkoholer 37-39 og syrer 40-42 direkte til de tilsvarende t-butylderivater i godt udbytte ved anvendelse af t-butyltrichloracetimidat 36 i nærvær af en katalytisk mængde bortrifluorideterat som vist i skema 9. Denne metode fungerer bedre med de syrefølsomme grupper end de traditionelle metoder, der bruger isobuten. Mindre hindret hydroksylgruppe af en diol kan beskyttes og er også egnet til arbejde i mindre skala (undgå aflevering af gasformig isobuten). T-butyl-2,2,2-trichloracetimidatet 36 fremstilles let ved tilsætning af t-butanol til trichloracetonitril. De fleste af forsøgene blev udført i nærvær af en blanding af dichlormethan og cycloheksan. Eddikesyreanhydrid i nærvær af bortrifluoridetherat er blevet anvendt til acetylering af hydroksylgruppen.24

figur 9 omdannelse af alkoholer og syrer fra T-butylderivater.
reagenser: 36, (i) BF3.Et2o, (ii) CH2Cl2, C6H12
cyklisering
bortrifluoridetheratet har spillet en vigtig rolle i cyklisering af mange, carboksyliske syrer, allener osv. De følgende få eksempler illustrerer bortrifluoridetherats rolle som cykliseringsmiddel. Syrechloridet 49 og Alken 50 blev kondenseret til opnåelse af divinylketon25 51,som gennemgik cyklisk cyklisering26, 27 møblering cyklisk keton 52, som blev omdannet til sekviterpentrichodien 53 (skema 10).
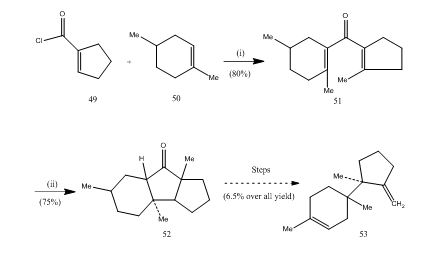
Figur 10 syntese af seskviterpen trichodien 53
reagenser: (i) SnCl4, NaOMe; (ii) BF3Et2O
flere allenylarylketoner gennemgår cyklisering med bortrifluorideterat, der giver methylencyclopentenon via en ny 5-endo-mode cyklisering.28 ketonerne 54-56 gav hhv.57-59 (Skema 11). Sandsynligvis skete transformationen som vist i cykliseringen af allenyl arylketon 54 Til 57. Det kan observeres, at tilstedeværelsen af substituentgrupper i aromatisk ring bestemmer udbyttet af det cykliske produkt. Kos og Loeventhal28 rapporterede cykliseringen af syren 60 med bortrifluoridetherat til ketonen 61, som blev omdannet gibberon 62 (Skema 12) i tre trin:
- Ketalisering
- Huang-minlon reduktion og
- syrehydrolyse. De ovennævnte eksempler udviser anvendelsen af bortrifluoridetherat i cykliseringen af organiske forbindelser
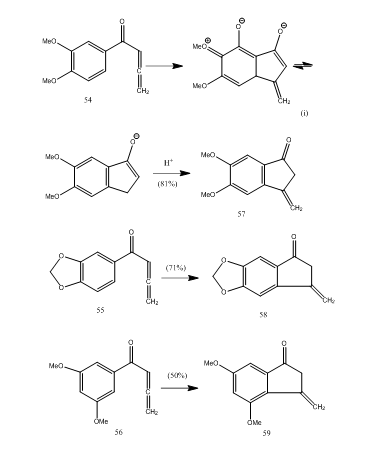
Figur 11 syntese af Cyclopentenoner

Figur 12 syntese over for gibberon
reagenser: (i) BF3. Et2O; (ii) (A) C2H6O2; (b) DEG, N2H4, KOH, 190-200 liter C; (c) H+