ATrain Education
ačkoli se každý den učíme více o patofyziologii Parkinsonovy choroby, je stále považována za převážně idiopatickou (neznámé příčiny). Pravděpodobně zahrnuje interakci citlivosti hostitele a faktorů prostředí. Malé procento případů je geneticky spojeno a genetické faktory jsou intenzivně studovány.
fyziologicky jsou příznaky spojené s Parkinsonovou chorobou výsledkem ztráty řady neurotransmiterů, zejména dopaminu. Symptomy se časem zhoršují, protože stále více buněk postižených onemocněním se ztrácí. Průběh onemocnění je velmi variabilní, u některých pacientů se s věkem projevuje jen velmi málo příznaků a u jiných, jejichž příznaky rychle postupují.
Parkinsonova choroba je stále více vnímána jako komplexní neurodegenerativní onemocnění se sekvencí progrese. Tam je silný důkaz, že to první má vliv na dorzální motorické jádro n. vagus a čichové žárovky a jádra, pak locus coeruleus, a nakonec substantia nigra. Kortikální oblasti mozku jsou postiženy v pozdější fázi. Poškození těchto různých neuronálních systémů účet pro multi-tváří patofyziologických změn, které způsobují znehodnocení nejen pohybový systém, ale také na kognitivní a neuropsychologické systémy (Kwan & Whitehillů, 2011).
Úloha Dopaminu
Dopaminu, stejně jako ostatní neurotransmitery, vysílá chemické zprávy z jedné nervové buňky do druhé přes synapse, prostor mezi presynaptickým a buněk a postsynaptického receptoru. Dopamin se vylučuje do synapse z membránových akumulačních váčků v presynaptické membráně. Prochází synapsí a váže se na postsynaptickou membránu, kde aktivuje dopaminové receptory. Nevyužité dopamin zůstávají v synapse je absorbován zpět do presynaptické buňky; po návratu do presynaptické buňky, přebytek dopaminu je zabaleny do skladu váčků a vydal ještě jednou do synapse.
v synapse, protože dopamin putuje z jedné buňky do druhé, může být štěpen a neaktivní dvěma enzymy, MAO (monoaminooxidáza) a COMT (katechol-O-methyltransferáza). Jedna terapeutická strategie zavádí do synapse inhibitor MAO, který přerušuje působení enzymu MAO a zabraňuje rozpadu dopaminu. To umožňuje více dopaminu zůstat v synapse a zvyšuje pravděpodobnost, že se bude vázat na postsynaptickou membránu.
chemický synaptický přenos
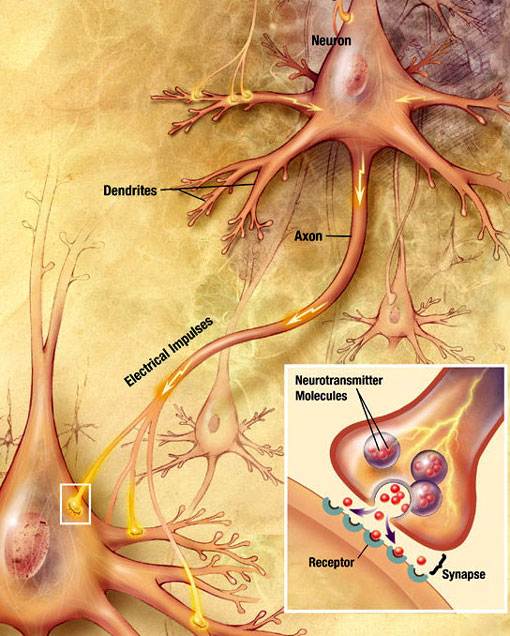
elektrochemická vlna zvaná akční potenciál cestuje podél axonu neuronu. Když akční potenciál dosáhne presynaptického terminálu, to vyvolává uvolnění malého množství neurotransmiter molekuly, které se váží na chemické molekuly receptoru se nachází v membráně postsynaptického neuronu, na opačné straně synaptické štěrbiny. Zdroj: Wikimedia Commons.
Progresivní Ztráta Dopaminu
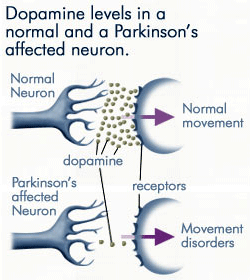
Jako méně a méně dopamin je produkován neurony postiženy Parkinsonovou chorobou, daleko méně dopaminu je k dispozici vázat na dopaminové receptory na postsynaptické membráně. Zdroj: anti-agingfirewalls.com.
i když dopaminové buňky ztrátu nelze měřit přímo, měření v neurologicky normálních lidí a primátů ukazují pomalé progresivní ztráta dopaminu s věkem. U Parkinsonovy choroby dochází ke ztrátě mnohem vyšší rychlostí a biochemická opatření i zobrazovací studie naznačují, že v době, kdy se objeví motorické příznaky, dochází k významnému poklesu dopaminu. Z tohoto pohledu je Parkinsonova choroba zrychlenou verzí buněčné smrti pozorované při normálním stárnutí (Cookson, 2009). To je znázorněno na následujícím grafu, který ukazuje pokles dopaminergních neuronů během normálního stárnutí, u idiopatické PD, u PD způsobené environmentálními nebo genetickými faktory a u PD s časným nástupem.
Vývoj Vyčerpání Dopaminu u Parkinsonovy Choroby
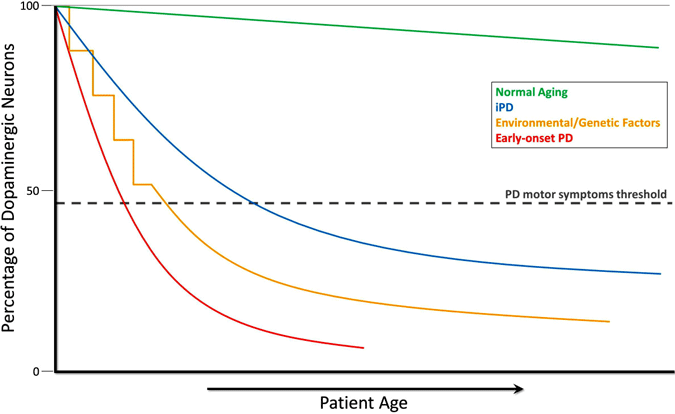
v Průběhu normálního stárnutí (zelená linka), malý, ale pomalý dopaminergní degeneraci dochází bez jakékoliv motorické příznaky. Idiopatická PD (IPD, modrá čára), je neznámého původu, ale předpokládá se, že postupně rozvíjet, s pomalou degeneraci dopaminergních neuronů, což vede k klasický PD motor příznaky, později v životě. Další model dopaminu neurodegeneraci, což vede k PD motorické příznaky zahrnuje opakovaná expozice do životního prostředí toxické látky v průběhu času v kombinaci s genetickou predispozicí k dopaminergní neuron ztráty (žlutá čára). Počátek PD (červená čára), jak je způsobena mutací v genu PARKIN, zahrnuje strmý pokles dopaminergní neurony, a PD motorické příznaky mohou představovat desetiletí před těmi, u idiopatické PD. Ještě jeden scénář (není zobrazeno) PD motor příznakem rozvoje zahrnuje možné v děloze životního prostředí toxické látky nebo genetické faktory vedoucí k atypicky nízký počet dopaminergních neuronů při narození a zvýšená náchylnost k PD rozvoj (Haas et al., 2012).
degenerace dopaminových neuronů je zvláště patrná v části substantia nigra zvané pars compacta. Výrazně, ztráta dopaminu v pars compacta zvyšuje celkovou excitační disk v bazálních gangliích,* dobrovolné přerušení řízení motoru a způsobuje charakteristické příznaky PD. Normalizace motorické funkce je zpočátku pozorována při léčbě levodopou (Gasparini et al ., 2013).
*hlavní komponenty bazální ganglia jsou striatum (nucleus caudatus a putamen), globus pallidus, substantia nigra, nucleus accumbens, a subtalamická jádra.
Jako závažnost PD zvyšuje, vyčerpání dopaminu vede k další změny v bazálních gangliích drah, včetně změněné funkce jiných bazálních ganglií neurotransmiterů, jako je glutamát, GABA a serotoninu (Gasparini et al., 2013). I když tam je relativní zranitelnost neurony produkující dopamin v substantia nigra, ne všechny dopaminové buňky jsou postiženy u Parkinsonovy choroby; v některých částech mozku dopamin produkující neurony jsou relativně ušetřeny (Cookson, 2009).
Nigrostriatální dráha
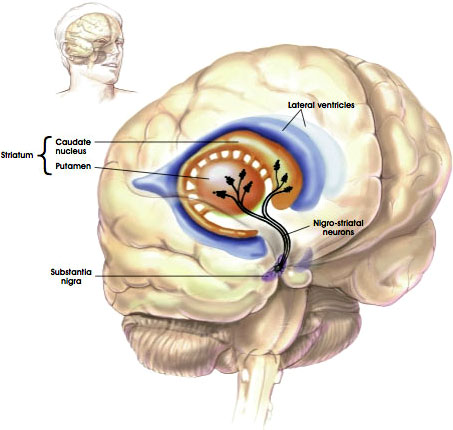
Zdroj: NIH, n.d.
Lewyho tělísky a Alfa-Synuclein
Lewyho tělísky jsou abnormální agregátů a inkluzí bílkovin, které se vyvíjejí uvnitř nervových buněk u lidí s Parkinsonovou chorobou. Agregace se obvykle skládají z nerozpustných fibrilárních agregátů obsahujících nesprávně složené proteiny. V Lewyho tělech bylo identifikováno velké množství molekul, ale hlavní složkou je protein zvaný alfa-synuklein.
Lewyho tělísky (Alfa-Synuclein Inkluze)
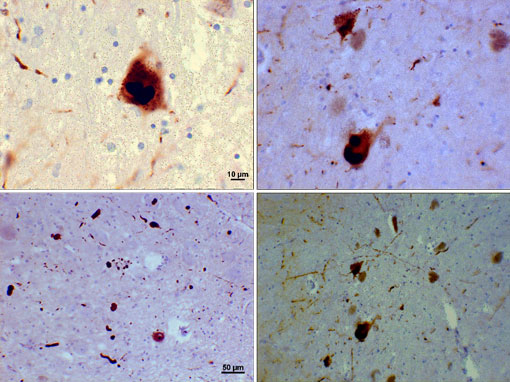
Photomicrograph z oblasti substantia nigra u Parkinsonovy pacient ukazuje Lewyho tělísky a Lewyho neuritů v různých přiblíženích. Horní panely ukazují 60x zvětšení alfa-synuclein certifikovaná inkluze agregovány tvoří Lewyho tělísky. Spodní panely jsou snímky zvětšení 20×, které ukazují vláknité Lewyho neurity a zaoblené Lewyho těla různých velikostí. Obrázky se svolením Suraj Rajan.
Lewyho patologie zahrnuje mnoho oblastí mozku a některé zprávy naznačují, že substantia nigra není první místo, kde Lewyho tělísky v podobě Parkinsonovy choroby. Inkluze a agregáty pravděpodobně symbolizují konečnou fázi kaskády komplikovaných událostí. Dřívější fáze může být přímo spojena s patogenezí poruchy než samotné inkluze, které mohou nebo nemusí představovat diagnostické znaky.
Lewyho těla jsou také pozorována u „demence s Lewyho těly“, což naznačuje, že tyto stavy spolu souvisejí sdílenou patologií a případně sdílenou etiologií. Ani ztráta buněk, ani tvorba Lewyho těl nejsou absolutně specifické pro PD, ale obě jsou vyžadovány pro diagnózu PD podle současných definic (Cookson, 2009).
Neurodegenerativních poruch, jako je Alzheimerova nemoc, frontální-temporální degenerace, infekční choroba, Huntingtonova chorea, onemocnění motoneuronu jsou stále více realizovány společné buněčné a molekulární mechanismy, včetně bílkovin agregace a zařazení tělesné formace v určitých oblastech nervové soustavy (Jellinger, 2011).
zánět a imunitní odpověď
spoušť dopaminergní degenerace se zdá být multifaktoriální-ovlivněna jak endogenními, tak environmentálními prvky. Zánět a imunitní reakce jsou stále více považovány za důležité mediátory dopaminergní degenerace. Velké populační studie naznačují, že jedinci užívající nesteroidní protizánětlivé léky (Nsaid) mají nižší riziko vzniku idiopatické PD, což naznačuje, že protizánětlivé léky, může být slibnou nemoc-modifikovat léčby pro pacienty s parkinsonovou nemocí (Barcia, 2013).
Nový zkušební fáze zahrnovala anti-pobuřující léčby—hledá speciálně pro objektivní biomarker v léčbě zaměřené na snížení zánětlivých změn u pacientů s PD. Vědci používají neuroimagingové nástroje k vývoji relevantního biomarkeru s úmyslem testovat to ve velkých klinických zobrazovacích studiích. Výsledky těchto zkoušek bude poskytovat data pro testování a monitorování progrese anti-pobuřující léčby PD a pomůže identifikovat včasné terapeutické okno zastavit, nebo alespoň zpomalit, zánětlivé-zprostředkované dopaminergní degeneraci (Barcia, 2013).
Parkinsonismus
Parkinsonismus, také známý jako „atypické Parkinsona,“ „sekundární Parkinsonova nemoc,“ nebo „Parkinsonova syndromu,“ je neurologický syndrom, ve kterém se pacient vykazuje některé z příznaků spojených s Parkinsonovou nemoci—tremor, rigidita, bradykineze a posturální nestabilita. Ale parkinsonismus není Parkinsonova choroba. Předpokládá se, že parkinsonismus není způsoben Parkinsonovou chorobou a pacienti obvykle špatně reagují na farmakologickou intervenci. Parkinsonismus má často identifikovatelnou příčinu, jako je expozice toxinům, metamfetaminu, trauma, mnohočetné mrtvice, jiné poruchy nervového systému nebo nemoci. Obecně, Lewyho těla nejsou vidět v parkinsonismu.
termín parkinsonismus je také spojena s poruchami, jako jsou progresivní supranukleární obrna, mnohočetné systémové atrofie, Lewy body demence, corticobasal degenerace, vaskulární parkinsonismus, léky a drogami vyvolaný parkinsonismus, a parkinsonismus sekundární infekce a jiných příčin (Hohler et al., 2012). Forma reverzibilního parkinsonismu může nastat při použití určitých neuroleptik, zejména reserpinu, antipsychotik (haloperidolu) a metoklopramidu. Vystavení určitým toxinům, těžké otravě oxidem uhelnatým a otravě rtutí může také vést k parkinsonismu.
vzhled na začátku roku 1980 parkinsonismu příznaky ve skupině drogově závislých, kteří konzumovali kontaminované šarže syntetický opiát vedla k objevu chemické látky MPTP jako agent, který způsobuje syndrom parkinsonismu v subhumánních primátů, stejně jako u lidí. MPTP může být produkován při výrobě formy heroinu (MPTP je přeměněn na neurotoxin, který selektivně ničí dopaminové buňky v substantia nigra). Tyto případy jsou vzácné a většinou postihly dlouhodobé uživatele drog.
zneužívání metamfetaminu bylo také spojeno s parkinsonismem. U pokusných zvířat, expozice metamfetaminu škody dopaminergní vlákna ve striatu* stejně jako těla buněk v substantia nigra, odrážet degenerace pozorována u lidských pacientů s PD. Selektivní poškození dopaminergních ve striatu byl také pozorován v lidské uživatelů metamfetaminu, ačkoli není tam žádný důkaz tak daleko, že zneužívání metamfetaminu poškození dopaminergních buněk těla v substantia nigra (Granado et al., 2013).
*největší jádra bazálních ganglií, striatum se skládá z nucleus caudatus a putamen.
předpokládalo se, že užívání metamfetaminu může uživatele predisponovat k budoucímu vývoji PD. Tato hypotéza byla podpořena nedávné epidemiologické práce, což naznačuje, že uživatelé metamfetaminu mají zvýšené riziko vzniku PD. To je v souladu s přetrvávajícími neurotoxickými účinky metamfetaminu u pokusných zvířat (Granado et al ., 2013).
pacienti s parkinsonismem jsou často obtížně léčitelní jako ambulantní pacienti. Složitost jejich příznaky, větší kognitivní a vegetativní deficity, špatná odpověď na většinu PD léky, a relativně rychlý pokles stavu přispívají k problémům v řízení těchto pacientů, zvláště když nemoc postupuje (Hohler et al., 2012).