Bioorganická A Organické Chemie
Hydroboration–oxidační reakce
cis přidání diborane na to alken vazba poskytuje velmi užitečný způsob hydratace. Diboran může být generován přidáním borohydridu sodného k etherátu fluoridu boru v tetrahydrofuranu nebo etheru při 0o-5oC. Diboran je dimer boranu (BH3) a je stabilní formou tohoto činidla (Scheme1).
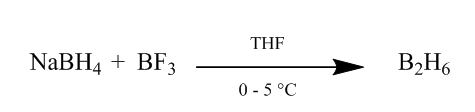
Obrázek 1 Uhrazených z Diborane z borohydrid sodný
přidání diborane na z alken je velmi rychlý a obvykle činidla se přidává z méně brání dvě tváře π systému. Přidání cis bylo racionalizováno přechodným stavem čtyř center. Na boranu komplex vyplývající z přidání diborane na to alken je převeden, s výhradou uvedení stereochemie, na alkohol při léčbě základní peroxidu vodíku. Tak 1-methylcyklohexen 1 na hydroborační oxidaci vede k tvorbě trans-2-methylcyklo-hexanolu 2. Mechanistická cesta byla znázorněna v (Schéma 2). Metoda přeměny alkenu na alkohol hydroborací-oxidací byla použita pro syntézu mnoha přírodních produktů. Několik příkladů je ilustrováno níže.

Obrázek 2 Reakce mechanismus pro vytvoření trans-2-methylcyclohexanol 2
Syntéza (±) junenol a (±) acalomone
použití hydroboration-oxidační reakce byl sledován Banerjee a spolupracovníky během synthesis3 z eudesmone seskviterpeny (±) junenol a (±) acalomone. Za účelem dosažení syntézy těchto seskviterpenů byl Alken 3 vybrán jako výchozí materiál a podroben hydroboraci-oxidaci za vzniku alkoholu 4 (Schéma 3). Keton 5, získaný oxidací alkoholu Jonesovým činidlem4, byl vyroben tak, aby reagoval s diethylkarbonátem. Výsledný produkt byl zpracován methyl lithiem, aby se získal ketol 6, jehož přeměna na isopropylketon 7 byla provedena dehydratací a hydrogenací. Metal-hydridové snížení keton následuje oxidace olova tetraacetate5 v cyklohexanu poskytované cyklický ether 8, který byl převeden do ketoacid 9 oxidací se kyselina chromová a kyselina octová. Dekarboxylace se vést tetraacetate v benzenu a pyridinu následuje čištění nad 10% AgNO3 impregnovaný silikagel poskytnuta (±) acolamone 10. Redukce akolamonu 10 borohydridem sodným v methanolu, následovaná sublimací výsledného produktu, se získá junenol 11.
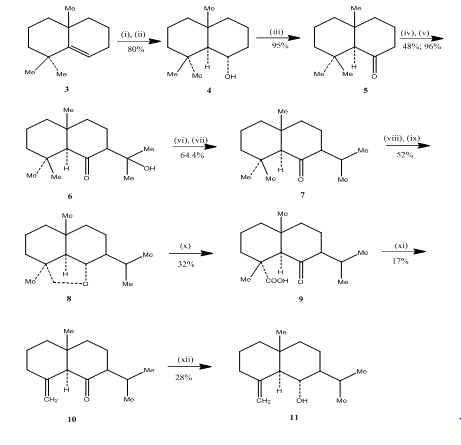
Obrázek 3 Syntéza eudesmone seskviterpeny (±) junenol a (±)-acalomone
Činidla: (i) BF3.Et2O, NaBH4, THF, 0-5°C; (ii) NaOH (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) Ne, CO(OEt)2, DME; (v) MeLi, Et2O, reflux, 2h; (vi) HCl(konc), MeOH; (vii) H2, PtO2, MeOH; (viii) Na, EtOH, reflux; (ix) Pb(OAc)4, C6H12; (x) CrO3, AcOH; (xi) Pb(OAc)4, C6H6, Py, šťáv; (xii) NaBH4, EtOH.
Syntéza pisiferic kyseliny
použití hydroboration-oxidace byl zaznamenán během syntézy pisiferic kyseliny,6 a tricyklická diterpenu který ukazuje antibakteriální aktivity proti gram-pozitivní bakterie testovány.7 syntetická trasa byla znázorněna ve schématu 4. Hydroboration-oxidace z alken 13, připravené z known8 ketoalcohol 12, byl oxidovaný jones reagent4 a snížení, respektive s metal-hydridové dát alkohol 14. Oxidace tetraacetátem olovnatým v benzenu s 250W wolframovou lampou poskytla cyklický ether 15. Štěpení cyklického etheru zinkem, jodidem zinečnatým a kyselinou octovou8 zařízený pisiferol 16. Transformace pisiferolu na ester 17 byla dosažena v šesti krocích:
- Metylace s dimethyl sulfát
- Oxidace s jonesem činidla
- Esterifikace s diazomethane
- Redukce s borohydrid sodný
- Tosylation
- Detosylation
ester l7 byl převeden do pisiferic kyseliny 18 zahříváním s hliníkovou bromid a ethanu thiol.
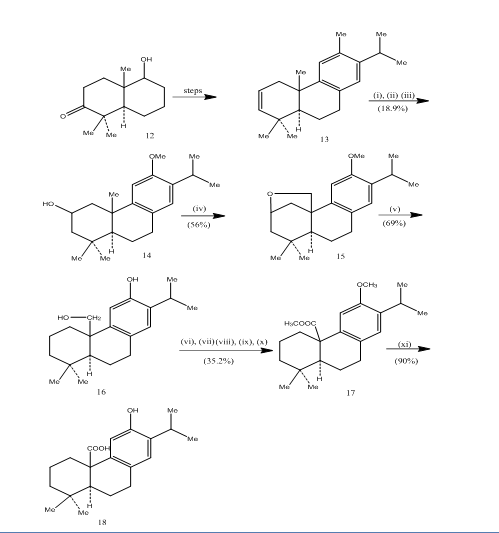
Obrázek 4 Syntéza pisiferic kyseliny 18
Činidla: (i) BF3.Et2O, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv) Pb(OAc)4, CaCO3, C6H6, 250w wolframové lampy; (v) Zn, ZnI, MeCOOH; (vi) MeSO4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; (ix) NaBH4, MeOH; (x) TsCl, Py; (xi) NaI, Zn prach, DMF; (xii) AlBr3, (CH2SH)2.
Na hydroboration-oxidační reakce byla použita pro syntézu (±) eudes-4(14),7(11)-dien-8 -, 9 taxodione,10 norditerpene alcohols11 a mnoho dalších terpenů.12 tyto příklady jasně ukazují použití etherátu tifluoridu boru při přeměně alkenů na alkoholy a následně jejich přeměně na terpenoidní sloučeniny.
štěpení epoxidů
epoxidy lze štěpit několika činidly. Lewis kyselina borontrifluoride etherate byl také použit pro štěpení epoxidy a v mnoha případech výsledný produkt přeskupí na keton. Štěpení epoxidů je také doprovázeno cyklizací. V této recenzi štěpení některé epoxidy s bor trifluoride etherate a využití výsledných produktů při syntéze přírodních produktů, které byly projednány.
Syntéza 6-methoxy-2-tetralone
štěpení epoxidového bórem trifluoride etherate byl utilized13 pro syntézu 6-methoxy-2-tetralone 20 (Schéma 5), důležitou vybrané výchozí materiál pro syntézu mnoha organických sloučenin. Epoxidace alkene13 19 následovaná zpracováním surového produktu v dichlormethanu etherátem trifluoridu boritého poskytla tetralonu 20 ve 36% výtěžku. Při pokusu o štěpení kyselinou sírovou byl výtěžek teralonu 20 zlepšen (39%) spolu s tvorbou dalších sekundárních produktů, a tak bylo chromatografické čištění velmi pracné.
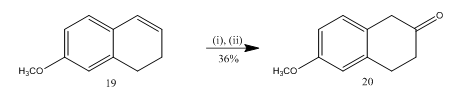
Obrázek 5 Syntéza 6-methoxy-2-tetralone 20
Činidla: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
Syntéza cuprane
přeskupení epoxidy tím, bor trifluoride etherate se ukázalo jako velmi užitečné během synthesis14 z seskviterpenové cuprane. Syntetická cesta je popsána ve schématu 6. 6,6-dimethyl-1-p-tolylcyclohexene 21 na epoxidation poskytnuta epoxidovou 22 v dobrém výtěžku, který na zacházení s bor trifluoride etherate v benzenu se získá aldehyd 23 v nízký výnos. Semikarbazon aldehydu byl zahříván hydroxidem draselným, aby poskytl seskviterpen cupran 24 v přijatelném výtěžku. Syntéza je atraktivní díky své stručnosti v krocích. Podmínky použité pro přeskupení epoxidu 22 jsou kritické, protože má tendenci podstupovat další přeskupení na keton 25.
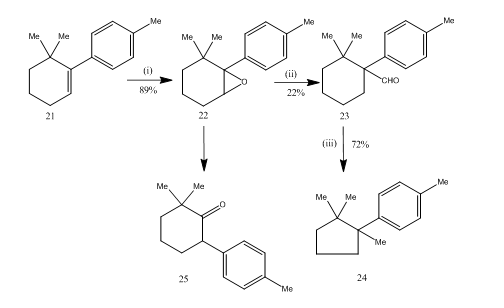
Obrázek 6 Syntéza cuprane
Činidla: (i) PhCO3H, Chci3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
Syntéza (±) karahana ether
Bor trifluoride etherate byl také použit pro štěpení epoxidového během synthesis15 z karahana éteru, těkavé monoterpene který byl isolated16 z Japonské chmele. Syntetická cesta je popsána ve schématu 7. Na epoxidovou 27, získané z dien 26, na léčeni bor trifluoride etherate té cyclization výtěžkem produktu 28. K cyklizaci pravděpodobně došlo prostřednictvím meziproduktu 27 (i). Redukce hydridu kovu poskytla diol, který při tosylaci poskytl karahanaether 29. Výnos je nespecifikovaný. Štěpení epoxidů bylo použito pro syntézu mnoha terpenů, jako je rosenolakton, 17 cyperolon, 18 maritimol.19
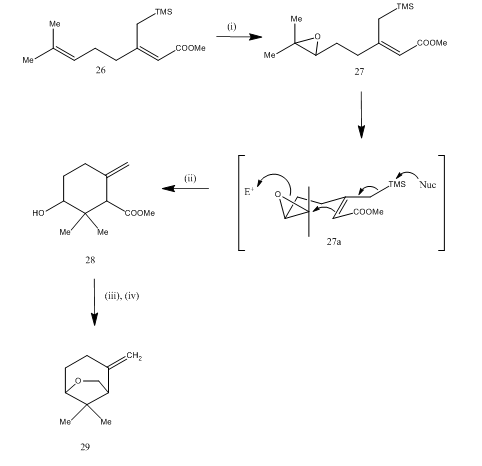
Obrázek 7 Syntéza (±) Karahana ether
Činidla: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
Esterifikace
Esterifikace je často používaná reakce pro syntézu mnoha organických sloučenin. Etherát trifluoridu boru-alkohol je velmi vhodným činidlem pro esterifikaci mnoha P-aminobenzoových kyselin, aromatických, heterocyklických a nenasycených kyselin.20 v některých esterifikačních reakcích poskytlo použití tohoto činidla vyšší výtěžek ve srovnání s jinými činidly. Některé příklady jsou uvedeny ve schématu 8. Kyseliny 30-32 byly převedeny na estery 33-35 ve vysokém výtěžku při zpracování činidlem etherát-alkohol-Trifluorid boritý. Marshall a spolupracovníci21 použili stejné činidlo pro esterifikaci karboxylových kyselin. Dymicky22 připravil několik formátů ve vysokém výtěžku z kyseliny mravenčí a alkoholu v přítomnosti katalytického množství komplexu fluorid-methanol Bor. Ostatní katalyzátory, např. kyselina sírová, kyselina p-toluensulfonová, nebyly tak účinné jako komplex fluorid – methanol Bor.
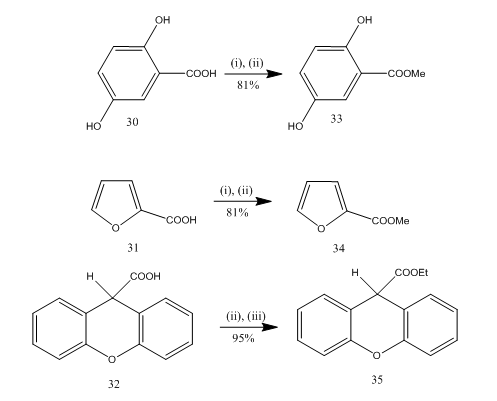
Obr. 8 Esterifikace kyselin 32-35
Činidla: (i) MeOH; (ii) BF3.Et2O; (iii) EtOH
Jackson a collaborators23 vyvinuli účinnou metodu pro konverzi alkoholy 37-39 a kyseliny 40-42 přímo na odpovídající t-butyl derivátů v dobrém výtěžku pomocí t-butyl trichloroacetimidate 36 v přítomnosti katalytického množství boru trifluoride etherate jak se projevuje ve Schématu 9. Tato metoda funguje lépe se skupinami citlivými na kyselinu než tradiční metody používající isobuten. Méně bráněná hydroxylová skupina diolu může být chráněna a je také přístupná práci v malém měřítku(vyhýbá se předávání plynného isobutenu). T-butyl 2,2,2-trichloracetimidát 36 se snadno připraví přidáním t-butanolu k trichloracetonitrilu. Většina experimentů byla provedena za přítomnosti směsi dichlormethanu a cyklohexanu. Pro acetylaci hydroxylové skupiny byl použit anhydrid kyseliny octové v přítomnosti etherátu fluoridu boritého.24

obrázek 9 přeměna alkoholů a kyselin z derivátů t-butyl.
činidla: 36, (i)BF3.Et2O, (ii) CH2Cl2, C6H12
Cyclization
boru trifluoride etherate hraje důležitou roli v cyclization mnoha, karboxylové kyseliny, allenes atd. Několik následujících příkladů bude ilustrovat roli etherátu fluoridu boritého jako cyklizačního činidla. Kyselina chlorid 49 a z alken 50 byly kondenzované, aby výnos divinyl ketone25 51, které prošly Nazarov cyclization26,27 vybavení cyklický keton 52, který byl převeden na seskviterpenové trichodiene 53 (Schéma 10).
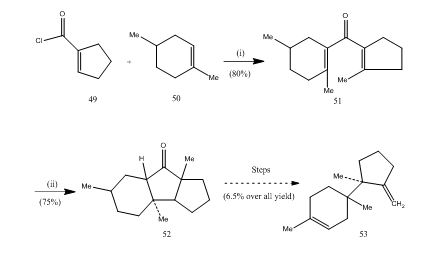
Obrázek 10 Syntézu seskviterpenové trichodiene 53
Činidla: (i) SnCl4, NaOMe; (ii) BF3Et2O
Několik allenyl aryl ketony podstoupit cyclization bórem trifluoride etherate poskytuje methylen benzocyclopentenone přes nový 5-endo-režim cyclization.28 ketony 54-56 poskytly benzocyklopentenony 57-59 (schéma 11). Pravděpodobně k transformaci došlo, jak je ukázáno v cyklizaci allenyl arylketonu 54 na 57. Lze pozorovat, že přítomnost substituentních skupin v aromatickém kruhu určuje výtěžek cyklizovaného produktu. Kos a Loewenthal28 hlášeny cyclization kyseliny 60 s bor trifluoride etherate na keton 61, který byl převeden gibberone 62 (Schéma 12) ve třech krocích:
- Ketalization
- Huang-Minlon snížení a
- Kyselé hydrolýze. Výše uvedené příklady vykazují použití boru trifluoride etherate v cyclization organických sloučenin
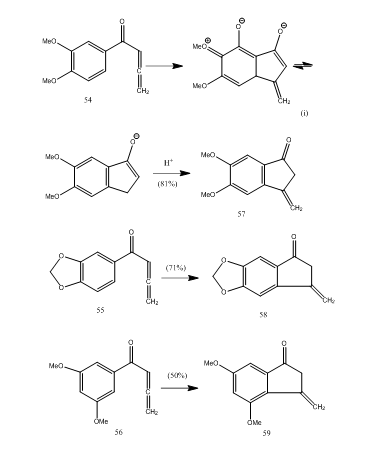
Obrázek 11 Syntézu Cyclopentenones

Obrázek 12 Syntézy gibberone
Činidla: (i) BF3.Et2O; (ii) (a) C2H6O2; (b) DEG, N2H4, KOH, 190-200°C; (c) H+