MO pro HF
Molekulové Orbitaly pro Heterogenní Diatomic Molekul
jednoduchý přístup k molekulární orbital (MO) teorie pro heterogenní diatomic molekul je ukázat energetické úrovni diagramu. MO energetické hladiny může být zpracován v návaznosti na tyto kroky:
Připomeňme si, že energie \(E_n\) pro kvantová čísla n je prvek s atomovým Z je přibližně
\
použijeme \(Z_{eff}\) namísto „z“, aby znamenat, že musíme změnit atomové číslo získat efektivní atomové poplatek za jádro. Protože máme co do činění s přibližnými hodnotami, lze použít Z přímo. 1s orbital energetické úrovni je -13.6 eV pro atomy vodíku, měřená jako ionizační energie H.
Tak, pro kvantové číslo n = 1, úroveň energie za 1s je přibližně 54 eV. Podobně je energetická hladina 1s pro F-1101 eV. Energetické hladiny 2s a 2p pro He jsou přibližně-13,6 eV, což je simlar k 1s orbitalu h.
energetická hladina 2s pro Li je tedy přibližně -6 eV. Pro atomy s více elektrony však mají p-subshell a s-subshell různé energie v důsledku penetrace. Na této úrovni o tom nemůžeme být přesní, ale jednoduše si myslíme, že 2p orbitaly jsou na vyšší energii než 2S orbital. Obvykle se atomové orbitaly s energetickými hladinami podobnými navzájem překrývají a vytvářejí molekulární orbitaly. Porovnáme tedy energetické hladiny atomových orbitalů a pak z nich vytvoříme vazby a anti-vazby MOs.
avšak v případě, že je atomová orbitální energetická hladina velmi odlišná, používáme atomové orbitaly neúplné podshellu k vytvoření MOs.
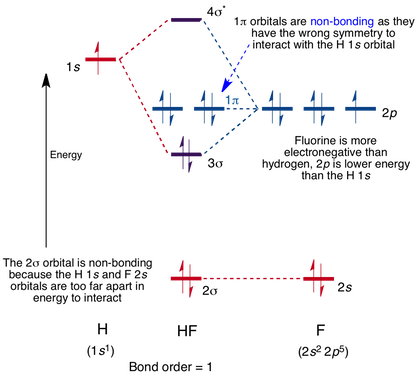
Molekulární Orbitální Diagram pro HF Molekula
Interakce dochází mezi orbitalu 1s na vodíku a 2p orbital v fluoru způsobuje vznik sigma-lepení a sigma-antibonding molekulární orbital, jak je uvedeno níže.