16.10: Elektrophile Addition: 1,2- Versus 1,4-Addition
Additionsreaktionen isolierter Diene verlaufen mehr oder weniger erwartungsgemäß aus dem Verhalten einfacher Alkene. Behandelt man also ein Moläquivalent 1,5-hexadien mit einem Äquivalent Brom, so erhält man ein Gemisch aus 5,6-Dibrom-1-hexen, 1,2,5,6-tetrabromhexan und nicht umgesetztem Dien, wobei die Dibromverbindung das Hauptprodukt ist (ca.50%)
fig
Ähnliche Reaktionen konjugierter Diene ergeben dagegen oft unerwartete Produkte. Die Addition von Brom an 1,3-Butadien ist ein Beispiel. Wie unten gezeigt, wird ein etwa 50:50 Gemisch aus 3,4-Dibrom-1-buten (das erwartete Produkt) und 1,4-Dibrom-2-buten (hauptsächlich das E-Isomer) erhalten. Die letztere Verbindung ist insofern bemerkenswert, als die verbleibende Doppelbindung an einer Stelle gefunden wird, an der keine Doppelbindung im Reaktanten vorhanden war. Dieser interessante Umzug bedarf einer Erklärung.
CH2=CH-CH= CH2 + Br2  |
BrCH2CHBr-CH=CH2 + | BrCH2CH=CHCH2Br |
| 3,4- dibrom-1-buten | 1,4-dibrom-2-buten |
Das erwartete Additionsprodukt von Reaktionen dieser Art ist das Ergebnis der 1,2-Addition, d. H. Bindung an die benachbarten Kohlenstoffe einer Doppelbindung. Das unerwartete Produkt kommt von der 1,4-Addition, d.h. Bindung an den terminalen Kohlenstoffatomen eines konjugierten Diens mit einer Verschiebung der verbleibenden Doppelbindung an die 2,3-Position. (Diese Zahlen beziehen sich auf die vier Kohlenstoffe des konjugierten Diens und sind keine IUPAC-Nomenklaturnummern.) Produktzusammensetzungen sind oft temperaturabhängig: Bei 40 oC sind 85% des Produktgemisches in der obigen Additionsreaktion das 1,4-Produkt, während bei 0 oC nur etwa 30% das 1,4-Produkt sind.
Die Bindung eines elektrophilen Atoms oder einer Gruppe an eines der Endkohlenstoffatome eines konjugierten Diens (Kohlenstoff # 1 in der folgenden Abbildung) erzeugt ein Allylkationenintermediat. Solche Kationen werden durch Ladungsdelokalisierung stabilisiert, und es ist diese Delokalisierung, die das bei solchen Additionsreaktionen erzeugte 1,4-Additionsprodukt ausmacht. Wie im Diagramm gezeigt, ist die positive Ladung über die Kohlenstoffe # 2 und # 4 verteilt, so dass an diesen Stellen die nukleophile Komponente bindet. Es ist zu beachten, dass die Resonanzstabilisierung des Allylkations größer ist als die vergleichbare Stabilisierung von 1,3-Butadien, da die Ladung im ersteren delokalisiert, im letzteren jedoch erzeugt und getrennt wird.
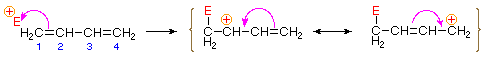
Eine Erklärung für den Temperatureinfluss ist im folgenden Energiediagramm für die Zugabe von HBr zu 1,3-Butadien dargestellt. Der erste Schritt, in dem ein Proton an Kohlenstoff # 1 bindet, ist der geschwindigkeitsbestimmende Schritt, wie durch die große Aktivierungsenergie (hellgrauer Pfeil) angezeigt. Der zweite schnellere Schritt ist der Produktbestimmungsschritt, und es gibt zwei Reaktionswege (blau gefärbt für 1,2-Addition und magenta für 1,4-Addition). Die 1,2-Addition hat eine geringere Aktivierungsenergie als die 1,4-Addition – sie erfolgt schneller als die 1,4-Addition, da das Bromid-Nukleophil näher an Kohlenstoff # 2 als an Kohlenstoff # 4 liegt. Das 1,4-Produkt ist jedoch stabiler als das 1,2-Produkt. Bei niedrigen Temperaturen werden die Produkte irreversibel gebildet und spiegeln die relativen Raten der beiden konkurrierenden Reaktionen wider. Das nennt man kinetische Kontrolle. Bei höheren Temperaturen stellt sich ein Gleichgewicht zwischen den Produkten ein und das thermodynamisch begünstigte 1,4-Produkt dominiert.
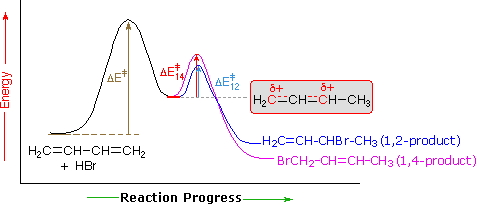
Wenn ein konjugiertes Dien von einem Elektrophilen angegriffen wird, sind die resultierenden Produkte eine Mischung von 1,2- und 1,4-Isomeren. Kinetik und Thermodynamik steuern eine Reaktion, wenn zwei Produkte unter unterschiedlichen Reaktionsbedingungen vorliegen. Das kinetische Produkt (Produkt A) wird schnell und das thermodynamische Produkt (Produkt B) langsamer gebildet. Normalerweise ist das erste gebildete Produkt das stabilere bevorzugte Produkt, aber in diesem Fall ist das langsamere gebildete Produkt das stabilere Produkt; Produkt B.
Einleitung
Wie nicht konjugierte Diene werden konjugierte Diene von Elektrophilen angegriffen. Tatsächlich erfahren konjugierte Elektrophile eine relativ größere kinetische Reaktivität, wenn sie mit Elektrophilen umgesetzt werden als nicht konjugierte Diene. Bei der elektrophilen Addition bildet das konjugierte Dien eine Mischung aus zwei Produkten — dem kinetischen Produkt und dem thermodynamischen Produkt -, deren Verhältnis durch die Reaktionsbedingungen bestimmt wird. Eine Reaktion, die mehr thermodynamisches Produkt liefert, steht unter thermodynamischer Kontrolle, und ebenso steht eine Reaktion, die mehr kinetisches Produkt liefert, unter kinetischer Kontrolle.
Basische Reaktion
Detaillierter Mechanismus
Schlussfolgerung
Die Reaktivität von konjugierten Dienen (Kohlenwasserstoffen, die zwei Doppelbindungen enthalten) variiert in Abhängigkeit von der Position der Doppelbindungen und der Temperatur der Reaktion.Diese Reaktionen können sowohl thermodynamische als auch kinetische Produkte erzeugen. Isolierte Doppelbindungen verleihen Dienen thermodynamisch eine geringere Stabilität als konjugierte Dienen. Sie sind jedoch kinetisch reaktiver in Gegenwart von Elektrophilen und anderen Reagenzien. Dies ist ein Ergebnis von Markovs Addition zu einer der Doppelbindungen. Ein Carbokation wird gebildet, nachdem eine Doppelbindung geöffnet wurde. Diese Carbokation hat zwei Resonanzstrukturen und Addition kann an jedem der positiven Kohlenstoffe auftreten.
Übungsprobleme
- Schreiben Sie die Produkte der 1,2-Addition und 1,4- Addition von a) HBr und Br auf. b) DBr zu 1,3-cyclohexadien. Was ist ungewöhnlich an den Produkten der 1,2- und 1,4-Addition von HX an unsubstituierte cyclische 1,3-diene?
- Wird das 1,2-Additionsprodukt bei höheren Temperaturen schneller gebildet, obwohl unter diesen Bedingungen das 1,4-Additionsprodukt vorherrscht?
- Warum ist das 1,4-Additionsprodukt das thermodynamisch stabilere Produkt?
- Welches der folgenden Radikalkationen ist keine vernünftige Resonanzstruktur?
5. Die Zugabe von 1 Äquivalent Brom zu 2,4-Hexadien bei 0 Grad C ergibt 4,5-Dibrom-2-hexen plus ein Isomer. Welches der folgenden ist das Isomer:
- 5,5- dibrom-2-hexen
- 2,5-dibrom-3-hexen
- 2,2-dibrom-3-hexen
- 2,3-Dibrom-4-hexen
6. Welches der folgenden wird das kinetisch bevorzugte Produkt aus der dargestellten Reaktion sein?
7. Die Addition von HBr an 2,3-Dimethyl-1,3-cyclohexadien kann in Abwesenheit oder Anwesenheit von Peroxiden erfolgen. Es werden jeweils zwei isomere C8H13Br-Produkte erhalten. Welches der folgenden Produkte ist ein gemeinsames Produkt beider Reaktionen?
8. und 9.
8. Das kinetisch kontrollierte Produkt in der obigen Reaktion ist:
- 3- Chlor-1-Buten
- 1-Chlor-2-Buten
9. Für die Reaktion in Frage 8, welche ist das Ergebnis der 1,4-Addition?
- 3- Chlor-1-Buten
- 1-Chlor-2-Buten
Antworten auf Probleme
1. A) Gleiches Produkt für beide Additionsmodi.
B) Es bilden sich sowohl cis- als auch trans-Isomere.
Durch Addition des HX an unsubstituierte Cycloalkan-1,3-diene in 1,2- oder 1,4-Weise erhält man aufgrund der Symmetrie das gleiche Produkt.
2. Ja. das kinetische Produkt wird sich immer noch schneller bilden, aber in diesem Fall wird genug Energie vorhanden sein, um das thermodynamische Produkt zu bilden, da das thermodynamische Produkt noch stabiler ist.
3. Das 1,4-Produkt ist thermodynamisch stabiler, da auf jeder Seite der Doppelbindung zwei Alkylgruppen vorhanden sind. Diese Form bietet Stabilität für die Gesamtstruktur.
4. Alle diese Isomere sind lebensfähig.
5. D
6. C
7. D
8. EIN
9. B
Mitwirkende
-
William Reusch, emeritierter Professor (Michigan State U.), Virtuelles Lehrbuch der organischen Chemie
-
Jim Clark (Chemguide.co.uk)
- Natasha Singh