Ansätze zur echokardiographischen Beurteilung der linksventrikulären Masse: Was fügt die Echokardiographie hinzu?
Einleitung
Die linksventrikuläre Masse (LVM) ist ein etabliertes Maß, mit dem unerwünschte kardiovaskuläre Ereignisse und vorzeitiger Tod unabhängig voneinander vorhergesagt werden können.1-3 Populationsbasierte Studien haben gezeigt, dass eine erhöhte LVM und linksventrikuläre Hypertrophie (LVH), wie sie durch zweidimensionale (2D) M-Mode-Echokardiographiemessungen bewertet werden, prognostische Informationen liefern, die über die traditionellen Risikofaktoren für kardiovaskuläre Erkrankungen (CVD) hinausgehen.4-6 In der bahnbrechenden Framingham Heart Study betrug das relative Risiko für Koronarerkrankungen nach Anpassung an Alter und traditionelle Risikofaktoren pro 50 g / m-Inkrement bei LVM 1,67 bei Männern und 1,60 bei Frauen.4 In ähnlicher Weise betrug in der älteren Kohorte der kardiovaskulären Gesundheitsstudie die Multiple-Risiko-adjustierte Hazard-Ratio für das höchste Quartil der geschlechtsspezifischen LVM 3,36 im Vergleich zum niedrigsten Quartil.5 Darüber hinaus wurde ein niedriges traditionelles CVD-Risikoprofil bei jungen Erwachsenen mit einem niedrigeren LVM und folglich einer niedrigeren CV-Morbidität und Mortalität in Verbindung gebracht.7 Daher wurde LVM als geeignetes Maß für die CVD-Risikostratifizierung und als Marker für subklinische Erkrankungen angepriesen.4,8 Darüber hinaus wurde die Regression der LVH bei Patienten mit Hypertonie, die mit blutdrucksenkenden Medikamenten behandelt wurden, oder nach Aortenklappenersatz bei Patienten mit schwerer Aortenklappenstenose mit verbesserten CVD-Ergebnissen in Verbindung gebracht.9,10
Schlüsselfaktoren, die LVM beeinflussen
LVM wird stark von der Körpergröße beeinflusst. Jedoch, auch nach Anpassung für anthropometrische Variablen, Männer haben größere LVM als Frauen.11 In ähnlicher Weise haben Athleten LVM im Vergleich zu Nichtathleten erhöht,12 und schwarze Männer und Frauen haben größere LVM als ihre weißen oder asiatischen Kollegen.11,13 Ebenso ist Fettleibigkeit mit einem erhöhten LVM verbunden. Die oben genannten Faktoren in Bezug auf Körpergröße, Gewicht und Bewegung sind mit einem erhöhten LVM sowie einem proportionalen Anstieg des linksventrikulären (LV) Volumens verbunden, wodurch zunächst eine normale LV-Wandspannung aufrechterhalten wird.12 Folglich bleibt die relative LV-Wanddicke (RWT), definiert als das Verhältnis der doppelten inferolateralen LV-Wanddicke zum an der Enddiastole gemessenen LV-Innendurchmesser, zunächst unverändert. Weitere zu berücksichtigende Faktoren sind Alter und Blutdruck.
Körpergrößenindexierungsmethoden für LVM
Normalwerte für LVM werden aus Studien der Allgemeinbevölkerung ohne Bluthochdruck oder Fettleibigkeit abgeleitet.12,14 Separate Grenzwerte für körpergrößenangepasste LVM wurden für Männer und Frauen verwendet.12,15 Um einen Vergleich der LVM zwischen Probanden unterschiedlicher Körpergröße zu ermöglichen, wurden verschiedene allometrische Ansätze vorgeschlagen, um die LVM zu normalisieren.14 Es gibt jedoch Kontroversen über die beste Methode zur Indizierung von LVM.
Die Körperoberfläche (BSA) war die erste anthropometrische Variable, die zur Indizierung von LVM verwendet wurde, und zeigte eine stärkere statistische Korrelation als die Körpergröße mit LVM16 und eine bessere Identifizierung von Bluthochdruck-bedingtem LVH.17 Es wurde jedoch festgestellt, dass die Indexierung durch BSA die Auswirkungen von Fettleibigkeit auf LVM minimiert und daher die Prävalenz von Adipositas-bedingtem LVH unterschätzt.18 Folglich wurde auch die Höhe für die Indexierung verwendet (entweder Höhe allein oder Höhe auf eine allometrische Potenz von 1,7 oder 2,7 angehoben).15,18-20 Die Indexierung von LVM zu Körpergröße, die auf einen allometrischen Exponenten von 2.7 (LVM / height2.7) angehoben wurde, hat im Vergleich zu BSA oder Körpergröße allein einen besseren Vorhersagewert für CVD-Ergebnisse, eine bessere Erkennung von Adipositas-bedingtem LVH und eine geringere Variabilität von LVM bei normalen Personen gezeigt.19,21 Chirinos et al. zeigte, dass die Indexierung auf LVM / height1.7 im Vergleich zu BSA und height2 die beste Methode war.7, um Adipositas-bedingte LVH zu identifizieren und war konsistenter mit CVD-Ergebnissen und Gesamtmortalität assoziiert.15 In einer Population mit einer geringen Prävalenz von Fettleibigkeit gab es unabhängig von der Indexierungsmethode keinen signifikanten Unterschied im LVH-Risiko.20 BSA wurde von der American Society of Echocardiography (ASE) und der European Association of Cardiovascular Imaging als bevorzugte Methode zur Indexierung von LVM weit verbreitet.14
Echokardiographie LVM-Messmethode und Vergleich mit kardiovaskulärer Magnetresonanz (CMR)
Angesichts der klinischen Bedeutung von LVM ist eine zuverlässige Methode zur Schätzung unerlässlich. Die Echokardiographie bietet eine zuverlässige, nichtinvasive, schnell verfügbare und relativ kostengünstige Methode zur Schätzung von LVM. Unabhängig von der verwendeten Methode wird die LVM-Schätzung abgeleitet, indem das Myokardvolumen in Masse umgewandelt wird, indem das Volumen mit der Myokarddichte von 1,05 g / ml multipliziert wird.14
Die erste und am häufigsten verwendete Echokardiographiemethode der LVM-Schätzung ist die lineare Methode, bei der enddiastolische lineare Messungen des interventrikulären Septums (IVSd), der inferolateralen LV-Wandstärke und des LV-Innendurchmessers verwendet werden, die aus der 2D-geführten M-Mode- oder direkten 2D-Echokardiographie abgeleitet wurden. Diese Methode verwendet die „Würfel“ -Formel von Devereux und Reichek, die eine verlängerte Ellipsoidform des LV mit einem Verhältnis von 1: 2 Neben- zu Hauptachse annimmt (Abbildung 1).22 Die Würfelformel enthält eine 20% ige Korrektur basierend auf der Überschätzung von LVM in früheren Validierungsstudien.14
Es ist wichtig, LV-Bilder an der Enddiastole mit dem Ultraschallstrahl zu erfassen senkrecht zur LV-Langachse ungefähr auf Höhe der Mitralklappenblattspitzen entweder aus einer parasternalen Langachs- oder einer Kurzachsenansicht.12 Zusätzlich können die Werte für die LV-Dicke, die durch direktes 2D erhalten werden, kleiner sein als die, die durch den M-Modus erhalten werden; daher können normale Werte für LVM nicht austauschbar sein.14 Die aktuellen Richtlinien der ASE und der European Association of Cardiovascular Imaging Chamber Quantification empfehlen die Verwendung der LV-Gewebe-Blut-Schnittstelle für die LVM-Messung und schlagen aus diesem Ansatz abgeleitete Normalwerte vor (Abbildung 1).12,14,23 Aufgrund seiner Einfachheit, einfachen Erfassung und geringeren gemessenen Variabilität empfahlen die ASE und die European Association of Cardiovascular Imaging, die lineare Methode (2D-geführter M-Modus oder direkter 2D) als beste Screening-Technik für LVH zu implementieren. Darüber hinaus basieren die meisten Daten über den prognostischen Wert von LVM auf dieser Methode. Jeder Fehler bei linearen Messungen kann jedoch zu erheblichen Ungenauigkeiten führen, da alle Messungen in der LVM-Formel in Würfel geschnitten werden. Diese Formel ist auch bei asymmetrischer LVH, dilatativer Kardiomyopathie und anderen Erkrankungen mit regionalen Unterschieden in der LV-Wanddicke nicht genau.14
Abbildung 1: Lineare und 2D-echokardiographische Methoden der LVM-Messung
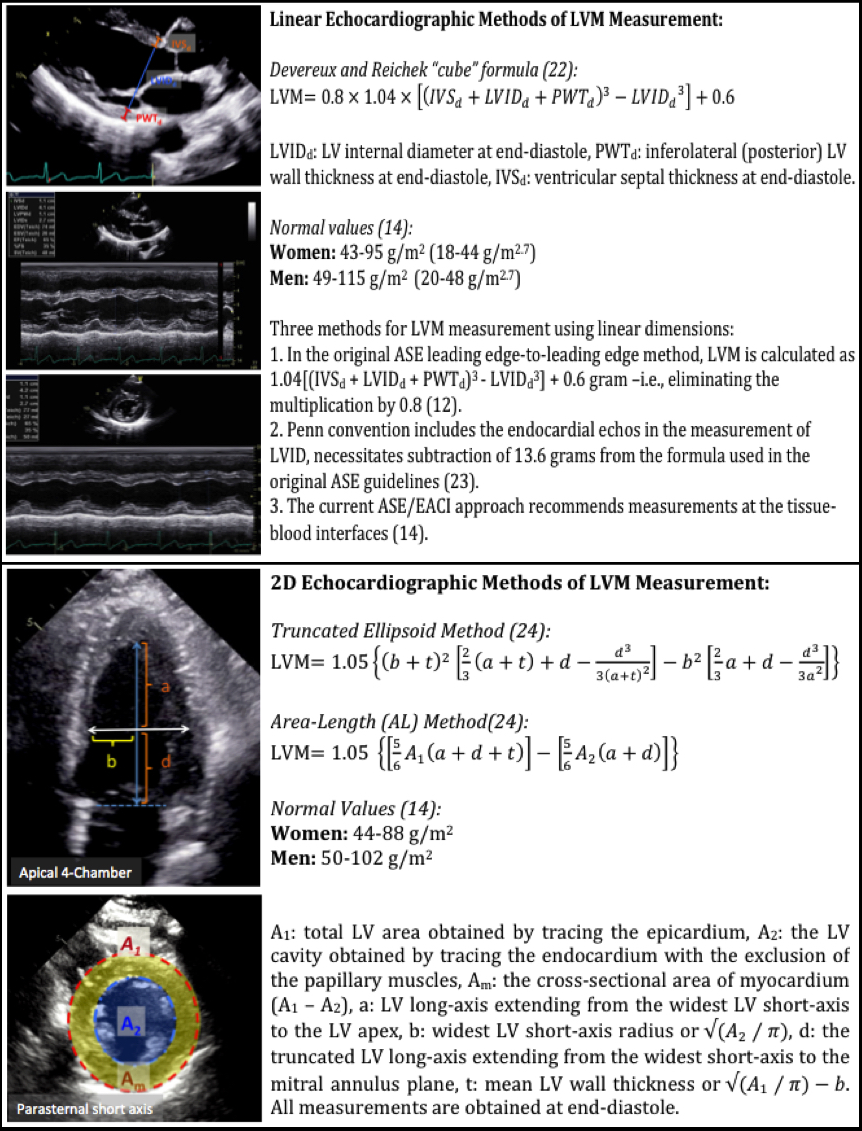
Die am häufigsten verwendeten 2D-Echokardiographiemethoden für die LVM-Schätzung sind die Flächenlängen- und abgeschnittenen Ellipsoidmethoden.14 In beiden Fällen wird die Fläche in der Mittelpapillarebene in der parasternalen Kurzachsenansicht und in der Enddiastole gemessen (Abbildung 1).24 Postmortale Daten haben gezeigt, dass sowohl 2D-Echokardiographiemethoden (Flächenlänge und abgeschnittenes Ellipsoid) als auch 2D-geführte M-Mode-Messungen von LVM vergleichbar waren, mit bescheidenen Korrelationen mit Autopsie-abgeleitetem LVM (r = 0.66-0.72 für die 2D-Echokardiographie und r = 0,78 für den 2D-geführten M-Modus).25 Sie zeigten auch, dass sowohl Flächenlängen- als auch abgeschnittene Ellipsoid-abgeleitete LVM in ihrer Korrelation mit Autopsie-LVM vergleichbar waren und die Einbeziehung der Papillarmuskeln in die Flächenmessungen dazu neigte, LVM zu überschätzen.25
Eine Einschränkung der 2D-Methoden besteht darin, dass sie auf geometrischen Annahmen beruhen, die nicht anwendbar sind, wenn große LV-Verzerrungen vorliegen oder wenn die LV verkürzt ist.12 Darüber hinaus erfordern die 2D-Verfahren im Vergleich zum M-Modus bessere Echokardiographiefenster, um endokardiale und epikardiale Grenzen zu identifizieren.24 Normale Referenzwerte für LVM-Indizes mit 2D-Echokardiographie sind in Abbildung 1.14
Die letzte Echokardiographiemethode zur Messung von LVM ist die Verwendung von Echtzeit-3D-Bildgebung. Die Echtzeit-3D-Echokardiographie beruht auf der direkten Messung des LV ohne geometrische Annahmen; Daher kann es theoretisch eine genauere Schätzung von LVM liefern als lineare M-Mode- oder 2D-Methoden. Darüber hinaus hat die Echtzeit-3D-Schätzung von LVM gezeigt bessere Übereinstimmung mit CMR-Messungen als 2D-Direkt- und M-Mode-Echokardiographiemessungen.26-27 Die Echtzeit-3D-Bewertung von LVM zeigte eine hervorragende Korrelation mit CMR-Daten mit einem Pearson-Korrelationskoeffizienten (r) von 0,99 im Vergleich zur 2D-Methode gegenüber CMR mit einem r von 0,84.26 In ähnlicher Weise betrug die Interobserver- und Intraobserver-Variabilität der Echtzeit-3D-Messungen 7% bzw. 8%, was signifikant besser war als die Interobserver- und Intraobserver-Variabilität der 2D-Methode (37% bzw. 19%).27 Darüber hinaus ähnelten die LVM-Werte in Echtzeit-3D-Messungen den CMR-Werten mit nur einer minimalen Verzerrung von 4 Gramm.27 Daher verbessert die Echtzeit-3D-Technik die Genauigkeit und Reproduzierbarkeit der Echokardiographieschätzung von LVM, hängt jedoch stark von der verwendeten Ausrüstung und der Qualität der erhaltenen Bilder ab.14 Die Richtlinien der ASE und der European Association of Cardiovascular Imaging Chamber zur Quantifizierung lieferten aufgrund begrenzter veröffentlichter Daten keine normalen Referenzwerte für Echtzeit-3D-abgeleitetes LVM.14
Klassifizierung von LV-Remodeling-Mustern
Traditionell wurde LV in vier sich gegenseitig ausschließende Muster gemäß der von RWT bewerteten LV-Geometrie und dem Vorhandensein oder Fehlen von LVH klassifiziert, definiert durch einen LVM-Index > 115 g / m2 für Männer oder > 95 g / m2 für Frauen (Abbildung 2).1 Diese traditionelle Klassifikation, die von der ASE und der European Association of Cardiovascular Imaging übernommen wurde, weist Nachteile im Zusammenhang mit der Verwendung linearer Messungen zur Abbildung einer 3D-LV-Struktur auf. Darüber hinaus identifiziert der traditionelle Ansatz keine isolierten Änderungen der LV-Größe oder LV-dicke, da RWT ein Verhältnis ist.
Abbildung 2: Linksventrikuläre geometrische Muster: Klassifikationssysteme
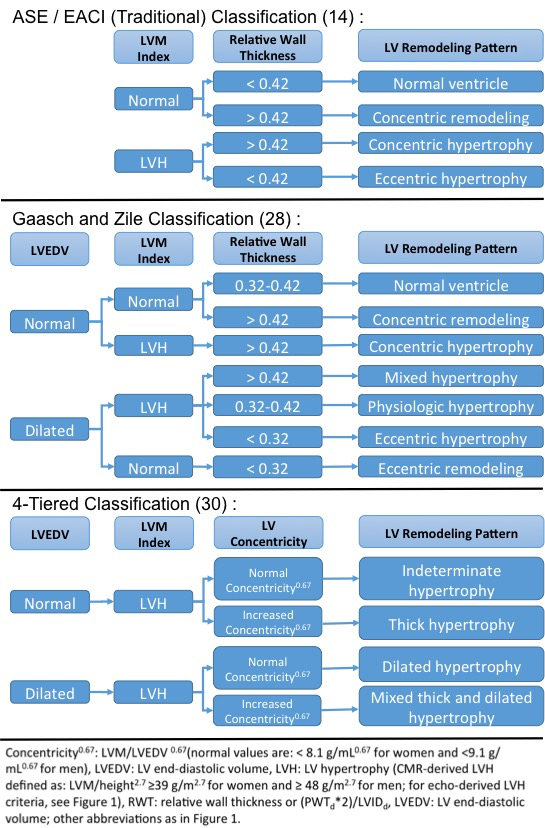
In einem Versuch, eine Klassifizierung zu entwickeln, die verschiedene physiologische und pathologische Remodeling-Phänotypen umfassender einbezieht, schlugen Gaasch und Zile vor, das enddiastolische LV-Volumen als zusätzlichen Marker zur Identifizierung der LV-Dilatation einzubeziehen (Abbildung 2).28 Diese Klassifizierung lieferte einen zusätzlichen prognostischen Wert in Bezug auf die CVD-Ergebnisse in der Studienkohorte für kardiovaskuläre Gesundheit.29
In einem weiteren Versuch, die mit der traditionellen Remodeling-Klassifikation verbundenen Einschränkungen anzugehen, Khouri et al. schlug eine vierstufige Klassifizierung von LVH vor (Abbildung 2).30 Die vierstufige Klassifikation wurde in der Dallas Heart Study über eine mittlere Nachbeobachtungszeit von 9 Jahren evaluiert und LVH erfolgreich in Untergruppen mit differentieller Prognose geschichtet. Dilated LVH und gemischt dick und dilated LVH trugen die schlechteste Prognose für Herzinsuffizienz oder CV Tod, und unbestimmte Hypertrophie hatte vergleichbare Raten zu denen ohne LVH.31
- Koren MJ, Devereux RB, Casale PN, et al. Verhältnis von linksventrikulärer Masse und Geometrie zu Morbidität und Mortalität bei unkomplizierter essentieller Hypertonie. Ann Intern Med 1991;114:345-52.
- Drazner MH, Rame JE, Marino EK et al. Eine erhöhte linksventrikuläre Masse ist ein Risikofaktor für die Entwicklung einer depressiven linksventrikulären Ejektionsfraktion innerhalb von fünf Jahren: die Cardiovascular Health Study. J Am Coll Cardiol 2004;43:2207-15.
- Verma A, Meris A, Skali H, et al. Prognostische Implikationen der linksventrikulären Masse und Geometrie nach Myokardinfarkt: die VALIANT (VALsartan bei akutem Myokardinfarkt) Echokardiographische Studie. JACC Cardiovasc Imaging 2008;1:582-91.
- Levy D, Garrison RJ, Savage DD, et al. Linksventrikuläre Masse und Inzidenz von koronarer Herzkrankheit in einer älteren Kohorte. Die Framingham Heart Study. Ann Intern Med 1989;110:101-7.
- Gardin JM, McClelland R, Kitzman D, et al. M-Mode echokardiographische Prädiktoren für die sechs- bis siebenjährige Inzidenz von koronarer Herzkrankheit, Schlaganfall, Herzinsuffizienz und Mortalität in einer älteren Kohorte (the Cardiovascular Health Study). Am J Cardiol 2001;87:1051-7.
- Verdecchia P, Carini G, Circo A, et al. Linksventrikuläre Masse und kardiovaskuläre Morbidität bei essentieller Hypertonie: die MAVI-Studie. J Am Coll Cardiol 2001;38:1829-35.
- Gidding SS, Carnethon MR, Daniels S, et al. Ein geringes kardiovaskuläres Risiko ist mit einer günstigen linksventrikulären Masse, einer relativen Wandstärke des linken Ventrikels und einer Größe des linken Vorhofs verbunden: die CARDIA-Studie. J Am Soc Echocardiogr 2010;23:816-22.
- Devereux RB, Stadtrat MH. Rolle der präklinischen kardiovaskulären Erkrankung in der Entwicklung von Risikofaktor Exposition zur Entwicklung von morbiden Ereignissen. Auflage 1993;88:1444-55.
- Verdecchia P, Schillaci G, Borgioni C, et al. Prognostische Bedeutung serieller Veränderungen der linksventrikulären Masse bei essentieller Hypertonie. Auflage 1998;97:48-54.
- Hatani T, Kitai T, Murai R, et al. Assoziationen des remanenten linksventrikulären und linksatrialen Remodelings mit klinischen Ergebnissen bei Patienten nach Aortenklappenersatz bei schwerer Aortenstenose. J Cardiol 2015 Oktober 30. .
- Gardin JM, Wagenknecht LE, Anton-Culver H, et al. Beziehung von kardiovaskulären Risikofaktoren zur echokardiographischen linksventrikulären Masse bei gesunden jungen schwarzen und weißen erwachsenen Männern und Frauen. Die CARDIA-Studie. Entwicklung des Koronararterienrisikos bei jungen Erwachsenen. Auflage 1995;92:380-7.
- Marwick TH, Gillebert TC, Aurigemma G, et al. Empfehlungen zur Verwendung der Echokardiographie bei Bluthochdruck bei Erwachsenen: Ein Bericht der European Association of Cardiovascular Imaging (EACVI) und der American Society of Echocardiography (ASE). J Am Soc Echocardiogr 2015;28:727-54.
- Poppe KK, Doughty RN, Gardin JM, et al.; im Auftrag der echokardiographischen Normalbereichsmetaanalyse des linken Herzmuskels. Ethnisch-spezifische normative Referenzwerte für echokardiographische LA- und LV-Größe, LV-Masse und systolische Funktion: Die echonormale Studie. JACC Cardiovasc Imaging 2015;8:656-65.
- Lang RM, Badano LP, Mor-Avi V, et al. Empfehlungen für die Quantifizierung der Herzkammer durch Echokardiographie bei Erwachsenen: ein Update der American Society of Echocardiography und der European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015;28:1-39.e14.
- Chirinos JA, Segers P, De Buyzere ML, et al. Linksventrikuläre Masse: allometrische Skalierung, normative Werte, Wirkung von Fettleibigkeit und prognostische Leistung. Hypertonie 2010;56:91-8.
- Gardin JM, Arnold A, Gottdiener JS, et al. Linksventrikuläre Masse bei älteren Menschen. Die kardiovaskuläre Gesundheitsstudie. Hypertonie 1997;29: 1095-103.
- Ferrara LA, Vaccaro O, Cardoni O, et al. Indexierungskriterien der ventrikulären Masse und prädiktive Rolle von Blutdruck und Körperzusammensetzung. Am Jhs 2005;18:1282-7.
- Cuspidi C, Giudici V, Negri F, et al. Verbesserung der kardiovaskulären Risikostratifizierung bei essentiellen hypertensiven Patienten durch Indexierung der linksventrikulären Masse auf die Höhe (2.7). Jpps 2009;27:2465-71.
- de Simone G, Daniels SR, Devereux RB, et al. Linksventrikuläre Masse und Körpergröße bei normotensiven Kindern und Erwachsenen: Bewertung allometrischer Beziehungen und Auswirkungen von Übergewicht. J Am Coll Cardiol 1992;20:1251-60.
- de Simone G, Devereux RB, Maggioni AP, et al. Unterschiedliche Normalisierungen für Körpergröße und Populationsrisiko für linksventrikuläre Hypertrophie: die MAVI-Studie. Am Jhs 2005;18:1288-93.
- de Simone G, Kizer JR, Chinali M, et al. Normalisierung der Körpergröße und des bevölkerungsbedingten Risikos einer linksventrikulären Hypertrophie: die Strong Heart Study. Am Jhs 2005;18:191-6.
- Devereux RB, Reichek N. Echokardiographische Bestimmung der linksventrikulären Masse beim Menschen. Anatomische Validierung der Methode. Auflage 1977;55:613-8.
- Deague JA, Wilson CM, Grigg LE, et al. Diskrepanzen zwischen echokardiographischen Messungen der linksventrikulären Masse in einer gesunden erwachsenen Bevölkerung. Clin Sci (Lond) 1999;97:377-83.
- Lang RM, Bierig M, Devereux RB, et al. Empfehlungen für die Kammerquantifizierung: Ein Bericht des Guidelines and Standards Committee der American Society of Echocardiography und der Chamber Quantification Writing Group, der in Zusammenarbeit mit der European Association of Echocardiography, einer Zweigstelle der European Society of Cardiology, entwickelt wurde. J Am Soc Echocardiogr 2005;18:1440-63.
- Park SH, Shub C, Nobrega TP, et al. Zweidimensionale echokardiographische Berechnung der linksventrikulären Masse, wie von der American Society of Echocardiography empfohlen: korrelation mit Autopsie und M-Mode-Echokardiographie. J Am Soc Echocardiogr 1996;9:119-28.
- Chuang ML, Beaudin RA, Riley MF, et al. Dreidimensionale echokardiographische Messung der linksventrikulären Masse: Vergleich mit Magnetresonanztomographie und zweidimensionalen echokardiographischen Bestimmungen beim Menschen. Int J Karte Imaging 2000;16:347-57.
- Mor-Avi V, Sugeng L, Weinert L, et al. Schnelle Messung der linksventrikulären Masse mit dreidimensionaler Echokardiographie in Echtzeit: Vergleich mit der Magnetresonanztomographie. Auflage 2004;110:1814-8.
- Gaasch WH, Zile MR. Linksventrikulärer struktureller Umbau in Gesundheit und Krankheit: mit besonderem Schwerpunkt auf Volumen, Masse und Geometrie. J Am Coll Cardiol 2011;58:1733-40.
- Zile MR, Gaasch WH, Patel K, et al. Adverse linksventrikuläre Remodeling in Community-Wohnung ältere Erwachsene prognostiziert Vorfall Herzinsuffizienz und Mortalität. JACC Herz versagen 2014;2: 512-22.
- Khouri MG, Peshock RM, Ayers CR, et al. Eine 4-stufige Klassifikation der linksventrikulären Hypertrophie basierend auf der linksventrikulären Geometrie: die Dallas Heart Study. Circ Cardiovasc Imaging 2010;3:164-71.
- Garg S, de Lemos JA, Ayers C, et al. Assoziation einer 4-stufigen Klassifikation der LV-Hypertrophie mit unerwünschten CV-Ergebnissen in der Allgemeinbevölkerung. JACC Cardiovasc Imaging 2015;8:1034-41.
Klinische Themen: Herzinsuffizienz und Kardiomyopathien, Nichtinvasive Bildgebung, Prävention, Sport- und Bewegungskardiologie, Herzklappenerkrankungen, Echokardiographie / Ultraschall, Bluthochdruck, Sport und Bewegung und Bildgebung
Schlüsselwörter: Afroamerikaner, Antihypertensiva, Aortenklappe, Aortenklappenstenose, Sportler, Autopsie, Blutdruck, Körpergröße, Körperoberfläche, Kardiomyopathie, Erweitert, Kohortenstudien, Koronarerkrankung, Diastole, Dilatation, Echokardiographie, Echokardiographie, Dreidimensional, Hypertonie, Hypertrophie, Linksventrikulär, Magnetresonanzspektroskopie, Mitralklappe, Mortalität, Früh, Fettleibigkeit, Beobachtervariation, Papillarmuskeln, Phänotyp, Phosmet, Prävalenz, Prognose, Referenzwerte, Reproduzierbarkeit der Ergebnisse, Risikofaktoren, Ventrikulärer Umbau
< Zurück zu Inserate