Artikel
John Plante *, Chelsea Eason, Alan Snyder, Dirk Elston
Abteilung für Dermatologie und dermatologische Chirurgie, Medizinische Universität von South Carolina, Charleston, South Carolina
Lichen planopilaris (LPP) ist eine primäre Narbenbildung alopezie gekennzeichnet durch Pruritus, Zärtlichkeit, follikuläre Stacheln und Erythem in der aktiven Phase1-3. Obwohl die genaue Ätiologie unbekannt ist, Die Pathogenese beinhaltet chronische, Lymphozyten-vermittelte Entzündung, die letztendlich zu irreversiblen führen kann, vernarbender Haarausfall durch seine selektive Zerstörung des Haarfollikels1,2. Es gibt drei Varianten von LPP, darunter die klassische Form, die frontale fibrosierende Alopezie (FFA) und das Graham-Little-Piccardi-Lassueur-Syndrom (progressive Alopezie der Kopfhaut, der Achselhöhlen, der Brauen und des Schambeins)2. LPP erweist sich oft als refraktär gegenüber Standardtherapien und folgt einem unvorhersehbaren, rezidivierenden Verlauf, der häufig zu einer stark verminderten Lebensqualität führt1,2,4,5. Hier diskutieren wir weiter unsere jüngste Studie über die Verwendung von Tofacitinib bei der Behandlung von widerspenstigem LPP6.
Zahlreiche Therapien wurden verwendet, um LPP mit variablem Erfolg zu behandeln1-3,5,7-9. Da derzeit verfügbare Behandlungen in der Regel nicht zum Nachwachsen der Haare führen, ist das Management darauf ausgerichtet, die Rate des Haarausfalls zu verringern, die Symptome zu kontrollieren und Entzündungen zu reduzieren2,9. First-Line-Therapien umfassen intraläsionale und hochwirksame topische Kortikosteroide, aber diese können zu Kopfhautatrophie führen und den Erfolg zukünftiger Haartransplantationen beeinträchtigen. Andere topische Mittel haben ein geringeres Atrophierisiko und umfassen die Calcineurin-Inhibitoren Tacrolimus und Pimecrolimus2. Obwohl es den zugrunde liegenden Entzündungsprozess nicht kontrolliert, kann sowohl topisches als auch orales Minoxidil auch verwendet werden, um das Nachwachsen der Haare bei Patienten zu maximieren, die ebenfalls an erblicher Alopezie leiden – fast 50% der Bevölkerung9,10. Zusätzliche systemische Therapien umfassen Hydroxychloroquin, Mycophenolatmofetil, Cyclosporin, Methotrexat, Thalidomid, Doxycyclin, Retinoide, Pioglitazon, 5-Alpha-Reduktase-Inhibitoren und Kurzzeitprädnisolon1,2,9. Jüngste Studien haben das Potenzial von niedrig dosiertem oralem Naltrexon, plättchenreichen Plasmainjektionen und nicht-pharmakologischen Interventionen wie Excimerlasern nahe gelegt, aber keine war einheitlich wirksam5,7,8. Während Haarteile und Verlängerungen das Volumen erhöhen und alopezische Bereiche bedecken können, ist Vorsicht geboten, um eine Traktion zu vermeiden9.
In einer kürzlich veröffentlichten Studie untersuchten wir das Potenzial von topischen und oralen (systemischen) Formulierungen von Tofacitinib6. Tofacitinib ist ein Januskinase (JAK) 1/3-Inhibitor mit Wirksamkeit gegen mehrere immunvermittelte dermatologische Erkrankungen, einschließlich atopischer Dermatitis, Alopecia areata und Vitiligo11-14. Seine immunmodulierende Aktivität wird durch Hemmung des JAK / STAT-Signalweges vermittelt12,13. In LPP wurden Interferone mit der Erleichterung der lymphozytären Rekrutierung und dem Verlust des Immunprivilegs von Bulge-Epithelzellen in Verbindung gebracht1. Durch die Wirkung von Tofacitinib auf den JAK / STAT-Signalweg kann diese Interferon-vermittelte Entzündung reduziert werden, wodurch die Symptome verbessert und eine weitere Follikelzerstörung verhindert1,11-13.
Wir untersuchten das therapeutische Potenzial von Tofacitinib bei der Behandlung von refraktärem LPP durch eine retrospektive Diagrammübersicht6. Nach Kenntnis der Autoren ist dies die zweite Studie, die den Einsatz von Tofacitinib beim LPP-Management untersucht1. Unsere Studie umfasste neun Patienten, die eine andere Therapie versagt hatten – drei verwendeten topische, fünf orale und eine verwendete beide Formulierungen.
Ein günstiges initiales Ansprechen wurde bei allen bis auf einen Patienten erreicht. Das verbleibende Subjekt sprach schlecht auf die topische Therapie an, verbesserte sich jedoch unter systemischer Tofacitinib-Therapie. Obwohl die absolute Anzahl der Patienten gering ist, gab es einen Trend zu einem besseren klinischen Ansprechen bei Patienten unter systemischer Therapie im Vergleich zu patienten unter topischer Therapie. Die Zeit bis zu einem günstigen Ansprechen lag zwischen 1 und 7 Monaten, wobei 5 und 8 Patienten innerhalb der ersten 3 bzw. 5 Behandlungsmonate eine Besserung zeigten.
Unser aktuelles Praxismuster besteht darin, schnell fortschreitende Krankheiten mit einem kurzen Kurs von Prednison oder Cyclosporin zu behandeln und dann zu versuchen Übergang zur topischen Calcineurin-Inhibitor-Therapie, wenn möglich (Abbildung 1). Eine Untergruppe der Patienten wird mit Pioglitazon in Dosen von 15-45 mg täglich eine Remission ihrer Erkrankung erreichen. Die Patienten sollten über die markierte Indikation, gemischte Daten zur Wirksamkeit und eine Warnung vor Blasenkrebs bei längerer Anwendung informiert werden. Unsere Praxis besteht darin, Pioglitazon nach maximal 9 Monaten nicht mit steigenden Dosen in Schritten fortzusetzen. Hilfsstoffe umfassen Naltrexon in einer Dosis von 5 mg täglich und N-Acetylcystein in Dosen von 600-1200 mg dreimal täglich. Excimer-Laser, Hand-Schmalband-UVB oder Low-Intensity-Laser-Cap-Therapie wird oft als Zusatztherapie bei Patienten mit einer partiellen Reaktion verwendet. Hydroxychloroquin kann gelegentlich von Vorteil sein, aber die meisten Patienten, die an unsere Klinik überwiesen wurden, haben die Hydroxychloroquin-Therapie bereits versagt. Diejenigen, die nicht ansprechen, müssen möglicherweise mit Methotrexat, Mycophenolatmofetil oder Tofacitinib behandelt werden. Die Ergebnisse unserer jüngsten Studie unterstützen zusätzlich die Idee, dass sowohl topisches als auch systemisches Tofacitinib in refraktären Fällen eine praktikable Zusatzbehandlung darstellen können. Haarstörungen reagieren oft langsam, und wir bewerten sie in Abständen von 3 Monaten neu, um das Ansprechen auf die Therapie und die Notwendigkeit einer Eskalation zu bestimmen.
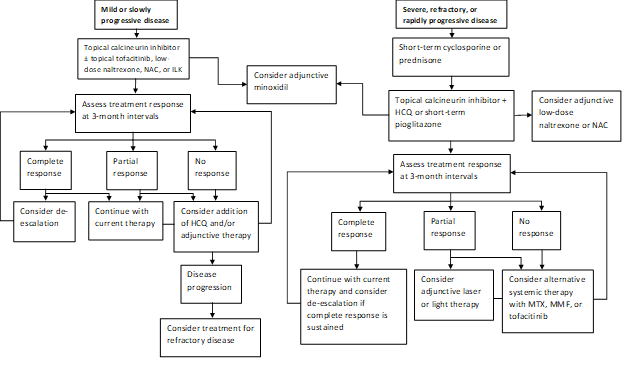
Abbildung 1: Schrittweiser Behandlungsalgorithmus für LPP
NAC, N-Acetylcystein; ILK, intraläsionale Kortikosteroide; HCQ, Hydroxychloroquin; MTX, Methotrexat, MMF, Mycophenolatmofetil
Bei der Prüfung der Anwendung von Tofacitinib in der Praxis müssen die Ärzte den Nutzen dieses Medikaments mit seinen Risiken in Einklang bringen. Unsere Kohorte hatte nur geringfügige Laboranomalien (eine bei topischer und zwei bei systemischer Therapie), die keine Intervention erforderten. Anbieter sollten sich jedoch der möglichen Nebenwirkungen bei der Verschreibung dieses Medikaments bewusst sein, einschließlich eines erhöhten Infektionsrisikos, Zytopenien, Hyperlipidämie, Leber- und Nierenanomalien sowie des Potenzials für thromboembolische Ereignisse14-16. Während die topische Formulierung niedrigere Plasmakonzentrationen als ihr systemisches Gegenstück gezeigt hat, wurden bei der topischen Therapie immer noch geringfügige unerwünschte Ereignisse und Laboranomalien berichtet13.
Obwohl unsere Ergebnisse vielversprechend sind, müssen sie nach Berücksichtigung mehrerer Einschränkungen interpretiert werden. Wir verwendeten ein retrospektives Studiendesign und konnten kein validiertes Maß für den Schweregrad der Erkrankung wie den Lichen Planopilaris Activity Index (LPPAI) 1,3 verwenden. Der LPPAI eignet sich für prospektive Studien und bietet ein standardisiertes Tool, mit dem Anbieter die Ergebnisse verschiedener Behandlungsmodalitäten direkt vergleichen können. Anzeichen und Symptome wie Erythem, Empfindlichkeit, Vorhandensein von Follikelstacheln und betroffenes Gebiet wurden verwendet, um das therapeutische Ansprechen zu beurteilen, Zukünftige Studien sollten jedoch auch ein Maß für die Lebensqualität umfassen. Die Möglichkeit einer Beobachterverzerrung kann nicht ausgeschlossen werden, da unsere Studie nicht blind und nicht randomisiert war.
Darüber hinaus verwendete unsere gesamte Kohorte Tofacitinib adjunktiv, was es schwierig machte, den unabhängigen Beitrag des Arzneimittels zu beurteilen. In einer früheren Studie verwendete ein Teil (N = 5) der Kohorte Tofacitinib als Monotherapie, und die meisten Probanden erzielten günstige Ergebnisse, aber diese Studie war auch durch ihre kleine Stichprobengröße und ihr retrospektives Design begrenzt1.
Aktuelle Studien sind durch ihre kleinen Stichprobengrößen und retrospektiven Studiendesigns begrenzt, und gut gestaltete prospektive Studien sind dringend erforderlich. Wir empfehlen einen schrittweisen Therapieansatz, um das Risiko von Nebenwirkungen zu minimieren. Das Risiko einer dauerhaften Narbenbildung muss im Lichte individueller Patientenfaktoren und Komorbiditäten gegen das Risiko schwerwiegender unerwünschter Ereignisse abgewogen werden, und die Patienten sollten aktive Partner bei der Entscheidungsfindung sein. Eine Haartransplantation kann in Betracht gezogen werden, sobald die Krankheitskontrolle erreicht ist und die Entzündung abgeklungen ist. Es ist wichtig zu beachten, dass eine aggressive Therapie wie Prednison oder Cyclosporin in der Regel in den Wochen nach der Transplantation erforderlich ist, um Krankheitsausbrüche zu vermeiden. Ein allmählicher Abrieb der transplantierten Haare ist auch nach erfolgreicher Transplantation zu erwarten, aber die Daten deuten darauf hin, dass die Patienten im Allgemeinen mit den Ergebnissen zufrieden sind und feststellen, dass die Transplantation die Lebensqualität verbessert.
Abkürzungen
LPP, Lichen planopilaris; FFA, frontale fibrosierende Alopezie; JAK, Januskinase; STAT, Signalwandler und Aktivator von Transkriptionsproteinen; LPPAI, Lichen Planopilaris Activity Index.
Interessenkonflikte
Die Autoren erklären keine Interessenkonflikte.
- Yang CC, Khanna T, Sallee B, et al. Tofacitinib zur Behandlung von Lichen planopilaris: Eine Fallserie. In: Dermatol Ther. 2018; 31(6): e12656. doi:10.1111/dth.12656
- Babahosseini H, Tavakolpour S, Mahmoudi H, et al. Lichen planopilaris: retrospektive Studie zu Merkmalen und Behandlung von 291 Patienten. In: J Dermatolog Treat. 2019; 30(6): 598–604. doi:10.1080/09546634.2018.1542480
- Chiang C, Sah D, Cho BK, et al. Hydroxychloroquin und Lichen planopilaris: Wirksamkeit und Einführung des Lichen Planopilaris Activity Index Scoring Systems. In: Acad Dermatol. 2010; 62(3): 387-392. Ursprungsbezeichnung:10.1016/j.jaad.2009.08.054
- Alirezaei P, Ahmadpanah M, Rezanejad A, et al. Im Vergleich zu Kontrollen haben Personen mit Lichen Planopilaris mehr Depressionen, ein geringeres Selbstwertgefühl und eine geringere Lebensqualität. Neuropsychobiologie. 2019; 78(2): 95-103. doi:10.1159/000499135
- Jha AK. Plättchenreiches Plasma als Zusatzbehandlung bei Lichen planopilaris. In: Acad Dermatol. 2019; 80(5): e109-e110. Ursprungsbezeichnung:10.1016/j.jaad.2018.09.013
- Plante J, Eason C, Snyder A, et al. Tofacitinib bei der Behandlung von Lichen planopilaris: eine retrospektive Überprüfung . In: Acad Dermatol. 2020; S0190-9622(20)30979-8. doi:10.1016/j.jaad.2020.05.104
- Lajevardi V, Salarvand F, Ghiasi M, et al. Die Wirksamkeit und Sicherheit von oralem niedrig dosiertem Naltrexon im Vergleich zu Placebo bei Patienten mit Lichen planopilaris: eine randomisierte kontrollierte klinische Studie . In: J Dermatolog Treat. 2020; 1-5. doi:10.1080/09546634.2020.1774488
- In: Lee B, Elston DM. Die Verwendung von Naltrexon bei dermatologischen Erkrankungen. In: Acad Dermatol. 2019; 80(6): 1746-1752. Ursprungsbezeichnung:10.1016/j.jaad.2018.12.031
- Bolduc C, Sperling LC, Shapiro J. Primäre narbige Alopezie: Lymphatische primäre narbige Alopezie, einschließlich chronischer kutaner Lupus erythematodes, Lichen planopilaris, frontale fibrosierende Alopezie und Graham-Little-Syndrom. In: Acad Dermatol. 2016; 75(6): 1081-1099.
- Vano-Galvan S, Trindade de Carvalho L, Saceda-Corralo D, et al. Orales Minoxidil verbessert die Hintergrundhaardicke bei Lichen planopilaris . In: Acad Dermatol. 2020; S0190-9622(20)30566-1. Ursprungsbezeichnung:10.1016/j.jaad.2020.04.026
- Tegtmeyer K, Zhao J, Maloney NJ, et al. Off-Label-Studien zu Tofacitinib in der Dermatologie: eine Übersicht . In: J Dermatolog Treat. 2019; 1–11. doi:10.1080/09546634.2019.1673877
- Montilla AM, Gomez-Garcia F, Gomez-Arien PJ, et al. Scoping Review zur Verwendung von Medikamenten gegen den JAK / STAT-Signalweg bei atopischer Dermatitis, Vitiligo und Alopecia Areata. Dermatol Ther (Heidelb). 2019; 9(4): 655–683. ust-idnr.:10.1007/s13555-019-00329- y
- Hosking AM, Juhasz M, Mesinkovska NA. Topische Janus-Kinase-Inhibitoren: Eine Überprüfung der Anwendungen in der Dermatologie. In: Acad Dermatol. 2018; 79(3): 535–544. Ursprungsbezeichnung:10.1016/j.jaad.2018.04.018
- Shreberk-Hassidim R, Ramot Y, Zlotogorski A. Januskinasehemmer in der Dermatologie: Eine systematische Überprüfung. In: Acad Dermatol. 2017; 76(4): 745-753.e19. Ursprungsbezeichnung:10.1016/j.jaad.2016.12.004
- Xeljanz/Xeljanz XR (Tofacitinib) . New York, NY: Pfizer Laboratories Division von Pfizer Inc. https://labeling.pfizer.com/showlabeling.aspx?id=959; 2019. Zugriff am 7. Juli 2020.
- FDA. Sicherheitsstudie findet Risiko von Blutgerinnseln in der Lunge und Tod mit höherer Dosis von Tofacitinib (Xeljanz, Xeljanz XR) bei Patienten mit rheumatoider Arthritis; FDA zu untersuchen. https://www.fda.gov/drugs/drug-safety-and-availability/safety-trial-finds-risk-blood-clots-lungs-and-death-higher-dose-tofacitinib-xeljanz-xeljanz-xr; 2019. Zugriff am 6. Juli 2020.