ATrain Education
Obwohl wir jeden Tag mehr über die Pathophysiologie der Parkinson-Krankheit lernen, wird sie immer noch als weitgehend idiopathisch (unbekannter Ursache) angesehen. Es beinhaltet wahrscheinlich die Interaktion von Wirtsanfälligkeit und Umweltfaktoren. Ein kleiner Prozentsatz der Fälle ist genetisch bedingt und genetische Faktoren werden intensiv untersucht.
Physiologisch gesehen sind die mit der Parkinson-Krankheit verbundenen Symptome das Ergebnis des Verlusts einer Reihe von Neurotransmittern, insbesondere Dopamin. Die Symptome verschlimmern sich mit der Zeit, da immer mehr der von der Krankheit betroffenen Zellen verloren gehen. Der Krankheitsverlauf ist sehr variabel, wobei einige Patienten mit zunehmendem Alter nur sehr wenige Symptome aufweisen und andere, deren Symptome schnell fortschreiten.
Parkinson wird zunehmend als komplexe neurodegenerative Erkrankung mit einer Abfolge von Fortschritten angesehen. Es gibt starke Hinweise darauf, dass es zuerst den dorsalen motorischen Kern des Vagusnervs und die Riechkolben und den Kern, dann den Locus coeruleus und schließlich die Substantia nigra betrifft. Kortikale Bereiche des Gehirns sind zu einem späteren Zeitpunkt betroffen. Schäden an diesen verschiedenen neuronalen Systemen sind für die vielfältigen pathophysiologischen Veränderungen verantwortlich, die nicht nur das motorische System, sondern auch das kognitive und neuropsychologische System beeinträchtigen (Kwan & Whitehill, 2011).
Die Rolle von Dopamin
Dopamin überträgt wie andere Neurotransmitter chemische Botschaften von einer Nervenzelle zur anderen über die Synapse, einen Raum zwischen der präsynaptischen Zelle und dem postsynaptischen Rezeptor. Dopamin wird aus Membranspeichervesikeln in der präsynaptischen Membran in die Synapse ausgeschieden. Es kreuzt die Synapse und bindet an die postsynaptische Membran, wo es Dopaminrezeptoren aktiviert. Ungenutztes Dopamin, das in der Synapse verbleibt, wird wieder in die präsynaptische Zelle absorbiert; Sobald es wieder in der präsynaptischen Zelle ist, wird das überschüssige Dopamin in Speichervesikel verpackt und wieder in die Synapse freigesetzt.
Wenn Dopamin innerhalb der Synapse von einer Zelle zur anderen wandert, kann es durch zwei Enzyme, MAO (Monoaminoxidase) und COMT (Catechol-O-Methyltransferase), abgebaut und inaktiviert werden. Eine therapeutische Strategie führt einen MAO-Hemmer in die Synapse ein, der die Wirkung des MAO-Enzyms unterbricht und den Abbau von Dopamin verhindert. Dadurch kann mehr Dopamin in der Synapse verbleiben und erhöht die Wahrscheinlichkeit, dass es an die postsynaptische Membran bindet.
Chemische synaptische Übertragung
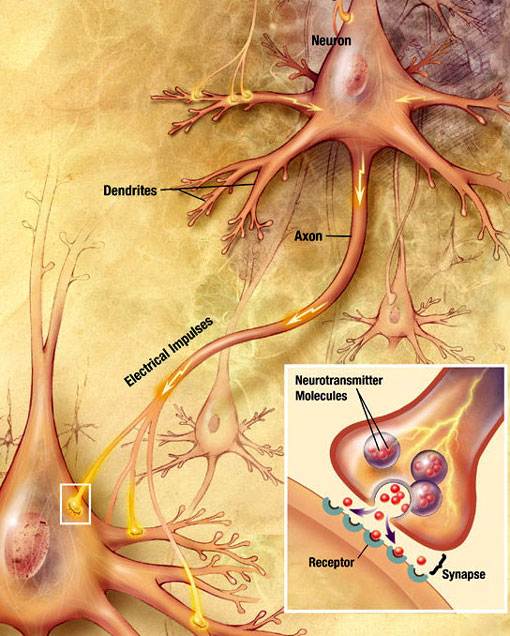
Eine elektrochemische Welle, die als Aktionspotential bezeichnet wird, wandert entlang des Axons eines Neurons. Wenn das Aktionspotential das präsynaptische Terminal erreicht, wird eine kleine Menge Neurotransmittermoleküle freigesetzt, die an chemische Rezeptormoleküle binden, die sich in der Membran des postsynaptischen Neurons auf der gegenüberliegenden Seite des synaptischen Spalts befinden. Quelle: Wikimedia Commons.
Progressiver Dopaminverlust
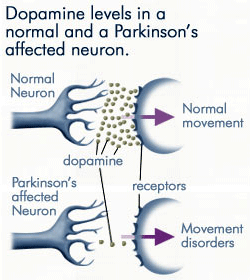
Da immer weniger Dopamin von den von der Parkinson-Krankheit betroffenen Neuronen produziert wird, steht weit weniger Dopamin zur Verfügung, um an die Dopaminrezeptoren auf der postsynaptischen Membran zu binden. Quelle: anti-agingfirewalls.com.
Obwohl der Dopaminzellverlust nicht direkt gemessen werden kann, zeigen Messungen bei neurologisch normalen Menschen und bei nichtmenschlichen Primaten einen langsam fortschreitenden Dopaminverlust mit zunehmendem Alter. Bei der Parkinson-Krankheit tritt der Verlust viel schneller auf, und sowohl biochemische Messungen als auch bildgebende Untersuchungen legen nahe, dass der Dopaminspiegel zum Zeitpunkt des Auftretens motorischer Symptome signifikant abnimmt. Aus dieser Sicht ist die Parkinson-Krankheit eine beschleunigte Version des Zelltods, der bei normalem Altern auftritt (Cookson, 2009). Dies wird in der folgenden Grafik veranschaulicht, die den Rückgang der dopaminergen Neuronen während des normalen Alterns, bei idiopathischer PD, bei PD, die durch Umwelt- oder genetische Faktoren verursacht wird, und bei früh einsetzender PD zeigt.
Entwicklung des Dopaminabbaus bei der Parkinson-Krankheit
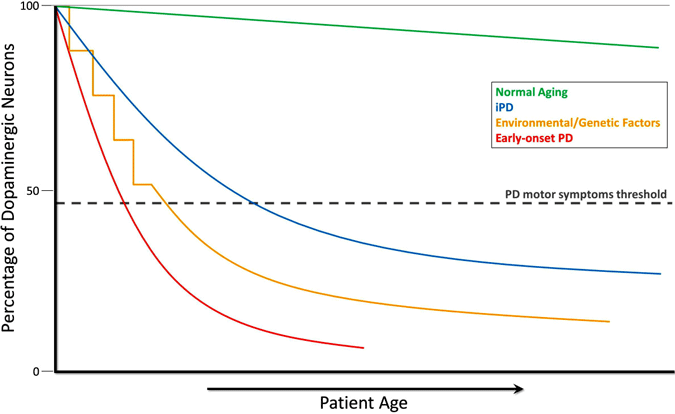
Im Verlauf des normalen Alterns (grüne Linie) tritt eine kleine, aber langsame dopaminerge Degeneration ohne motorische Symptome auf. Idiopathische PD (IPD, blaue Linie) ist unbekannter Herkunft, aber es wird angenommen, dass sie sich allmählich entwickelt, mit einer langsamen Degeneration von dopaminergen Neuronen, die später im Leben zu den klassischen PD-motorischen Symptomen führt. Ein anderes Modell der Dopamin-Neurodegeneration, das zu PD-motorischen Symptomen führt, beinhaltet eine wiederholte Exposition gegenüber umwelttoxischen Substanzen im Laufe der Zeit in Kombination mit einer genetischen Prädisposition für dopaminergen Neuronenverlust (gelbe Linie). Früh einsetzende PD (rote Linie), wie sie durch Mutationen im PARKIN-Gen verursacht wird, beinhaltet einen steilen Rückgang der dopaminergen Neuronen, und PD-motorische Symptome können Jahrzehnte vor denen bei idiopathischer PD auftreten. Ein weiteres Szenario (nicht gezeigt) der PD-Motorsymptomentwicklung beinhaltet mögliche in utero Umweltgifte oder genetische Faktoren, die zu einer atypisch geringen Anzahl von dopaminergen Neuronen bei der Geburt und einer erhöhten Anfälligkeit für die PD-Entwicklung führen (Haas et al., 2012).
Die Degeneration von Dopaminneuronen zeigt sich besonders in einem Teil der Substantia nigra, der Pars compacta. Signifikant erhöht der Verlust von Dopamin in der Pars compacta den gesamten exzitatorischen Antrieb in den Basalganglien, wodurch die freiwillige motorische Kontrolle gestört und die charakteristischen Symptome der PARKINSON-Krankheit verursacht werden. Eine Normalisierung der motorischen Funktion wird zunächst unter Levodopa-Behandlung beobachtet (Gasparini et al., 2013).
*Die Hauptbestandteile der Basalganglien sind das Striatum (Nucleus caudatus und Putamen), der Globus pallidus, die Substantia nigra, der Nucleus accumbens und der Nucleus subthalamicus.
Mit zunehmendem Schweregrad der PD führt der Abbau von Dopamin zu weiteren Veränderungen der Basalganglienbahnen, einschließlich einer veränderten Funktion anderer Basalganglien-Neurotransmitter wie Glutamat, GABA und Serotonin (Gasparini et al., 2013). Obwohl die dopaminproduzierenden Neuronen in der Substantia nigra relativ anfällig sind, sind bei der Parkinson-Krankheit nicht alle Dopaminzellen betroffen; In einigen Teilen des Gehirns sind die dopaminproduzierenden Neuronen relativ verschont (Cookson, 2009).
Der nigrostriatale Weg
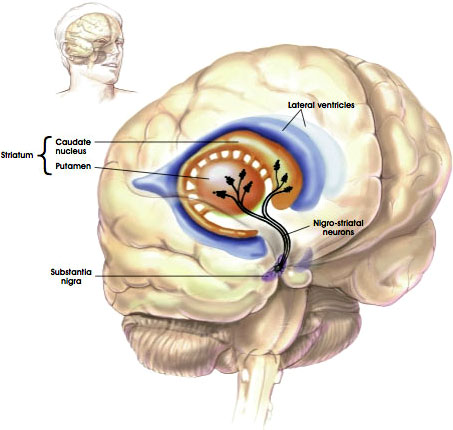
Quelle: NIH, n.d.
Lewy-Körper und Alpha-Synuclein
Lewy-Körper sind abnormale Aggregate und Proteineinschlüsse, die sich bei Menschen mit Parkinson-Krankheit in Nervenzellen entwickeln. Die Aggregationen bestehen üblicherweise aus unlöslichen fibrillären Aggregaten, die fehlgefaltete Proteine enthalten. Eine große Anzahl von Molekülen wurde in Lewy-Körpern identifiziert, aber ein Protein namens Alpha-Synuclein ist die Hauptkomponente.
Lewy-Körper (Alpha-Synuclein-Einschlüsse)
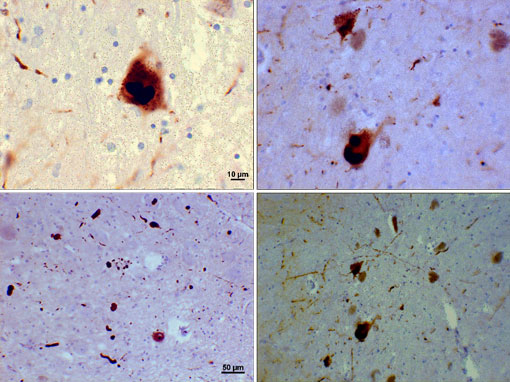
Mikroskopische Aufnahme von Regionen der Substantia nigra bei einem Parkinson-Patienten mit Lewy-Körpern und Lewy-Neuriten in verschiedenen Vergrößerungen. Die oberen Felder zeigen eine 60-fache Vergrößerung der intraneuronalen Alpha-Synuclein-Einschlüsse, die zu Lewy-Körpern aggregiert sind. Die unteren Platten sind 20 × Vergrößerungsbilder, die strangartige Lewy-Neuriten und abgerundete Lewy-Körper verschiedener Größen zeigen. Bilder mit freundlicher Genehmigung von Suraj Rajan.
Die Lewy-Pathologie umfasst viele Regionen des Gehirns, und einige Berichte deuten darauf hin, dass die Substantia nigra nicht der erste Ort ist, an dem sich Lewy-Körper bei der Parkinson-Krankheit bilden. Einschlüsse und Aggregate symbolisieren wahrscheinlich das Endstadium einer Kaskade komplizierter Ereignisse. Ein früheres Stadium kann direkter mit der Pathogenese der Störung verbunden sein als die Einschlüsse selbst, die diagnostische Merkmale darstellen können oder nicht.
Lewy-Körper werden auch in „Demenz mit Lewy-Körpern“ gesehen, was darauf hindeutet, dass diese Zustände durch gemeinsame Pathologie und möglicherweise durch gemeinsame Ätiologie miteinander verbunden sind. Weder der Zellverlust noch die Bildung von Lewy-Körpern ist absolut spezifisch für PD, aber beide sind für eine Diagnose von PD nach aktuellen Definitionen erforderlich (Cookson, 2009).
Es wird zunehmend erkannt, dass neurodegenerative Erkrankungen wie Alzheimer, frontal-temporale Degeneration, Prionenkrankheit, Chorea Huntington und Motoneuronerkrankungen gemeinsame zelluläre und molekulare Mechanismen aufweisen, einschließlich Proteinaggregation und Einschlusskörperbildung in bestimmten Bereichen des Nervensystems (Jellinger, 2011).
Entzündung und Immunantwort
Der Auslöser der dopaminergen Degeneration scheint multifaktoriell zu sein — sowohl von endogenen als auch von Umwelteinflüssen beeinflusst. Entzündungen und Immunreaktionen werden zunehmend als wichtige Mediatoren der dopaminergen Degeneration angesehen. Große Bevölkerungsstudien haben gezeigt, dass Personen, die nichtsteroidale entzündungshemmende Medikamente (NSAIDs) einnehmen, ein geringeres Risiko haben, eine idiopathische Parkinson-Krankheit zu entwickeln, was darauf hindeutet, dass entzündungshemmende Medikamente eine vielversprechende krankheitsmodifizierende Behandlung für Parkinson-Patienten sein können (Barcia, 2013).
In neuen Studienphasen wurden entzündungshemmende Behandlungen durchgeführt – insbesondere auf der Suche nach einem objektiven Biomarker für Behandlungen zur Verringerung entzündlicher Veränderungen bei Patienten mit Parkinson. Forscher verwenden Neuroimaging-Tools, um einen relevanten Biomarker zu entwickeln, mit der Absicht, dies in großen klinischen Bildgebungsstudien zu testen. Das Ergebnis dieser Studien wird Daten liefern, um das Fortschreiten entzündungshemmender Behandlungen für Parkinson zu testen und zu überwachen, und wird dazu beitragen, das rechtzeitige therapeutische Fenster zu identifizieren, um die entzündungsvermittelte dopaminerge Degeneration zu stoppen oder zumindest zu verlangsamen (Barcia, 2013).
Parkinsonismus
Parkinsonismus, auch bekannt als „atypischer Parkinson“, „sekundärer Parkinson“ oder „Parkinson—Syndrom“, ist ein neurologisches Syndrom, bei dem ein Patient einige der mit der Parkinson-Krankheit verbundenen Symptome aufweist – Tremor, Rigidität, Bradykinesie und Haltungsinstabilität. Aber Parkinson ist keine Parkinson-Krankheit. Es wird nicht angenommen, dass Parkinsonismus durch die Parkinson-Krankheit verursacht wird, und Patienten sprechen in der Regel schlecht auf pharmakologische Eingriffe an. Parkinsonismus hat oft eine identifizierbare Ursache, wie die Exposition gegenüber Toxinen, Methamphetamin, Trauma, mehrere Schlaganfälle, andere Störungen des Nervensystems oder Krankheit. Im Allgemeinen werden Lewy-Körper bei Parkinson nicht gesehen.
Der Begriff Parkinsonismus ist auch mit Störungen wie progressiver supranukleärer Lähmung, multipler Systematrophie, Lewy-Körper-Demenz, kortikobasaler Degeneration, vaskulärem Parkinsonismus, arzneimittelinduziertem Parkinsonismus und Parkinsonismus infolge einer Infektion und anderen Ursachen verbunden (Hohler et al., 2012). Eine Form des reversiblen Parkinsonismus kann durch die Verwendung bestimmter Neuroleptika, insbesondere Reserpin, Antipsychotika (Haloperidol) und Metoclopramid, auftreten. Die Exposition gegenüber bestimmten Toxinen, schweren Kohlenmonoxidvergiftungen und Quecksilbervergiftungen kann ebenfalls zu Parkinson führen.
Das Auftreten von Parkinson-Symptomen in den frühen 1980er Jahren bei einer Gruppe von Drogenabhängigen, die eine kontaminierte Charge eines synthetischen Opiats konsumiert hatten, führte zur Entdeckung der Chemikalie MPTP als Wirkstoff, der das Parkinson-Syndrom sowohl bei nichtmenschlichen Primaten als auch beim Menschen verursacht. MPTP kann bei der Herstellung einer Form von Heroin produziert werden (MPTP wird in ein Neurotoxin umgewandelt, das selektiv Dopaminzellen in der Substantia nigra zerstört). Diese Fälle sind selten und haben meist langfristige Drogenkonsumenten betroffen.
Methamphetaminmissbrauch wurde auch mit Parkinson in Verbindung gebracht. Bei Versuchstieren schädigt die Exposition gegenüber Methamphetamin die dopaminergen Fasern im Striatum * sowie die Zellkörper in der Substantia nigra, was die bei menschlichen Patienten mit Parkinson beobachtete Degeneration widerspiegelt. Selektive Schäden an dopaminergen Terminals im Striatum wurden auch bei menschlichen Methamphetaminkonsumenten beobachtet, obwohl es bisher keine Hinweise darauf gibt, dass Methamphetaminmissbrauch dopaminerge Zellkörper in der Substantia nigra schädigt (Granado et al., 2013).
*Der größte Kern der Basalganglien, das Striatum, besteht aus dem Nucleus caudatus und dem Putamen.
Es wurde die Hypothese aufgestellt, dass Methamphetaminkonsum Benutzer für die zukünftige Entwicklung von PD prädisponieren kann. Diese Hypothese wurde durch neuere epidemiologische Arbeiten gestützt, die darauf hindeuten, dass Methamphetaminkonsumenten ein erhöhtes Risiko haben, an Parkinson zu erkranken. Dies steht im Einklang mit den anhaltenden neurotoxischen Wirkungen von Methamphetamin bei Versuchstieren (Granado et al., 2013).
Patienten mit Parkinson sind oft schwer ambulant zu behandeln. Die Komplexität ihrer Symptome, die zusätzlichen kognitiven und autonomen Defizite, die schlechte Reaktion auf die meisten PD-Medikamente und der relativ rasche Statusrückgang tragen zu den Herausforderungen bei der Behandlung dieser Patienten bei, insbesondere wenn die Krankheit fortschreitet (Hohler et al., 2012).