Kaliumchromat
Kaliumchromat Chemische Eigenschaften, Verwendung, Herstellung
Anorganische Verbindung
Kaliumchromat, allgemein bekannt als Tarapacait, ist eine anorganische Verbindung, die bei Raumtemperatur ein gelber orthorhombischer oder hexagonaler Kristall ist. Die relative Dichte beträgt 2,732 und der Schmelzpunkt beträgt 968 ° C. Es ist giftig und kann sich in Wasser unter Bildung einer alkalischen Chromat-Ionen-Hydrolyselösung auflösen. Und es ist unlöslich in Alkohol und Ether. Nach Zugabe von Säure wird die gelbe Lösung von Kaliumchromat orange, was die Farbe von Dichromat ist. Es besteht ein Gleichgewicht zwischen der Umwandlung von Chromat und Dichromat in der Lösung: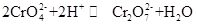
Wenn die Säure der Kaliumchromatlösung zugesetzt wird, verschiebt sich das Gleichgewicht in Richtung der Erzeugung von Kaliumdichromat, und wenn das Alkali der Kaliumdichromatlösung zugesetzt wird, verschiebt sich das Gleichgewicht in Richtung der Erzeugung von Kaliumchromat. Kaliumchromat hat oxidative Eigenschaften und kann mit dem Reduktionsmittel in alkalischem Medium unter Bildung von Cr (OH) 4- (nämlich CrO2-) reagieren. Durch Zugabe verschiedener Lösungen, die jeweils Bariumionen, Bleiionen und Silberionen enthalten, zur Kaliumchromatlösung wird das entsprechende unlösliche Chromat gebildet: Bariumchromat BaCrO4 (gelb), Bleichromat PbCrO4 (gelb), Silberchromat Ag2CrO4 (ziegelrot). Und die Anwesenheit von Chromat-Ionen kann durch die charakteristische Farbe dieser unlöslichen Chromate nachgewiesen werden. Kaliumchromat kann als analytisches Reagenz, Oxidationsmittel, Beizmittel, Metallrostschutzmittel und zur Analyse von Barium- und Silberspuren verwendet werden. Es kann auch als Rohstoffe der Gerb- und Medizinindustrie und anderer Chromverbindungen verwendet werden. Chromit Fe (CrO2) 2 Pulver kann als Rohstoff verwendet und mit Kaliumhydroxid, Kalkstein (Dolomit) in der Luft kalziniert und dann mit Kaliumsulfatlösung extrahiert werden, um Kaliumchromat zu erhalten.
Die obigen Informationen werden von Xiao Nan von Chemicalbook bearbeitet.
Kaliumchromat-Indikatormethode
Die Kaliumchromat-Indikatormethode, auch Moore (Mohr) genannt, ist eine Fällungstitrationsmethode (Silbermethode), bei der Kaliumchromat (K2CrO4) als Indikator und Silbernitrat (AgNO3) als Standardlösung verwendet werden. Diese Methode wird hauptsächlich zur Bestimmung von Chlorionen (Cl-) oder Bromidionen (Br-) verwendet. Vor der Bestimmung eine kleine Menge K2CrO4 als Indikator zugeben und anschließend mit AgNO3-Standardlösung titrieren. Nach Beginn der Titration fällt zuerst der Niederschlag von Weiß (Silberchlorid) oder hellgelb (Silberbromid) aus. Wenn Cl- oder Br-quantitativ ausfällt, führt ein wenig überschüssige Silbernitratlösung dazu, dass die Konzentration von Ag + plötzlich ansteigt, um sofort einen ziegelroten Silberchromat (Ag2CrO4) -Niederschlag zu erzeugen, der den Titrationsendpunkt anzeigt. Die Indikatormenge und der Säuregehalt der Lösung sind zwei Hauptprobleme dieser Titrationsmethode. Wenn die K2CrO4-Konzentration zu hoch ist, ist die Farbe der Titrierlösung zu tief, um die Beobachtung der Ag2CrO4-Fällungsfarbe am Ende zu behindern; Wenn die K2CrO4-Konzentration zu niedrig ist, wird nach der quantitativen Ausfällung von Silberhalogenid eine übermäßig beträchtliche Menge Silbernitratlösung benötigt, um eine Silberchromatausfällung zu erzeugen, um den Titrationsendpunkt anzuweisen, wodurch der Titrationsfehler zunimmt. Wenn die 0,1 mol/l AgNO3-Lösung verwendet wird, um die 0 zu titrieren.1mol / l Halogenid, wenn die Konzentration von K2CrO4 5 × 10-3mol / l beträgt, beträgt der Endpunktfehler nur +0,06%, was angenommen werden kann, dass die Genauigkeit des Analyseergebnisses nicht beeinträchtigt wird. Die K2CrO4-Indikatormethode kann nicht in saurer oder alkalischer Lösung durchgeführt werden, da K2CrO4 bei einem kleinen pH-Wert in Kaliumdichromat (K2Cr2O7) umgewandelt wird und Ag + bei zu hohem pH-Wert in Form von Silberoxid (Ag2O) ausfällt. Üblicherweise ist der geeignete Säurebereich pH = 6,5 ~ 10,5, aber wenn Ammoniumsalze in Lösung sind, ist der Säuregehalt der Lösung pH = 6,5 ~ 7,2 angemessen.
Die Kaliumchromatindikatormethode kann nur für die direkte Titration von Cl- oder Br-Ionen verwendet werden, und das Titrationsergebnis ist ihre Summe bei Koexistenz. Diese Methode eignet sich nicht zur Bestimmung von Iodidionen (I-) oder Thiocyanationen (SCN-), da diese durch Sedimentation zu leicht absorbiert werden und der Endpunkt unklar ist. Diese Methode ist auch nicht für die Titration von Ag + mit Cl- geeignet, aber Ag + kann unter Verwendung der Rücktitration bestimmt werden, nämlich eine übermäßige Menge an NaCl-Standardlösung in die Testlösung geben und dann AgNO3-Standardlösung verwenden, um überschüssige Cl-Ionen zu titrieren. In der Lösung stören alle Kationen, die mit CrO2-4 Ausscheidungen bilden können, oder die Anionen, die mit Ag + ausfallen können, die Bestimmung. Kaliumchromat-Indikatormethode wird hauptsächlich für die Bestimmung der Cl-Ionen in sehr verdünnter Lösung, wie die Bestimmung von Cl-in Trinkwasser und Industrieprodukten Verunreinigungen verwendet.
Kaliumdichromat
Kaliumdichromat, auch bekannt als rotes Alaunkalium, ist ein orangeroter trikliner Kristall oder nadelartiger Kristall. Die Dichte beträgt 2,676 g / cm3. Die Schmelztemperatur beträgt 398 °C. Es ist in Wasser löslich und in Ethanol unlöslich. Es hat starke oxidierende Eigenschaften und zersetzt sich bei 1300 ° C.
In der Produktion wird Kaliumdichromat immer verwendet, um Chrom einzuführen, um den Zahnschmelz beim Schmelzen zu färben. Es ist das Färbemittel von gefärbter titanmilchgelber Glasur und titangelber Glasur, und die verwendete Dosierung beträgt im Allgemeinen 0,06% ~ 0,12%. Kaliumdichromat und Kupferoxid können auch gemischt werden, um grüne, bambusgrüne, fruchtgrüne und andere Farbglasuren zu erhalten. Diese farbigen Glasuren sind jedoch aufgrund des Einflusses von Chromat im Allgemeinen weniger glänzend.
Die aus Chromoxid oder Kalium (Natrium) Dichromat erhaltene Farbglasur ist aufgrund der Valenzänderung von Chromionen im Schmelzprozess häufig gelbgrün. Kaliumdichromat wird auch häufig verwendet, um verschiedene grüne Pigmente und rosa Pigmente herzustellen.
Kaliumdichromat sollte die erforderlichen Ziele erfüllen: Kaliumdichromatgehalt ≥ 99%, Chloridgehalt (Cl) ≤ 0,08%, wasserunlöslich ≤ 0,05%.
Die obigen Informationen werden von Yaoyao von Chemicalbook zusammengestellt.
Löslichkeit in Wasser (g/100ml)
Gelöste Gramm pro 100 ml Wasser bei verschiedenen Temperaturen (°C):
60 g / 10 ° C; 63,7 g / 20 ° C; 66,7 g / 30 ° C; 67,8 g / 40 ° C
70,1 g / 60 ° C; 74,5 g / 90 ° C
Toxizität
Siehe Natriumchromat
Chemische Eigenschaften
Zitronengelber orthorhombischer Kristall; Löslich in Wasser; unlöslich in Alkohol
Anwendung
Verwendet als analytisches Reagenz, Oxidationsmittel, Beizmittel und Metallrostschutzmittel; verwendet für die Herstellung von Chromat, verwendet als Oxidationsmittel und Beizmittel des Druckens und Färbens. Verwendet für tinte, farbe, emaille, metall korrosion und so weiter, vor allem bei der herstellung von chemischen reagenzien und pigmente.
Zubereitung
Neutralisationsmethode: Kaliumdichromat in der Mutterlauge und Wasser auflösen und dann die Mischung in den Reaktor geben. Als nächstes fügen Sie Kaliumhydroxid unter Rühren hinzu, um eine Neutralisationsreaktion durchzuführen. Das erzeugte Kaliumchromat wird schwach alkalisch und dann zur Konzentration eingedampft, zur Kristallisation abgekühlt, abgetrennt und getrocknet, um die fertigen Kaliumchromatprodukte zu erhalten.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Die abgetrennte Mutterlauge wird zum Auflösen von Kaliumdichromat in den Lösungsschritt zurückgeführt.
Chemische Eigenschaften
zitronengelbe Kristalle
Chemische Eigenschaften
Kaliumchromat (VI) ist ein gelber kristalliner Feststoff.
Verwendet
Kaliumchromat (K2CrO4) ist in wasser löslich und wird verwendet, um helle gelb inksand farbe pigmente. Es wird auch als Reagenz in chemischen Labors und als Beizmittel zum „Fixieren“ von Farbstoffen in farbigen Textilien verwendet.
Verwendet
Es wird als Oxidationsmittel verwendet.
Verwendet
Hat eine begrenzte Anwendung in emails, finishing leder, Rostschutz von metallen, ersetzt durch das natriumsalz; als Reagenz in der analytischen Chemie.
Definition
ChEBI: Ein Kaliumsalz, bestehend aus Kalium- und Chromat-Ionen im Verhältnis 2:1.
Definition
Ein Salz, das das ionCrO42- enthält.
Definition
Kaliumchromat: Ein hellgelber kristalliner Feststoff, K2CrO4, löslich in Wasser und unlöslich in Alkohol;rhombisch; r.d. 2.73; Schmp. 968.3 ° C; zersetzt sich ohne zu kochen. Es wird industriell hergestellt, indem pulverförmiges Chromerz mit Kaliumhydroxid und Kalkstein geröstet und die resultierende Schlacke mit heißer Kaliumsulfatlösung ausgelaugt wird. Potassiumchromate wird im leatherfinishing, als Textilbeizmittel und inenamels und Pigmente benutzt. Im Labores wird als analytisches verwendetreagenz und als Indikator. Wie andere Chrom (III) -verbindungen ist es giftig, wenn es eingenommen oder inhaliert wird.
Allgemeine Beschreibung
Kaliumchromat ist ein gelber kristalliner Feststoff. Kaliumchromat ist in Wasser löslich. Die primäre Gefahr ist die Bedrohung der Umwelt. Es sollten sofort Maßnahmen ergriffen werden, um seine Ausbreitung in die Umwelt zu begrenzen. Kaliumchromat wird in der chemischen Analyse, bei der Herstellung von Pigmenten für Farben und Tinten, als Fungizid und zur Herstellung anderer Chromverbindungen verwendet.
Luft & Wasser Reaktionen
Löslich in wasser.
Reaktivitätsprofil
Oxidationsmittel wie Kaliumchromat können mit Reduktionsmitteln reagieren, um Wärme und Produkte zu erzeugen, die gasförmig sein können (was zu einer Druckbeaufschlagung geschlossener Behälter führt). Die Produkte können selbst zu weiteren Reaktionen (wie Verbrennung in der Luft) fähig sein. Die chemische Reduktion von Materialien dieser Gruppe kann schnell oder sogar explosiv sein, erfordert jedoch häufig eine Initiierung (Hitze, Funken, Katalysator, Zugabe eines Lösungsmittels). Explosive Gemische von anorganischen Oxidationsmitteln mit Reduktionsmitteln bleiben oft lange unverändert, wenn eine Initiierung verhindert wird. Solche Systeme sind typischerweise Mischungen von Feststoffen, können aber jede Kombination von physikalischen Zuständen beinhalten. Einige anorganische Oxidationsmittel sind Salze von Metallen, die in Wasser löslich sind; Die Auflösung verdünnt, macht aber die Oxidationskraft solcher Materialien nicht zunichte. Organische Verbindungen haben im Allgemeinen eine gewisse Reduktionskraft und können prinzipiell mit Verbindungen dieser Klasse reagieren. Die tatsächliche Reaktivität variiert stark mit der Identität der organischen Verbindung. Anorganische Oxidationsmittel können heftig mit aktiven Metallen, Cyaniden, Estern und Thiocyanaten reagieren.
Gefahr
Giftig bei Verschlucken und Einatmen.
Gesundheitsgefährdung
Einatmen verursacht lokale Reizung der Schleimhäute; anhaltende Nasenreizung kann zur Perforation der Nasenscheidewand führen. Verschlucken kann heftige Gastroenteritis, Kreislaufkollaps, Schwindel, Koma und toxische Nephritis verursachen; Die Einnahme übermäßiger Mengen kann tödlich sein. Kontakt mit den Augen verursacht schwere Reizungen und Konjunktivitis. Wiederholte oder längere Exposition gegenüber Staub, Nebel oder Lösungen kann Dermatitis verursachen; Kontakt mit Brüchen in der Haut kann dazu führen, `Chrom Wunden“ erscheinen als langsam heilende, hart umrandeten Geschwüre, die den Bereich anfällig für Infektionen verlassen.
Brandgefahr
Verhalten im Brandfall: Kann bei Kontakt mit brennbaren Stoffen die Intensität des Brandes erhöhen. Behälter und verschüttetes Material mit viel Wasser kühlen.
Sicherheitsprofil
Bestätigtes Karzinogenmit experimentellen tumorigenen Daten. Giftdurch Einnahme, intravenös, subkutan undintramuskuläre Wege. Ein experimentelles Teratogen. Andere experimentelle Reproduktiveeffekte. Menschliche Mutationsdaten berichtet. Apowerful Oxidationsmittel. Wenn todecomposition erhitzt emittiert es giftige Dämpfe von K2O.Used als Beizmittel für Wolle, in der oxidizingand Behandlung von Farbstoffen auf Materialien. Siehe AUCHCHROMVERBINDUNGEN.
Mögliche Belichtung
Kaliumchromat wird beim Drucken verwendet: photomechanische Verarbeitung; chrom-pigment produktion; und wolle konservierungsmittel methoden; zu machen farbstoffe, pigmente, tinten und emails; als oxidationsmittel; analytische reagenz; in galvanik; sprengstoffe.
Versand
UN1479 Oxidierender Feststoff, n.a.g., Gefahrenklasse: 5.1; Etiketten: 5.1-Oxidationsmittel, Technische Bezeichnung erforderlich. UN3288 Toxische Feststoffe, anorganisch, n.a.g., Gefahrenklasse: 6.1; Etiketten: 6.1-Giftige Materialien, Technische Bezeichnung erforderlich
Reinigungsmethoden
Kristallisieren Sie es aus Leitfähigkeitswasser (0,6 g / ml bei 20 o) und trocknen Sie es zwischen 135 o und 170 o.
Unverträglichkeiten
Ein starkes Oxidationsmittel. Heftige Reaktionen mit brennbaren Stoffen, organischen Stoffen, Metallpulver; oder leicht oxidierbaren Substanzen. Kontakt mit Hydroxylamin, Hydrazin verursacht Explosion.