Klüver-Bucy-Syndrom nach traumatischer Hirnverletzung: Eine systematische Synthese und Überprüfung der pharmakologischen Behandlung von Fällen bei Jugendlichen und Erwachsenen
Das Klüver-Bucy-Syndrom (KBS) ist eine seltene neuropsychiatrische Störung, die nach einer traumatischen Hirnverletzung (TBI) auftreten kann. Das Syndrom wurde erstmals 1937 als experimentelles neurobehaviorales Syndrom bei Affen mit bitemporalen Hirnläsionen1 beschrieben; sowohl transient2 als auch permanent KBS bei Menschen3 wurden anschließend beobachtet. Das Syndrom ist durch komplexe Verhaltensweisen gekennzeichnet, einschließlich Gelassenheit, visueller Agnosie, veränderter sexueller Aktivität, Hyperoralität, Gedächtnisstörungen, Hypermetamorphose sowie Veränderungen des emotionalen und Ernährungsverhaltens.4-6 Der psychologische Status bei Patienten mit KBS hängt nicht nur vom Ausmaß und Ort der Läsion ab, sondern auch vom Grad der emotionalen und intellektuellen Entwicklung vor der Verletzung und vom Ausmaß der sozialen Stimulation nach einer Hirnschädigung. Die Diagnose von KBS erfordert nicht, dass sich alle Symptome gleichzeitig manifestieren, und eine vollständig symptomatische KBS ist selten.3,6,7
KBS ist normalerweise mit Läsionen der Amygdala oder der Amygdaloidwege assoziiert. Es wurde bei Patienten mit einer Vielzahl von Pathologien berichtet, darunter Herpes-simplex-Enzephalitis, 8 Huntington-Krankheit, 9 Alzheimer-Krankheit, 10 Adrenoleukodystrophie, 11 Hitzschlag, 12 Meningitis, 13 Multiple Sklerose, 14 Pick-Krankheit, 15 temporale Epilepsie, 16 und Reye-Syndrom.17 Diese neurologischen Störungen sind mit einer Zerstörung oder Funktionsstörung bilateraler mesialer Temporallappenstrukturen verbunden.7 Es gibt derzeit keine definitiven KBS-Behandlungsempfehlungen. KBS-Symptome werden symptomweise behandelt, im Gegensatz zu einer Pharmakotherapie, die für KBS als Ganzes verschrieben wird.
Angesichts der seltenen Darstellung von KBS sowohl in der klinischen Praxis als auch in der akademischen Literatur hat sich unser Verständnis von KBS nach TBI aufgrund des Mangels an verfügbaren Daten höherer Qualität hauptsächlich auf Fallberichte gestützt. Die Richtlinien der französischen Gesellschaft für Physikalische Medizin und Rehabilitation (SOFMER) für das Pflegemanagement von Verhaltensstörungen nach TBI berichteten über Beweise der Stufe 4 Grad C für die Behandlung mit Carbamazepin auf der Grundlage der Erfahrung von vier Patienten mit posttraumatischen Läsionen lokalisiert bitemporal, die KBS entwickelten.18 Für die vier Patienten in der Fallserie berichtete der Artikel, dass mehrere Symptome dramatisch auf Carbamazepin ansprachen.19,20 Die Symptome wurden nicht angegeben. Von den vier Patienten hatten jedoch zwei Kopfverletzungen unbestimmten Ursprungs.19,20 Die Leitlinien kamen zu dem Schluss, dass Carbamazepin ein nützliches Mittel bei der Behandlung dieses ungewöhnlichen Syndroms ist.
Ziel dieser Studie war es, auf den in den SOFMER-Richtlinien berichteten Ergebnissen mit einer umfassenderen Überprüfung der Fallberichte aufzubauen. Daher war das ursprüngliche Ziel dieser systematischen Überprüfung, Fallberichte zu verwenden, um KBS bei Jugendlichen und Erwachsenen zu beschreiben, die eine TBI erlitten hatten. Das zweite Ziel bestand darin, Einzelfallberichte für Patienten mit KBS nach TBI zu vergleichen und zu kontrastieren, für die eine Verschreibung von Pharmakotherapien gemeldet wurde. Angesichts der möglichen Auswirkungen von Entwicklungsproblemen bei Kindern konzentriert sich diese Überprüfung auf Jugendliche und Erwachsene. Obwohl eine kleine Anzahl von Bewertungen KBS nach TBI berücksichtigt hat,7,21 Soweit uns bekannt ist, KBS nach TBI stand nicht im Mittelpunkt einer systematischen Überprüfung.
Diese Übersicht ist Teil eines größeren Projekts zur Synthese der Evidenz für das pharmakologische Management neurobehavioraler Symptome nach TBI als Auftakt zur Entwicklung einer klinischen Leitlinie. Diese systematische Überprüfung trägt neben dem akademischen und klinischen Expertenkonsens zur Entwicklung evidenzbasierter Empfehlungen für das pharmakologische Management komplexer Neuroverhaltensweisen bei, einschließlich KBS bei Patienten nach TBI.
Vor Beginn der Überprüfung durchsuchten wir die PROSPERO-Datenbank und die Joanna Briggs-Datenbank, um sicherzustellen, dass die vorgeschlagene Arbeit keine laufenden Arbeiten dupliziert. Diese systematische Überprüfung wird gemäß den bevorzugten Berichtspunkten für systematische Überprüfungs- und Metaanalyse-Richtlinien berichtet.
Einschluss- und Ausschlusskriterien
Die vorliegende Überprüfung beschränkte sich auf Fallberichte und Fallserien menschlicher Teilnehmer, die als Volltextartikel verfügbar waren. Fallberichte und Serien von Jugendlichen und Erwachsenen (Alter: ≥13 Jahre), sowohl männlich als auch weiblich, die eine TBI mit partiellen oder vollständigen KBS-Symptomen erlitten hatten, wurden für die Aufnahme in Betracht gezogen. TBI wurde definiert als eine Veränderung der Gehirnfunktion oder andere Hinweise auf eine Hirnpathologie, die durch eine äußere Kraft verursacht wurden. Die Studien wurden unabhängig von der Schwere der Verletzung oder dem Mechanismus der Verletzung eingeschlossen. Teilnehmer mit durchdringenden und nicht durchdringenden Kopfverletzungen waren teilnahmeberechtigt.
Die folgenden werden als charakteristische KBS-Symptome angesehen:6 placidity (Verlust der normalen Wut oder Angst); Hyperoralität (Tendenz, Objekte im Mund zu erkunden); visuelle Agnosie (Unfähigkeit, Objekte ohne Verlust der groben visuellen Diskriminierung zu erkennen); Hypermetamorphose (Tendenz, Objekte im Gesichtsfeld zu betreuen und zu manipulieren); wahlloses Ernährungsverhalten, einschließlich Hyperphagie (ein übermäßiger, unersättlicher Appetit); und Hypersexualität. Die Diagnose der vollständigen Form des Syndroms basiert auf dem Auftreten aller oben genannten Symptome.6 Die Diagnose der partiellen Form des Syndroms erfordert das Vorhandensein von drei oder mehr Symptomen.4,6 Studien, in denen die Diagnose von KBS auf weniger als drei Symptomen beruhte, wurden von der Überprüfung ausgeschlossen.
Um aufgenommen zu werden, mussten Fallberichte medizinische Beweise für TBI vorlegen — dh eindeutige TBI, die in Krankenakten oder anderen Gesundheits- oder medizinischen Berichten dokumentiert sind, die vom Forschungsteam im Zusammenhang mit dem veröffentlichten Artikel zitiert wurden. Beispiele für eindeutige Beweise sind Befunde aus der Bildgebung des Gehirns (z. B. Computertomographie , Magnetresonanztomographie ), Glasgow Coma Scale (GCS) Score, posttraumatische Amnesie und Bewusstlosigkeit.
Studien in einer anderen Sprache als Englisch wurden einbezogen, wenn den Forschern ein Übersetzungsdienst zur Verfügung stand. Die folgenden Studien wurden ausgeschlossen: Fallberichte oder Serien von Kindern bis zum Alter von 13 Jahren; Fallberichte oder Serien, in denen der Mechanismus der Verletzung nicht klar angegeben war und daher nicht geschlossen werden konnte, dass TBI im Mittelpunkt stand; und Fallstudien, die auf Selbstberichten von TBI entweder von der Person oder von einem Informanten basieren, in Ermangelung anderer medizinischer Beweise in Bezug auf die Kopfverletzung, wie oben beschrieben.
Eine Beschreibung des Syndroms nach TBI mit Schwerpunkt auf demografischen und Verletzungsmerkmalen, Bildgebung des Gehirns, Symptomen und Pharmakotherapie wird bereitgestellt. Die Ergebnisse, die im Mittelpunkt dieser Überprüfung standen, waren die Wirksamkeit der Behandlung, gemessen an der Auflösung oder Verbesserung der KBS-Symptome; allgemeine Genesung; und Schäden, einschließlich unerwünschter Ereignisse, die sich aus der verschriebenen Pharmakotherapie ergeben.
Suchstrategie
Die Suchstrategie wurde auf der Grundlage der für diese Überprüfung relevanten Elemente Population-Intervention-Comparator-Outcome entwickelt (die Population war in diesem Fall KBS sekundär zu TBI). Es enthielt eine Reihe von Begriffen und Schlüsselwörtern für medizinische Überschriften, die durch Boolesche Operatoren verknüpft waren. Die Durchsuchungen wurden am 20.Dezember 2016 durchgeführt und am 5. November 2017 wiederholt. Die Begriffe wurden für jede Datenbank entsprechend geändert. Die folgenden Datenbanken wurden ohne Datum durchsucht, Alter, oder Sprachbeschränkung: MEDLINE: OVID SP-Schnittstelle; EMBASE: Excerpta Medica Datenbank, PsycINFO: OVID SP interface; und SCOPUS. Die MEDLINE-Suchbegriffe und die Anzahl der Ergebnisse für jede Datenbank sind in der Online-Ergänzung enthalten.
Um die Suche so umfassend wie möglich zu gestalten, haben wir die formale Suche in bibliografischen Datenbanken um Suchanfragen von Google Scholar und ResearchGate ergänzt. Wir führten auch eine elektronische Suche in den folgenden Online-Zeitschriften durch: Brain Injury, Neuropsychology, Journal of Neurotrauma, Neurocase und BMJ Case Reports. Wir haben Referenzlisten und Bibliografien der abgerufenen Artikel überprüft, um Forschungsergebnisse zu identifizieren, die nicht über andere Suchstrategien gefunden wurden. Schließlich fragten wir die Kollegen, ob sie Kenntnis von Fallberichten in diesem Bereich hätten.
Studienauswahl
Die Ergebnisse der vier Datenbanksuchen wurden in Endnote×7 heruntergeladen und dedupliziert. Titel und Abstracts wurden von zwei unabhängigen Gutachtern (FC, AK) auf die Einschluss- und Ausschlusskriterien für die Überprüfung überprüft. Studien, die möglicherweise die Einschlusskriterien im Titel- und Abstract-Stadium erfüllten, wurden vollständig abgerufen und von zwei Mitgliedern des Review-Teams (FC, AK) unabhängig anhand der Einschlusskriterien bewertet. Ein Artikel könnte in die Überprüfung aufgenommen werden, wenn er mindestens einen relevanten Fall enthält. Artikel, die sowohl relevante Fälle als auch Fälle enthielten, die die Einschlusskriterien nicht erfüllten (z. B. aufgrund des Alters des Patienten oder weil KBS nicht sekundär zu TBI war), waren weiterhin förderfähig. Die Diskussion zwischen den Gutachtern wurde genutzt, um eine Einigung über die Förderfähigkeit zweier Studien zu erzielen. Volltextstudien, die die Einschlusskriterien nicht erfüllten, wurden ausgeschlossen, und die Gründe für den Ausschluss sind in Abbildung 1 angegeben.
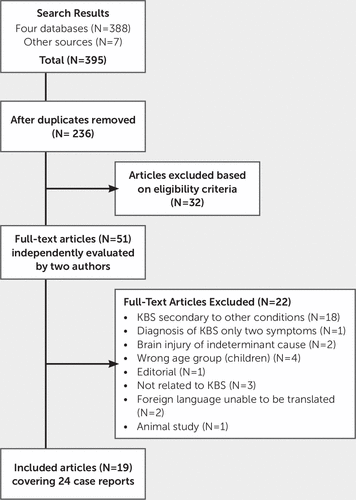
ABBILDUNG 1. Studien eingeschlossen und ausgeschlossen in der Analyse
ein KBS=Klüver-Bucy-Syndrom.
Bewertung der methodischen Qualität
Die Qualität wurde von drei Gutachtern (FC, AK, EA) anhand der Acht-Fragen-Checkliste des Joanna Briggs Institute Critical Appraisal für Fallberichte bewertet. (Diese Checkliste ist in der Online-Beilage enthalten.) Kurz gesagt, die Fragen bewerten die Qualität der Berichterstattung über die demografischen Merkmale des Patienten, den aktuellen klinischen Zustand, diagnostische Tests oder Bewertungsmethoden, Interventionen oder Behandlungen, den klinischen Zustand nach der Intervention, Schäden und unerwartete Folgen sowie Lektionen zum Mitnehmen.
Datenextraktion
Wo verfügbar, wurden die folgenden Daten aus den enthaltenen Fallberichten mit einem angepassten Datenextraktionstool extrahiert Pilotversuch an zwei Fallberichten von KBS sekundär zum Herpes-simplex-Virus (FC, AK). Nach dem Pilotprojekt wurden geringfügige Änderungen am Datenextraktionstool vorgenommen. Um die Interpretation der Daten zu erleichtern, wollten wir sicherstellen, dass einer der an der Datenextraktion beteiligten Prüfer einen medizinischen Abschluss (AK) hat. Die spezifischen extrahierten Datenelemente sind, sofern verfügbar, wie folgt.
Wir extrahierten Daten über das Land des Falles; Alter, Geschlecht und Mechanismus der Verletzung des Falles; und Bericht über Bewusstseinsverlust (auf der Grundlage von GCS-Score und Vorhandensein oder Fehlen von Koma). Wir haben auch Informationen über die Studienpopulation gesammelt: TBIs (andere Verletzungen als am Kopf, Zeit nach Verletzung), KBS-Syndromsymptome, ob KBS vollständig oder teilweise war, Zeit bei KBS-Beginn und Dauer von KBS. Wir extrahierten Daten zur verwendeten Bildgebung (CT, MRT) und zur Pharmakotherapie Intervention, wenn eine verwendet wurde, einschließlich Art der pharmakologischen Verbindung, Dosis, Häufigkeit und Dauer, und Cointerventions und ihre Details. Wir verfolgten die Ergebnisse und wann sie gemessen wurden, sowie das Ansprechen auf die Behandlung und unerwünschte Ereignisse in der Behandlung.
Ergebnisse
Studienauswahl
Die Suchstrategie ergab eine Anfangsausbeute von 388 Referenzen aus vier bibliografischen Datenbanken. Sieben potenziell relevante Referenzen wurden von Google Scholar identifiziert. Nach dem Entfernen von Duplikaten blieben 236 Referenzen übrig. Davon wurden 185 Referenzen entweder aufgrund des Titels oder des Abstracts ausgeschlossen.
Der vollständige Text von 51 Artikeln wurde zur detaillierten Bewertung abgerufen; Nach unabhängiger Überprüfung durch zwei Autoren (FC, AK) erfüllten 32 Artikel die Einschlusskriterien nicht. Primäre Gründe für den Ausschluss waren falsches Studiendesign (kein Fallbericht) oder Population außerhalb des Geltungsbereichs (Studien mit Kindern oder Tieren, KBS sekundär zu anderen Bedingungen als TBI). Eine auf Italienisch veröffentlichte Studie wurde von einem Doktoranden übersetzt. Ein potenzieller Fallbericht, der auf Polnisch veröffentlicht wurde, wurde nach Übersetzung durch einen Mitarbeiter ausgeschlossen. Eine englische Version eines weiteren Papiers in polnischer Sprache war verfügbar; Daher wurde die polnische Version ausgeschlossen. Nach einer unabhängigen Überprüfung erfüllten 19 Artikel, die sich auf 24 Fallberichte bezogen, die Einschlusskriterien für die Überprüfung. Die Suchstrategie ist in Abbildung 1 dargestellt.
Datensynthese
Die Ergebnisse der 24 Fälle werden als narrative deskriptive Synthese präsentiert, die um die Merkmale des Einzelfallberichts, die Schwere der Verletzung, die Bildgebung des Gehirns, die KBS-Symptome, den Einsatz von Pharmakotherapie und die Behandlungsergebnisse strukturiert ist.
Demografische Merkmale
Die enthaltenen Fallberichte wurden zwischen 1968 und 2017 veröffentlicht. Die Hälfte der Fallberichte (N= 12) stammte aus den Vereinigten Staaten, der Rest aus Indien (N = 2), 22,23 der Türkei (N = 1), 24 Japan (N = 1), 25 Italien (N = 1), 26 Polen (N = 4), 19,20,27 und den Niederlanden (N = 3).28 Der eingeschlossenen Fallberichte, 70,1% bezogen sich auf Männer und Jungen (N = 17). Das mittlere Verletzungsalter für die 21 Fallberichte, in denen das Alter angegeben wurde, betrug 25,1 Jahre mit einer Spanne von 13 bis 67 Jahren. In drei weiteren Berichten wurde entweder Anfang 20 oder Ende 20 angegeben.7,29 Der häufigste Verletzungsmechanismus war ein Verkehrsunfall (N = 17, 70,1%). Es gab drei Fallberichte von KBS nach Schussverletzungen,7,35,36 und jeweils zwei nach einem Sturz19,20,32 oder sportbedingten Unfall.7,33 Demografische, bildgebende und Verletzungsmerkmale der Probanden in den eingeschlossenen Studien sind in Tabelle 1 dargestellt.
| Studie | Fall | Alter bei Verletzung (Jahre) | Geschlecht | Land | Mechanismus der Verletzung | Bewusstseinsverlust | Glasgow Coma Scale (GCS) Scorea | Gehirn-MRT und computergestützte Tomographie Ergebnisse |
|---|---|---|---|---|---|---|---|---|
| Aygun et al.24 | 29 | Männlich | Türkei | Verkehrsunfall | Nein | 14 | Kontusionen bilateraler Temporallappen | |
| Bhat et al.22 | 30 | Männlich | Indien | Verkehrsunfall | Nicht gemeldet | Nicht gemeldet | Leichte Atrophie des rechten vorderen temporalen Gyrus | |
| Caro und Jimenez7 | Ende 20 | Männlich | USA | Sport | Nein | Erhöhte Größe der Frontallappen; Läsionen der rechten parietalen weißen Substanz; infratentorielle Läsionen in Kleinhirnhemisphären | ||
| Deginal und Changty23 | 16 | Männlich | Indien | Verkehrsunfall | Ja | 10 | Bilaterale temporale Kontusionen mit Ödemen | |
| Fiume und Fiume Garelli26 | 23 | Männlich | Italien | Verkehrsunfall | Comab | Bildgebung nicht durchgeführt; Kraniotomie subtemporal | ||
| Góscínski et al.19,20 | 1 | 23 | Männlich | Polen | Verkehrsunfall | Ja | 4 | Linkes subdurales Hämatom |
| Rechtsseitiges Hirnödem | ||||||||
| Góscínski et al.19,20 | 2 | 67 | Männlich | Polen | Herbst | Ja | 7 | Intrazerebrales bitemporales Hämatom |
| Hardy und Aldridge2 | 16 | Männlich | USA | Feuerwaffe | Nein | Läsion des rechten Temporallappens | ||
| Hooshmand et al.34 | 16 | Weiblich | USA | Verkehrsunfall | Ja, Koma | Schädigung des rechten Temporallappens | ||
| Lingerie31 | 37 | Weiblich | USA | Feuerwaffe | Nein | Schädigung des Bitemporallappens | ||
| Kwiatwoski et al.27 | 1 | 16 | Männlich | Polen | Verkehrsunfall | Ja | 3 | Bilaterale Prellungen: temporal- und Parietallappen |
| Blutung in subkortikale Kerne; parazerebrales Hämatom | ||||||||
| Kwiatwoski et al.27 | 2 | 16 | Weiblich | Polen | Verkehrsunfall | Ja, GCS Score=3 | Linkes temporales subdurales Hämatom | |
| Hämorrhagische Kontusion der rechten Hemisphäre und Hirnödem | ||||||||
| Lilly et al.6 | 57 | Männlich | USA | Verkehrsunfall | Ja | Bilaterale Schädigung der unteren Temporallappen | ||
| Morcos und Guirgis32 | 39 | Männlich | USA | Herbst | Ja | Inferiorer linker Temporalschaden | ||
| Moviat et al.28 | 1 | 13 | Weiblich | Niederlande | Verkehrsunfall | <7 | Linksseitiges parietales subdurales Hämatom; generalisiertes Ödem | |
| Verlust der basalen Zisternen; linke temporale plus rechte frontotemporale Kontusionen | ||||||||
| Moviat et al.28 | 2 | 13 | Weiblich | Niederlande | Verkehrsunfall | 7 | Linksseitiges parietales subdurales Hämatom; generalisiertes Ödem | |
| Verlust der Basalzisternen; bilaterale frontotemporale Kontusion | ||||||||
| Moviat et al.28 | 5 | 14 | Männlich | Niederlande | Verkehrsunfall | GCS Score=7 | Rechtes frontotemporales Hämatom; rechte Frontalatrophie | |
| Hypodensity im linken Thalamus | ||||||||
| Salim et al.48 | 24 | Weiblich | USA | Verkehrsunfall | Nein | 14 | Fokale axonale Verletzung des linken Temporallappens | |
| Slaughter et al.29 | 1 | Ende 20 | Männlich | Vereinigte Staaten | Verkehrsunfall | Ja | 3Tc | Linkes intraparenchymales Hämatom; Subarachnoidalblutung |
| Kontusionen des linken Schläfenlappens; bilaterale Vergrößerung-Schläfenhörner | ||||||||
| Slaughter et al.29 | 2 | Anfang 20 | Männlich | USA | Verkehrsunfall | Ja | 6 | Bilaterale kleine Frontallappenkontusionen |
| Smigielski und Boeve36 | 25 | Weiblich | Vereinigte Staaten | Verkehrsunfall | Nicht gemeldet | Nicht gemeldet | Bilaterale Temporallappenprellung; linksseitige Frontalverletzung | |
| Stewart35 | 20 | Männlich | Vereinigte Staaten | Verkehrsunfall | Nicht gemeldet | Nicht gemeldet | Bilaterale frontale und temporale Enzephalomalazie | |
| In: Yoneoka et al.25 | 17 | M | Japan | Sport | Ja, ja | Rechtsseitiges akutes subdurales Hämatom mit transtentorialer Herniation | ||
| York und McCarter30 | 25 | Männlich | Vereinigte Staaten | Firearm | 5Tc | Bifrontal- und Temporallappenprellungen |
aAt Krankenhauseinweisung, sofern nicht anders angegeben.
bNo Verlust des Bewusstseins oder GCS-Score berichtet.
Cverbale Reaktionen wurden nicht bewertet, da eine T-Röhre eingeführt wurde.
TABELLE 1. Demografische und Verletzungsmerkmale des Klüver-Bucy-Syndroms nach TBI bei Fallpersonen (N=24)
Schweregrad der Verletzung
Die Hälfte der Probanden hatte eine schwere Kopfverletzung erlitten, definiert durch einen GCS-Score < 8, Koma und aufgezeichneten Bewusstseinsverlust. Die Dauer des Bewusstseinsverlustes wurde nur in einem Fallbericht berichtet. Der GCS-Score wurde in 13 Berichten aufgezeichnet, mit einem gemeldeten Score < 8 in neun Fällen. Koma wurde in drei Fallberichten dokumentiert.25,26,34 Es gab vier Fälle, in denen Bewusstlosigkeit festgestellt wurde, aber der GCS-Score wurde nicht angegeben. In drei Fällen war der Schweregrad der Verletzung nicht verfügbar, da keine Informationen über den GCS-Score, das Koma oder den Bewusstseinsverlust gemeldet wurden.22,35,36
Bildgebung des Gehirns
Bildgebung des Gehirns (MRT oder CT) war für die meisten Fälle verfügbar (N=23). Läsionen wurden am häufigsten in den Temporallappen gefunden, wobei Temporallappenläsionen in 18 (90%) Fällen festgestellt wurden. Von den 15 Probanden (75%) mit Läsionen, die nur für die Temporallappen isoliert waren, zeigten 11 bilaterale Läsionen und zwei hatten einseitige Läsionen (links, N = 1; rechts, N = 1). Die Frontallappen waren in vier Fällen beteiligt. In drei dieser Fälle waren auch die Temporallappen beteiligt.
KBS-Symptome
Sexuelle Hyperaktivität oder unangemessenes Sexualverhalten war das häufigste KBS-Symptom, das in 95,8% der Fallberichte (N = 23) festgestellt wurde. Eine Änderung der Ernährungsgewohnheiten zu Hyperphagie oder Bulimie wurde in 20 Fällen berichtet, wobei Hyperphagie die häufigste Darstellung war (13 Fälle). Hyperoralität trat in 17 Fällen auf und Hypermetamorphose war in 13 Fällen vorhanden. Placidity wurde in 15 Fällen berichtet. In einigen dieser Fälle trat die placidity intermittierend mit Agitation und Aggression auf. Visuelle Agnosie war das am wenigsten verbreitete KBS-Symptom, wobei nur acht Fälle von visueller Agnosie berichteten. Vollständige und teilweise KBS basierten auf der Anzahl der präsentierenden KBS-Merkmale; In der Mehrzahl der eingeschlossenen Fälle war die KBS teilweise (N = 19; 79,1%), während der Rest voll war (N = 5; 20,9%).6,23–25,31
In Bezug auf die damit verbundenen klinischen Befunde wurden in vier Fällen Krampfanfälle und in 16 Fällen Gedächtnisprobleme gemeldet. Herausfordernde Verhaltensweisen im Zusammenhang mit KBS, einschließlich Impulsivität, Widerspenstigkeit, Agitation und Aggression (oft extrem), wurden in 16 Fällen festgestellt.
In den meisten Fällen traten KBS-Symptome früh nach TBI auf. In 12 Fällen trat dies in weniger als 7 Tagen nach TBI auf, und in fünf Fällen trat es zwischen 7 und 31 Tagen nach TBI auf. Keine Fälle von KBS wurden während des Komas diagnostiziert oder wenn eine Periode von Stupor beschrieben wurde.25 Symptome von KBS traten in einem Fall etwa 6 Monate nach TBI auf, 34 1 Jahr nach TBI in zwei Fällen, 22, 28 und 2 Jahre nach TBI in einem Fall.28 In zwei Fällen war es nicht möglich, den Zeitpunkt des Beginns zu bestimmen. Die KBS-Merkmale, einschließlich des Zeitpunkts des Beginns, und die damit verbundenen klinischen Befunde für jeden der enthaltenen Fallberichte sind in Tabelle 2 dargestellt.
| Studie | Fall | Zeit bei KBS Onsetb | Gedächtnis | Visuelle Agnosie | Ruhe | Ernährungsumstellung | Hyperaktivität | Sexuelle Hyperaktivität | Hypermetamorphosen | Verhalten | Vollständige oder teilweise KBS |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Aygunet al.24 | T1 | Nicht beschrieben | + | + | + | + | + | Nicht beschrieben | FA | Voll | |
| Bhat et al.22 | T3 | Nicht beschrieben | + | + | Nicht beschrieben | + | + | + | FA | Teilweise | |
| Caro und Jimenez7 | T5 | Nicht beschrieben | Nicht beschrieben | + | + | + | + | Nicht beschrieben | A | Teilweise | |
| Deginal und Changty23 | T2 | Nicht beschrieben | + | + | + | + | + | + | A | Voll | |
| Fiume und Fiume Garelli26 | T1 | + | Nicht beschrieben | + | + | + | + | + | D | Teilweise | |
| Góscínski et al.19,20 | 1 | T2 | + | Nicht beschrieben | Nicht beschrieben | + | + | + | Nicht beschrieben | A/FA | Teilweise |
| Góscínski et al.19,20 | 2 | T2 | Nicht beschrieben | Nicht beschrieben | Nicht beschrieben | + | + | + | + | A | Teilweise |
| Hardy und Aldridge2 | T1 | + | + | + | + | Nicht beschrieben | + | + | FA | Teilweise | |
| Hooshmand et al.34 | T3 | + | Nicht beschrieben | Nicht beschrieben | + | + | + | Nicht beschrieben | A | Teilweise | |
| Lingerie31 | T1 | + | + | + | + | + | + | + | A | Voll | |
| Kwiatwoski et al.27 | 1 | T1 | Nicht beschrieben | + | + | + | + | + | Nicht beschrieben | A | Teilweise |
| Kwiatwoski et al.27 | 2 | T1 | + | Nicht beschrieben | Nicht beschrieben | + | + | + | + | A/D | Teilweise |
| Lilly et al.6 | T2 | + | + | + | + | + | + | + | FA/R | Voll | |
| Morcos und Guirgis32 | T1 | + | Nicht beschrieben | Nicht beschrieben | + | Nicht beschrieben | + | + | A | Teilweise | |
| Moviat et al.28 | 1 | T4 | + | Nicht beschrieben | + | + | Nicht beschrieben | + | + | RE | Teilweise |
| Moviat et al.28 | 2 | T3 | + | Nicht beschrieben | + | Nicht beschrieben | Nicht beschrieben | + | + | RE | Teilweise |
| Moviat et al.28 | 5 | T1 | + | Nicht beschrieben | + | + | + | + | Nicht beschrieben | RE | Teilweise |
| Salim et al.48 | T1 | + | Nicht beschrieben | + | + | Nicht beschrieben | + | Nicht beschrieben | A | Teilweise | |
| Slaughter et al.29 | 1 | T2 | + | Nicht beschrieben | Nicht beschrieben | + | + | + | Nicht beschrieben | A/R | Teilweise |
| Slaughter et al.29 | 2 | T1 | + | Nicht beschrieben | Nicht beschrieben | Nicht beschrieben | + | N | Nicht beschrieben | A/FA/R | Teilweise |
| Smigelski und Boeve36 | T5 | Nicht beschrieben | Nicht beschrieben | Nicht beschrieben | Nicht beschrieben | + | + | Nicht beschrieben | A | Teilweise | |
| Stewart35 | T1 | + | Nicht beschrieben | + | + | Nicht beschrieben | + | + | A | Teilweise | |
| Youporn 25 | T2 | Nicht beschrieben | + | + | + | + | + | + | N/R | Voll | |
| York und McCarter30 | T1 | + | Nicht beschrieben | Nicht beschrieben | + | Nicht beschrieben | + | Nicht beschrieben | N/R | Teilweise |
Apositiv (+) Symbol zeigt an, dass das Symptom aufgetreten ist. A = Agitation oder Aggression, D = desorientiert, FA= Flat effect, R = Unruhe, RE=Widerspenstigkeit, T1 < 7 Tage nach traumatischer Hirnverletzung (TBI), T2 = 7-31 Tage nach TBI, T3 = 31-365 Tage nach TBI, T4 ≥1 Jahr nach TBI, T5= nicht bestimmbar. Die Symptome von KBS werden wie von Lilly et al.6
bAt Krankenhauseinweisung, sofern nicht anders angegeben.
TABELLE 2. Klüver-Bucy-Syndrom (KBS) Symptome und Merkmalea
Erholung über die Zeit: Alle Fallpersonen (N = 24)
Ansprechen auf die Behandlung und Verbesserung der KBS-Merkmale sind in Tabelle 3 zusammengefasst. Von den Fallberichten, die in dieser Überprüfung enthalten waren, wurde in 22 Fällen die Wiedereinziehung von KBS erwähnt (ein Bericht über die Wiedereinziehung lag für zwei Fallpersonen nicht vor). Bei den 11 Probanden, die eine positive Verbesserung aller KBS-Symptome zeigten, lag die Dauer der KBS zwischen 7 Tagen und 14 Monaten. Bei den Fallpatienten, bei denen eine partielle Symptomverbesserung auftrat (N = 6), lösten sich einige KBS-Symptome vollständig auf, während andere langfristig anhielten. Bei fünf Probanden gab es keine Besserung mit Berichten über eine Verschlechterung des Gesundheitszustands und eine verminderte Funktionsfähigkeit.19,26,28 In einem einzigen Fall wurde eine fortschreitende Verschlechterung der zum Tod führenden Symptome berichtet.26 Es wurde zu wenig berichtet, wann KBS-Patienten über den Zeitraum ihres Krankenhausaufenthalts, während der Rehabilitation und nach der Entlassung aus dem Krankenhaus beurteilt wurden. Bewertungen der Langzeitergebnisse von 12 Monaten oder länger nach TBI wurden in wenigen Fällen aufgezeichnet (N = 5).19,20,25,28
| Studie | Fall | Verbesserung der KBS-Symptome | Dauer der KBS | Ansprechen und Ergebnis der Behandlung |
|---|---|---|---|---|
| Aygun et al.24 | Positiv | 5 Tage | Vollständige Verbesserung | |
| Bhat et al.22 | Positiv | 3 Wochen | Asymptomatisch | |
| Caro und Jimenez7 | Teilweise | Allmähliche Verbesserung von Verhalten und Kognition | ||
| Deginal et al.23 | Teilweise | 30% Verbesserung des Verhaltens und der KBS-Symptome, gemessen 8 Wochen nach TBI | ||
| Fiume und Fiume Garelli26 | Keine Besserung | Gestorben | Fortschreitende Verschlechterung, die zum Tod führt | |
| Góscínski et al.19,20 | 1 | Keine Verbesserung | Laufend | Verminderte intellektuelle Kapazität und Funktionsfähigkeit (7 Jahre) |
| Reizbar, verbal aggressiv, schlechtes Gedächtnis, Apathie und keine Libido (25 Jahre) | ||||
| Góscínski et al.19,20 | 2 | Keine Besserung | Andauernd | Anhaltende psychiatrische Störungen, soziale Fehlanpassung, Aggression und Selbstverletzung |
| Hardy und Aldridge2 | Teilweise | 15 Tage | Verbesserter Appetit, Sprache und keine sexuellen Kommentare 15 Tage nach TBI | |
| Zwangsstörungen und stumpfe Affekte blieben bestehen | ||||
| Hooshmand et al.34 | Positiv | 1 Jahr | Anfälle endeten in 24 Stunden; Hyperoralität verschwand; konzentration verbessert; deutliche Verbesserung des Gedächtnisses | |
| Lingerie31 | Nicht gemeldet | 4-5 Monate | ||
| Kwiatwoski et al.27 | 1 | Positiv | Es gelang, effektiv zum Funktionieren vor dem Unfall zurückzukehren, einschließlich der Arbeit | |
| Kwiatwoski et al.27 | 2 | Teilweise | Anhaltende Symptome der Hyperoralität 4 Jahre nach TBI | |
| Verbesserung der Ernährungsgewohnheiten, emotionale Dumpfheit, Emotionalität, körperliche Gewalt und Wut-Management | ||||
| Lilly et al.6 | Positiv | 1 Monat | ||
| Morcos und Guirgis32 | Nicht gemeldet | |||
| Moviat et al.28 | 1 | Keine Verbesserung | Keine Veränderung nach 6 Jahren Rehabilitation | |
| Moviat et al.28 | 2 | Keine Verbesserung | Keine Veränderung nach 3 Jahren Rehabilitation | |
| Moviat et al.28 | 5 | Teilweise | 2 Jahre | Bilaterale Pyramidenzeichen verbessert |
| Keine Veränderung nach 3 Jahren Rehabilitation | ||||
| Salim et al.48 | Positiv | Ungefähr 7 Tage | Gelöst | |
| Schlachthof29 | 1 | Positiv | 3,5 Monate | Vollständige Auflösung |
| Slaughter et al.29 | 2 | Positiv | 18 Tage | Reduzierte Symptome von Agitation / Lippenkauen; symptome traten nicht wieder auf |
| Smigelski und Boeve36 | Positiv | 8 Monate | Beeindruckende neurobehaviorale und neurokognitive Erholung | |
| Stewart35 | Positiv | <3 monate | Positive Verbesserung (allmähliche Abnahme, keine gewalttätigen Angriffe mehr) | |
| In: Yoneoka et al.25 | Positiv | 14 Monate | Vorübergehende Symptome von KBS; zurück zur High School und dann zum College | |
| York und McCarter30 | Teilweise | Verbesserung des Restgedächtnisses und der Kognition |
TABELLE 3. Ansprechen auf die Behandlung bei Patienten mit Klüver-Bucy-Syndrom (KBS) (N=12) Nach TBI
Pharmakologische Behandlung
Das pharmakologische Management wurde in 50% der Fallberichte dokumentiert (N=12). Die pharmakologische Behandlung mit Carbamazepin war die am häufigsten berichtete Intervention (N= 10). Die Verwendung von Antipsychotika der ersten Generation wurde in drei Fallberichten festgestellt. Selektive Serotonin-Wiederaufnahmehemmer (SSRIs) wurden in drei Fällen verschrieben. Die Verschreibung von zwei oder mehr Medikamenten wurde in vier Fallberichten festgestellt.7,27,29 Einzelheiten des postakuten pharmakologischen Managements sind in Tabelle 4 zusammengefasst. Nur zwei Fallberichte berichteten über die Behandlungsdauer nach 4 Jahren, die übrigen Fallberichte berichteten nicht über die Dauer der medikamentösen Behandlung.
| Studie | Fall | Pharmakotherapie |
|---|---|---|
| Bhat et al.22 | Carbamazepin; no further details provided | |
| sehr Geehrter and Jimenez7 | Valproate changed to topiramate, quetiapine, propranolol, benztropine, and haloperidol | |
| Deginal and Changty23 | Carbamazepin (200 mg b.die.d.) | |
| Góscínski et al.19,20 | 1 | Carbamazepine |
| Góscínski et al.19,20 | 2 | Carbamazepine (400 mg B. I. d.) |
| Hooshmand et al.34 | Chlorpromazin (300 mg / Tag) (abgesetzt) | |
| Carbamazepin (1.000 mg / Tag) (begonnen nach Chlorpromazin) | ||
| Kwiatwoski et al.27 | 1 | Haloperidol |
| Carbamazepin dreimal täglich oral verabreicht (200 mg / pro Tag); Serumspiegel 6 µg / ml | ||
| Kwiatwoski et al.27 | 2 | Carbamazepin dreimal täglich oral verabreicht (200 mg / Tag); 6 µg/ml Serumspiegel |
| Morcos und Guirgis32 | Carbamazepin (400 mg b.i.d.) | |
| Slaughter et al.29 | 1 | Carbamazepin (600 mg / Tag); Propranolol (keine Änderung des Ausgangsverhaltens) |
| Trazodon | ||
| Sertralin (titriert auf 150 mg); ersetzt durch Fluoxetin (40 mg morgens und 20 mg mittags) | ||
| Slaughter et al.29 | 2 | Haloperidol; ersetzt durch Olanzapin |
| Lorazepam, Valproinsäure, Thiothixen und Bromocriptin | ||
| Sertralin (150 mg / pro Tag) | ||
| Stewart 35 | Carbamazepin; Serumspiegel 9-11 µg / ml für 3 Wochen, dann 8-9 ug / ml für 1 Jahr |
TABELLE 4. Pharmakotherapie nach TBI bei Patienten mit Klüver-Bucy-Syndrom (N=12) nach Erstbehandlung im akuten Setting
Behandlung mit Carbamazepin
Die Altersspanne der Patienten, die entweder Carbamazepin oder ein anderes Antikonvulsivum erhielten, betrug 16-39 Jahre. In 10 der 12 Fälle, in denen eine pharmakologische Behandlung beschrieben wurde, wurde Carbamazepin zur Behandlung von Patienten mit vollständigen oder teilweisen Symptomen von KBS angewendet. In diesen Fällen lag die Dosis von Carbamazepin zwischen 400 mg und 1.000 mg pro Tag.19,20,27,29,32,34,35 Die therapeutische Arzneimittelüberwachung zur Anpassung der Carbamazepin-Behandlung wurde nur in drei Fällen beschrieben und zielte darauf ab, Serumspiegel zwischen 6 und 11 µg / ml zu erreichen. In den meisten Fällen wurde Carbamazepin als Monotherapie angewendet, während in zwei Fällen Carbamazepin mit Propranolol bzw. Haloperidol kombiniert wurde, was zur Auflösung aller oder der Mehrheit der Symptome führte.7,27,29 Leider beschrieben nur wenige der Fallberichte Daten zu den Nebenwirkungen von Medikamenten, die beim Symptommanagement verwendet wurden.
Ansprechen auf die pharmakologische Behandlung (12 Fälle)
Die Hälfte der Fallberichte (N=12) in diesem Review beschrieben pharmakologisches Management. Von diesen waren sechs Fälle mit einer positiven Verbesserung der Symptome verbunden, wobei einige von einer vollständigen Auflösung der Symptome und einer Rückkehr zu Aktivitäten vor Verletzungen berichteten. In drei Fällen wurde eine teilweise Besserung berichtet, wobei sich einige KBS-Symptome im Laufe der Zeit besserten und andere anhielten. In den beiden definitiven TBI-Fällen, die von Góscínski et al.19,20, die eine lange Nachbeobachtungszeit von 3 bzw. 25 Jahren hatten, hielten anhaltende psychiatrische Symptome mit verminderter Funktionsfähigkeit an. In 50% der Fälle, in denen über die Verabreichung von Carbamazepin berichtet wurde, wurde eine positive Verbesserung der KBS-Symptome festgestellt. In zwei Fällen wurde eine Kombination von Arzneimitteln verwendet, die kein Carbamazepin, sondern Sertralin, Thiothixen, Bromocriptin, Topiramat, Haloperidol, Propranolol und Quetiapin enthielten.7,29 In beiden Fallberichten wurde eine allmähliche Verbesserung der Symptome festgestellt, die sich speziell auf die Erregung bezogen.
Methodische Qualität
Die methodische Qualität jedes Fallberichts wurde gemäß der Vorlage des Joanna Briggs Institute Critical Appraisal for case Reports untersucht. Die Fragen, die der kritischen Beurteilung zugrunde liegen, sind in der Online-Beilage enthalten. Insgesamt gab es klare Berichte über die demografischen Merkmale des Patienten (Frage 1), den aktuellen klinischen Zustand (Frage 3) und diagnostische Tests oder Bewertungsmethoden (Frage 4). Nur 13 Fallberichte (54.1%) beschrieben die Anamnese des Patienten in einer Zeitleiste klar, indem sie Informationen zur Krankengeschichte und zur relevanten Familienanamnese lieferten (Frage 2), und nur sieben Fallberichte lieferten Informationen zu Schäden und unerwarteten Folgen (Frage 7). Die kritischen Beurteilungsergebnisse für die eingeschlossenen KBS-Fälle sind in Tabelle 5 dargestellt.
| Studie | Fall | Q1 | Q2 | Q3 | Q4 | Q5 | Q6 | Q7 | Q8 |
|---|---|---|---|---|---|---|---|---|---|
| Aygun et al.24 | Y | Y | Y | Y | Y | N / A | N | Y | |
| Bhat et al.t22 | Und | Und | Und | Und | Und | Und | N | Und | |
| Teuer und Jimenez7 | Und | Und | Und | Und | Und | Und | Und | Und | |
| Deginal und Changty23 | Und | Und | Und | Und | Und | Und | N | Und | |
| Fiume und Fiume Garelli26 | Und | N | Und | Und | N | N | N | N | |
| Góscínski et al.19,20 | 1 | Y | N | Y | Y | N | N | N | Y |
| Góscínski et al.19,20 | 2 | Y | N | Y | Y | N | N | N | Y |
| Hardy und Aldridge2 | Y | N | Y | Y | N | Y | N | N | |
| Hooshmand et al.34 | Und | Und | Und | Und | Und | Und | Und | Und | |
| Lingerie31 | Und | Und | Und | Und | Und | Und | N | N | |
| Kwiatwoski et al.27 | 1 | Y | Y | Y | Y | Y | Y | N | Y |
| Kwiatwoski et al.27 | 2 | Y | Y | Y | Y | Y | Y | N | Y |
| Lilly et al.6 | Und | N | Und | Und | Und | Und | N | Und | |
| Morcos und Guirgis32 | Und | Und | Und | Und | Und | Und | N | Und | |
| Moviat et al.28 | 1 | Y | N | Y | Y | N | N | Y | Y |
| Moviat et al.28 | 2 | Y | N | Y | Y | N | N | Y | Y |
| Moviat et al.28 | 5 | Y | N | Y | Y | N | N | Y | Y |
| Salim et al.48 | Y | N | Y | Y | N/A | N | N | Y | |
| Slaughter et al.29 | 1 | Y | Y | Y | Y | Y | Y | Y | Y |
| Slaughter et al.29 | 2 | Und | N | Und | Und | Und | Und | Und | Und |
| Smigelski und Boeve36 | Und | N | Und | Und | N | Und | N | N | |
| Stewart35 | Und | Und | Und | Und | Und | Und | N | Und | |
| In: Yoneoka et al.25 | Y | Y | Y | Y | Y | Y | N | Y | |
| York und McCarter30 | Y | Y | Y | Y | N | N | N | Y |
aN=erfüllt die Kriterien nicht, N/A=nicht zutreffend, Q=Frage, Y=erfüllt die Kriterien.
TABELLE 5. Kritische Bewertung von Fallberichten zum Klüver-Bucy-Syndrom nach TBI (KBS) gemäß der Bewertungscheckliste des Joanna Briggs Institute für Fallseriena
Diskussion
Nach unserem besten Wissen ist dies die erste systematische Überprüfung, um die Evidenz für KBS sekundär zu TBI aus Fallberichten zu identifizieren und zu synthetisieren. Mit Hilfe einer definierten Suchstrategie, die auf vier bibliografische Bibliotheksdatenbanken angewendet wurde, identifizierten wir 24 Fallberichte, die die Einschlusskriterien erfüllten und den Schwerpunkt dieser Überprüfung bilden. Ungeachtet der methodischen Einschränkungen, die mit Fallberichten verbunden sind, bietet die Verwendung von Fallberichten angesichts der Seltenheit von KBS und des Mangels an Studien mit qualitativ hochwertigeren Methoden Möglichkeiten, KBS nach TBI besser zu verstehen.
In der aktuellen Überprüfung waren Hypersexualität, Hyperoralität und aggressives Verhalten die häufigsten Symptome von KBS. Visuelle Agnosie war das am wenigsten verbreitete Symptom. Gerstenbrand et al.37 fassten ihre Erfahrungen mit posttraumatischen Fällen von KBS zusammen und berichteten über klinische Daten zu 40 Fallpersonen, die zwischen 1978 und 1981 diagnostiziert wurden. Obwohl keine Einzelfalldaten vorgelegt wurden, wurde über die Häufigkeit von KBS-Symptomen berichtet. Symptome von Bulimie, Gedächtnisstörungen, Hyperoralität und visueller Agnosie traten in 30 Fällen auf. Hypersexualität trat in 18 Fällen und Aggressivität in 11 Fällen auf. Persistenz der Hypersexualität nach 1 Jahr wurde in 12 Fällen, Bulimie in acht Fällen und Aggressivität in 10 Fällen festgestellt. Obwohl die Quellen der Fälle nicht beschrieben werden, waren die meisten männlich (77,5%), und die Altersspanne zeigt an, dass die Kohorte jünger war, da Kinder eingeschlossen waren (im Alter von 7 bis 33 Jahren ). Die Unterschiede können die heterogene Natur von TBI widerspiegeln. Es ist unklar, ob die Patienten in der Studie von Gerstenbrand et al.37 hatten TBI oder andere erworbene Hirnverletzungen. Sechs Fallpersonen starben innerhalb von 10 Wochen nach ihrem Unfall, und daher ist es möglich, dass die in der aktuellen Überprüfung beschriebenen Fälle weniger schwerwiegend waren.
Obwohl die natürliche Vorgeschichte von KBS nach TBI nicht bekannt ist,23 erscheint es bei einigen Patienten als chronischer, anhaltender Zustand und bei anderen als vorübergehender, auflösender Zustand.6 Der in der aktuellen Übersicht beschriebenen Fallberichte zeigten in der Mehrzahl der Fälle eine teilweise oder vollständige Genesung. In den meisten Fällen lag der KBS-Verlauf zwischen 5 Tagen und 1 Jahr. In anderen Fällen (N = 8) dauerte das Syndrom 1-25 Jahre nach Beginn an, je nachdem, wann der Patient untersucht wurde. Obwohl nicht ausgeschlossen werden kann, dass dies einen Publikationsbias mit positivem Ergebnis widerspiegelt, stimmt das Ausmaß der Erholung mit der Studie von Formisano et al. überein.,38 who untersuchte das globale Ergebnis von 19 Patienten mit KBS infolge einer schweren Hirnverletzung nach einem Verkehrsunfall. In Formisano et al.der Studie wurden Fälle als KBS gezählt, wenn sie zwei der KBS-Symptome hatten.38 Dies steht im Widerspruch zur Definition von partiellem KBS, die drei Symptome erfordert.6 Obwohl keine Einzelfalldaten vorgelegt wurden, erlangten von den 19 eingeschlossenen KBS-Patienten vier keine Unabhängigkeit zurück, sechs erreichten eine Familienintegration und neun erreichten eine Arbeitsintegration. In Übereinstimmung mit Formisano et al.’s38 Befunde, Läsionen in den Temporallappen waren in den Fallberichten, die in der aktuellen Synthese enthalten waren, häufig.
Die Art und der anatomische Ort der Läsionen, die zur Erzeugung von humanem KBS nach TBI erforderlich sind, wurden nicht endgültig bestimmt, teilweise aufgrund der Grenzen der derzeitigen routinemäßigen Strukturbildgebung. Die Forscher haben eine Reihe von Hypothesen vorgeschlagen. Góscínski et al.19,20 schlug eine bilaterale Verletzung des mediobasalen Temporallappens als Folge von Schwellung oder Ödem des Gehirns und Kompression der Arterien vor. In: Yoneoka et al.25 stellten die Hypothese auf, dass die KBS-Symptomatik eine ödeminduzierte vorübergehende Dysfunktion des rechten temporalen und basalen Frontallappens widerspiegeln kann. Slaughter et al.29 vorgeschlagene Kombinationen von posterioren Frontal- und anterioren Temporallappendefekten sowie Deginal- und Pty23 postulierten Störungen der Bahnen, die den dorsomedialen Thalmus mit präfrontalen Kortizes und anderen limbischen Bereichen verbinden. Es ist bemerkenswert, dass das Ausmaß der neurologischen Defizite nicht mit dem Ausmaß der Persönlichkeitsstörungen korrelierte.27 In jüngerer Zeit schlugen Caro und Jimenez7 vor, dass KBS aus mesiotemporalen Läsionen oder anderen Veränderungen (möglicherweise vorübergehend) resultiert, die unabhängig von der Ätiologie zu einer Hypofunktion der Amygdala oder ihrer Projektionen führen. Im Fall von vorübergehendem KBS schlugen sie vor, dass das Verschwinden der KBS-Symptome einer Verbesserung der lokalisierten neuronalen Dysfunktion folgt.
Ein sekundäres Ziel der aktuellen Überprüfung war es, die einzelnen Fallberichte zu vergleichen und zu kontrastieren, die das pharmakologische Management von KBS-bedingten Symptomen beschrieben. Die französischen SOFMER-Richtlinien für Arzneimittel gegen Verhaltensstörungen nach TBI berichteten über Beweise der Stufe 4 Grad C für die Verwendung von Carbamazepin.18 Dies beruhte auf einer Einzelfallserie von vier Patienten, die mit Carbamazepin behandelt wurden.19,20 Es wurden keine Daten zur Behandlungsdauer oder zum Zeitpunkt des Behandlungsbeginns vorgelegt. Die Dosis von Carbamazepin wurde für Fall 1 nicht berichtet.
Die Autoren berichteten, dass die Patienten eine Verbesserung zeigten, gemessen an der Glasgow Outcome Scale (GOS), bei Entlassung aus dem Krankenhaus, 3 Monate und 6 Monate nach dem Trauma, wenn Carbamazepin während des Krankenhausaufenthalts und nach der Entlassung gegeben wurde.19,20 Fall 2 zeigte keine Änderung des GOS-Scores. Die Art der Verbesserung wurde nicht beschrieben. Angesichts der Komplexität des Syndroms, der Tatsache, dass nur zwei Fälle definitiv als TBI angesehen werden können, des Mangels an pharmakologischen Informationen und der fehlenden Berichterstattung darüber, welche Symptome sich verbessert haben, sollten Leitlinienempfehlungen, die auf diesem Artikel basieren, bestenfalls vorsichtig sein.
Zehn Fallberichte, in denen die Behandlung mit Carbamazepin beschrieben wurde, wurden in diese Übersicht aufgenommen und liefern einige zusätzliche Beweise für die Verwendung von Carbamazepin in Bezug auf KBS. Eine Verbesserung der Symptome wurde innerhalb von 3 Wochen nach Beginn der Behandlung mit Carbamazepin beobachtet22, und in einem Fall wurde eine vollständige Auflösung der Symptome berichtet,34 Es wurde jedoch kein Zeitrahmen angegeben. Andere Fälle berichteten über allgemeine Verbesserungen der Symptome bei Patienten, die Carbamazepin einnahmen, aber auch hier wurde kein Zeitrahmen erwähnt, in dem Verbesserungen auftraten.23,27,34,35
Carbamazepin ist ein Carboxamid-Derivat-Antiepileptikum mit einer chemischen Struktur ähnlich wie trizyklische Antidepressiva und wird bei der Behandlung von Anfallsleiden, neuropathischen Schmerzen und psychiatrischen Störungen eingesetzt.39 Die Wirksamkeit von Carbamazepin als Antikonvulsivum wurde bei Patienten mit Temporallappenepilepsie nachgewiesen40 mit zusätzlichen Symptomen, die KBS ähneln, was einer der Gründe für seine Anwendung sein könnte. Darüber hinaus wurden sowohl eine vollständige als auch eine teilweise Remission der Symptome nach einer Carbamazepin-Behandlung bei KBS festgestellt, die mit einer Reihe anderer Ursachen als TBI assoziiert sind. Leider berichteten die Fallberichte in der aktuellen Studie nicht im Detail, welche der diagnostischen KBS-Symptome sich verbesserten. Verbesserungen der Verhaltens-, Hyperoral- und kognitiven Symptome wurden dokumentiert.
Von den 24 in diesem systematischen Review beschriebenen Fällen wurden 10 mit Carbamazepin behandelt. Insgesamt deuten die Fälle darauf hin, dass Carbamazepin eine wirksame Behandlung für bestimmte Symptome von KBS sein kann. Von den mit Carbamazepin behandelten Fällen wurde bei drei Patienten ein Carbamazepin-Talspiegel im Serum von > 6 µL / ml berichtet (optimaler therapeutischer Bereich: 4-12 µL / ml). Aufgrund seiner potenziell schweren toxischen Wirkungen (z. B. Ataxie, Krampfanfälle, dystonische Reaktion und sogar Koma) ist es wichtig, eine Überdosierung von Carbamazepin zu vermeiden.39 Obwohl ein Serum-Talspiegel von 6 µL / ml immer noch im empfohlenen Bereich liegt, ist die fehlende Wirkung mit Carbamazepin in Slaughter et al.’s29 Fall 1 kann mit einem subtherapeutischen Talspiegel assoziiert sein.
Das Antipsychotikum Chlorpromazin zeigt in der Regel eine hohe sedierende Wirkung und ein erhöhtes Potenzial für extrapyramidale Symptome. In dem von Hooshmand vorgestellten Fall könnte 41 Chlorpromazin zur Behandlung psychotischer Symptome verabreicht worden sein, und die Behandlung hätte dann zur langfristigen Behandlung von Anfällen auf Carbamazepin umgestellt werden können.34 In Bezug auf die Wirksamkeit scheint die frühzeitige Einführung von Carbamazepin wichtig zu sein, wie von Góscínski et al.19,20
Die Verschreibung mehrerer Medikamente wurde in vier Fällen beschrieben. In Slaughter et al.’s29 Fall 2, sowohl Lorazepam als auch Valproinsäure wurden verschrieben. Lorazepam wird normalerweise wegen seiner anxiolytischen Wirkungen verschrieben, und seine berichtete pharmakokinetische Wechselwirkung mit Valproinsäure kann zu weiteren verstärkten sedativen Wirkungen führen.42 In Slaughter et al.’s29 Fall 1, der Patient erhielt mehrere Antidepressiva, einschließlich Sertralin und Trazodon. Sertralin wurde später durch Fluoxetin ersetzt; Beide Medikamente sind SSRIs. Einige KBS-Symptome weisen Merkmale einer Zwangsstörung (OCD) auf, und es wurde gezeigt, dass Sertralin in höheren Dosen bei OCD wirksam ist.43 Sertralin und Fluoxetin werden jedoch beide über übliche Cytochrom-P450-Stoffwechselwege, einschließlich CYP2D6, metabolisiert, und pharmakokinetische Wechselwirkungen sind im vorliegenden Fall angesichts der schnellen Abfolge zu erwarten.44 Das Antidepressivum Trazodon, ein potenter Serotonin- und α1-adrenerger Rezeptorantagonist und schwacher Serotonin-Wiederaufnahmehemmer, wurde zusammen mit Carbamazepin verabreicht.45 Da Carbamazepin ein bekannter Induktor von CYP3A4 ist, könnten mögliche Wechselwirkungen klinisch relevant sein und die Symptomremission verschlimmern.46,47
Es ist wichtig anzuerkennen, dass diese systematische Überprüfung Einschränkungen unterliegt, die ein Merkmal von Fallberichten sind. Da es sich bei den Fallberichten um retrospektive Beobachtungsstudien handelt, können keine kausalen Schlussfolgerungen gezogen werden. Es besteht die Gefahr einer Verzerrung des positiven Ergebnisses, und man könnte Merkmale des Falles aufgrund der unterschiedlichen Betonung der Fälle durch die Autoren überinterpretieren. Für die aktuelle Überprüfung fehlten für einige der gesammelten Attribute Daten. Eine unzureichende Berichterstattung darüber, wann KBS-Patienten während ihres Krankenhausaufenthalts, während der Rehabilitation und nach der Entlassung aus dem Krankenhaus beurteilt wurden, schränkt die Interpretation der Dauer der KBS-Symptome ein.
Da es sich um ein natürliches Experiment handelt, kann der Fall nicht wiederholt werden, und die Versorgung von Patienten mit KBS hat sich im Laufe der Jahre möglicherweise geändert. Da Peer-Review-Artikel zu KBS nicht sehr verbreitet sind, enthielt die Suchstrategie keine große Auswahl an Begriffen, und es ist möglich, dass relevante Fälle übersehen wurden. Wir halten die Wahrscheinlichkeit dafür angesichts der Anzahl der durchsuchten Datenbanken, der Anzahl der konsultierten Referenzlisten und der Suche von Google Scholar für gering.
Ungeachtet dieser Einschränkungen umfassen die Stärken der Überprüfung die systematische Identifizierung von Fällen durch eine spezifizierte Suchstrategie und eine kritische Bewertung der Qualität der Berichte. Darüber hinaus wurden keine Datums- oder Sprachbeschränkungen angewendet, und wir konnten drei Studien übersetzen lassen. Die Überprüfung umfasst 24 Fälle von KBS nach TBI, von denen die Hälfte mit Pharmakotherapie behandelt wurde. Diese Überprüfung wird Klinikern helfen, das klinische Spektrum von KBS nach TBI zu verstehen, und kann Leitlinien für die Personalisierung von Behandlungen in der klinischen Praxis bieten.
Schlussfolgerungen
Diese systematische Überprüfung hat die Beweise aus 24 Fallberichten von KBS nach TBI identifiziert und synthetisiert. Die Fallberichte zeigen die komplexe Darstellung von KBS-Symptomen nach TBI. Die Behandlung mit Carbamazepin war in sieben von 10 Fällen mit einer Verbesserung der KBS-Symptome verbunden. Aufgrund der Qualität der Evidenz ist es jedoch nicht möglich, eine Praxisempfehlung in der in Entwicklung befindlichen klinischen Richtlinie mit Gewissheit abzugeben. Ob diese Intervention für einen Patienten getestet wird, hängt von der individuellen klinischen Präsentation, dem mangelnden Ansprechen auf andere Behandlungen und der klinischen Indikation ab.
Professor Hopwood war Berater und erhielt Forschungsstipendien von Bionomics, Eli Lilly, Lundbeck, Novartis und Servier. Alle anderen Autoren berichten keine finanziellen Beziehungen mit kommerziellen Interessen.
Unterstützt vom Institut für Sicherheits-, Kompensations- und Genesungsforschung und der Monash University (durch die Neurotrauma-Strategie, 2010-2015).
Die Autoren danken ihrem Informationsspezialisten Farhad Shokraneh. Die Autoren danken auch Elena Pozzi für die sprachliche Übersetzung.
1 Kluver H, Bucy P: Vorläufige Analyse der Funktionen der Temporallappen bei Affen. Arch Neurol Psychiatry 1939; 42: 979-1000Crossref, Google Scholar
2 Hardy TL, Aldridge J: Traumatisches transientes Klüver-Bucy-Syndrom. Surg Neurol 1981; 15:338-340Crossref, Medline, Google Scholar
3 Lanska DJ: Das Klüver-Bucy-Syndrom. Vorderseite Neurol Neurosci 2018; 41:77–89Crossref, Medline, Google Scholar
4 Trimble MR, Mendez MF, Cummings JL: Neuropsychiatrische Symptome aus den temporolimbischen Lappen. J Neuropsychiatry Clin Neurosci 1997; 9:429-438Link, Google Scholar
5 Shraberg D, Weisberg L: Das Klüver-Bucy-Syndrom beim Menschen. J Nerv Ment Dis 1978; 166: 130-134Crossref, Medline, Google Scholar
6 Lilly R, Cummings JL, Benson DF, et al.: Das menschliche Klüver-Bucy-Syndrom. Neurologie 1983; 33: 1141-1145Crossref, Medline, Google Scholar
7 Caro MA, Jimenez XF: Mesiotemporale Trennung und Hypoaktivität beim Kluver-Bucy-Syndrom: Fallreihen und Literaturübersicht. J Clin Psychiatrie 2016; 77:e982-e988Crossref, Medline, Google Scholar
8 Begum H, Nayek K, Khuntdar BK: Kluver-Bucy-Syndrom – eine seltene Komplikation der Herpes-simplex-Enzephalitis. J. Med Assoc 2006; 104:637-638Medline, Google Scholar
9 Janati A: Kluver-Bucy-Syndrom bei Chorea Huntington. J Nerv Ment Dis 1985; 173: 632-635Crossref, Medline, Google Scholar
10 Kile SJ, Ellis WG, Olichney JM, et al.: Alzheimer-Anomalien der Amygdala mit Klüver-Bucy-Syndrom Symptome: eine Amygdaloid-Variante der Alzheimer-Krankheit. Arch Neurol 2009; 66:125–129Crossref, Medline, Google Scholar
11 Powers JM, Schaumburg HH, Gaffney CL: Klüver-Bucy-Syndrom durch Adreno-Leukodystrophie. Neurologie 1980; 30: 1231–1232Crossref, Medline, Google Scholar
12 Pitt DC, Kriel RL, Wagner NC, et al. Kluver-Bucy-Syndrom nach Hitzschlag bei einem 12-jährigen Mädchen. Pediatr Neurol 1995; 13: 73–76Crossref, Medline, Google Scholar
13 Jha KK, Singh SK, Kumar P, et al.: Partielles Kluver-Bucy-Syndrom nach tuberkulöser Meningitis. BMJ Fall Rep 2016; 2016:16Google Scholar
14 De Azevedo JPRPT, Vasques GL, Rocha CD, et al. Kluver-Bucy syndrome in a multiple sclerosis patient. J Neurological Sciences. 2013;1:e377–e378Crossref, Google Scholar
15 Devinsky O, Bear D: Klüver-Bucy syndrome in Pick’s disease. Neurology 1983; 33:957–959Crossref, Medline, Google Scholar
16 Varon D, Pritchard PB 3rd, Wagner MT, et al.: Transient Kluver-Bucy syndrome following complex partial status epilepticus. Epilepsy Behav 2003; 4:348–351Crossref, Medline, Google Scholar
17 Ozawa H, Sasaki M, Sugai K, et al.: Einzelphotonenemissions-CT- und MR-Befunde beim Klüver-Bucy-Syndrom nach dem Reye-Syndrom. AJNR Am J Neuroradiol 1997; 18: 540-542Medline, Google Scholar
18 Plantier D, Luauté J; Medikamente gegen Verhaltensstörungen nach traumatischer Hirnverletzung: Ssystematische Überprüfung und Expertenkonsens, die zu französischen Empfehlungen für eine gute Praxis führen. Ann Phys Rehabil Med 2016; 59:42-57Crossref, Medline, Google Scholar
19 Góscínski I, Kwiatkowski S, Polak J, et al. Das Kluver-Bucy-Syndrom. J Neurochirurgie Sci 1997; 41:269–272Medline, Google Scholar
20 Gościński I, Kwiatkowski S, Polak J, et al. Das Kluver-Bucy-Syndrom. Acta Neurochir (Wien) 1997; 139:303–306Crossref, Medline, Google Scholar
21 Lippe S, Gonin-Flambois C, Jambaqué I: Die Neuropsychologie des Klüver-Bucy-Syndroms bei Kindern. Handb Clin Neurol 2013; 112: 1285-1288Crossref, Medline, Google Scholar
22 Bhat PS, Pardal PK, Das RC: Partielles Kluver-Bucy-Syndrom als verzögerte Manifestation einer Kopfverletzung. Ind Psychiatrie J 2009; 18:117–118Crossref, Medline, Google Scholar
23 Deginal A, Changty S: Post traumatic Kluver-Bucy syndrome: a case report. Ind J Neurotrauma. 2011; 8:41–42Crossref, Google Scholar
24 Aygun D, Guven H, Altintop L, et al.: Postcontusional Kluver-Bucy syndrome. Am J Emerg Med 2003; 21:246–247Crossref, Medline, Google Scholar
25 Yoneoka Y, Takeda N, Inoue A, et al.: Human Kluver-Bucy syndrome following acute subdural haematoma. Acta Neurochir (Wien) 2004; 146:1267–1270Crossref, Medline, Google Scholar
26 Fiume S, Fiume Garelli F: A case of Kluver Bucy syndrome probably caused by traumatic bitemporal injury. G Psichiatr Neuropatol 1968; 96:122–130Google Scholar
27 Kwiatkowski S, Starowicz A, Milczarek O, et al.: Neuropsychological characteristic of post-traumatic Kluver-Bucy syndrome. Arch Psychiatry Psychother 2011; 13:59–65Google Scholar
28 Moviat MAM, Janssen CLW, Jaeken D, et al.: Kluver-Bucy syndrome in brain injured children; neurological, neuroradiological, behavioural and neuropsychological findings. J Rehabil Sciences. 1995; 8:106–109Google Scholar
29 Slaughter J, Bobo W, Childers MK: Selektive Serotonin-Wiederaufnahmehemmer-Behandlung des posttraumatischen Klüver-Bucy-Syndroms. Gehirn, 1999; 13: 59–62Crossref, Medline, Google Scholar
30 York HS, McCarter R: Kluver-Bucy-Syndrom nach Gesichtsschusswunde: ein Fallbericht. PM R 2017; 9 (Beilage 1): S231Crossref, Medline, Google Scholar
31 Isern RD Jr: Gewalt in der Familie und das Klüver-Bucy-Syndrom. Süd Med J 1987; 80:373-377Crossref, Medline, Google Scholar
32 Morcos N, Guirgis H: Ein Fall von akut einsetzendem partiellem Kluver-Bucy-Syndrom bei einem Patienten mit einer traumatischen Hirnverletzung in der Vorgeschichte. J Neuropsychiatry Clin Neurosci 2014; 26: E10-E11Link, Google Scholar
33 Ak F, Yalcin Cakmakli G, Karakoc M, et al. Jenseits des Kluver-Bucy-Syndroms: buntes Krankheitsbild des bilateralen Infarkts der vorderen Hirnarterie. J Neurologische Wissenschaften 2013; 1: e648Crossref, Google Scholar
34 Hooshmand H, Sepdham T, Vries JK: Klüver-Bucy-Syndrom. Erfolgreiche Behandlung mit Carbamazepin. JAMA 1974; 229:1782Crossref, Medline, Google Scholar
35 Stewart JT: Carbamazepine treatment of a patient with Klüver-Bucy syndrome. J Clin Psychiatry 1985; 46:496–497Medline, Google Scholar
36 Smigielski JS, Boeve BF: Kluver-Bucy syndrome in traumatic brain injury: a case study. Arch Clin Neuropsychol 1997; 4:406Crossref, Google Scholar
37 Gerstenbrand F, Poewe W, Aichner F, et al.: Klüver-Bucy syndrome in man: experiences with posttraumatic cases. Neurosci Biobehav Rev 1983; 7:413–417Crossref, Medline, Google Scholar
38 Formisano R, Saltuari L, Gerstenbrand F: Vorhandensein des Klùver-Bucy-Syndroms als positives prognostisches Merkmal für die Remission traumatischer längerer Bewusstseinsstörungen. Acta Neurol Scand 1995; 91: 54-57Crossref, Medline, Google Scholar
39 Patsalos PN, Berry DJ, Bourgeois BF, et al. Antiepileptika – best practice guidelines for therapeutic drug monitoring: ein Positionspapier der Subcommission on Therapeutic Drug Monitoring, ILAE Commission on Therapeutic Strategies. Epilepsie 2008; 49:1239-1276Crossref, Medline, Google Scholar
40 Goldenberg Mm. Überblick über Medikamente gegen Epilepsie und Krampfanfälle: Ätiologie, Diagnose und Behandlung. P T 2010; 35 (7): 392-415Medline, Google Scholar
41 Münch J, Hamer AM: Nebenwirkungen von Antipsychotika. Am Fam Arzt 2010; 81: 617-622Medline, Google Scholar
42 Anderson GD, Gidal BE, Kantor ED, et al.: Lorazepam-Valproat-Wechselwirkung: Studien an normalen Probanden und isolierter perfundierter Rattenleber. Epilepsia 1994; 35: 221-225Crossref, Medline, Google Scholar
43 Ninan PT, Koran LM, Kiew A, et al.: Hochdosis-Sertralin-Strategie für Nonresponder zur akuten Behandlung von Zwangsstörungen: eine multizentrische Doppelblindstudie. J Clin Psychiatry 2006; 67: 15-22Crossref, Medline, Google Scholar
44 Spina E, Santoro V, D’Arrigo C: Klinisch relevante pharmakokinetische Wechselwirkungen mit Antidepressiva der zweiten Generation: ein Update. Clin Ther 2008; 30: 1206-1227Crossref, Medline, Google Scholar
45 Stahl SM: Wirkmechanismus von Trazodon: ein multifunktionales Medikament. CNS Spectr 2009; 14:536–546Crossref, Medline, Google Scholar
46 Sánchez-Romero A, Mayordomo-Aranda A, García-Delgado R, et al.: Wahrscheinliche Wechselwirkung zwischen Trazodon und Carbamazepin. Pharmacopsychiatry 2011; 44: 158-159Crossref, Medline, Google Scholar
47 Hachad H, Ragueneau-Majlessi I, Levy RH: Ein nützliches Werkzeug für die Bewertung von Arzneimittelwechselwirkungen: die Metabolismus- und Transport-Arzneimittelwechselwirkungsdatenbank der University of Washington. Hum Genomics 2010; 5: 61-72Crossref, Medline, Google Scholar
48 Salim A, Kim KA, Kimbrell BJ, et al.: Klüver-Bucy-Syndrom als Folge eines leichten Kopftraumas. Süd Med J 2002; 95: 929-931Crossref, Medline, Google Scholar