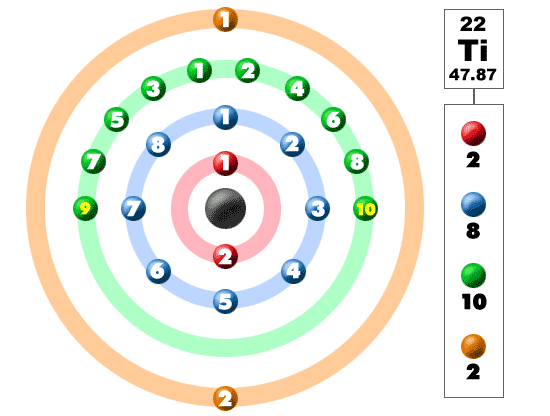
elektroner i skallerne
![]()
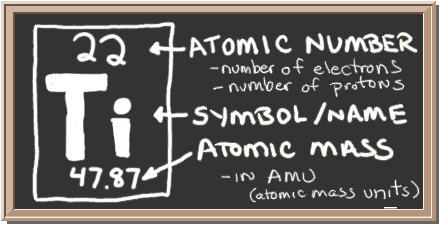
Tjek tavlen. Denne boks til venstre har alle de oplysninger, du har brug for at vide om et element. Det fortæller dig massen af et atom, hvor mange stykker der er inde, og hvor det skal placeres på det periodiske bord.
nu arbejder vi med den fjerde periode/række i tabellen over elementer. Du kan have en nem måde at kende antallet af elektroner i et neutralt atom, men placeringen af disse elektroner bliver lidt mere kompleks. Lad os se på arrangementerne af elektroner i de grundlæggende elementer (venstre og højre side af bordet) i periode fire og de mere komplekse arrangementer af overgangselementerne (i midten af rækken). Hvis du synes, det er lidt over dit hoved, skal du gå tilbage og se på elementerne 1-18, der har organisationer, der er lidt mere enkle.
Tag et kig på billedet nedenfor. Hver af disse farvede bolde er en elektron. I et atom drejer elektronerne rundt om midten, også kaldet kernen. Elektronerne kan lide at være i separate skaller/orbitaler. Når du lærer mere om atomstruktur, lærer du, at elektronerne ikke forbliver i definerede områder omkring kernen. De findes i skyer, der kan have forskellige former, der inkluderer kugler og håndvægtlignende former. Så husk, når du ser på vores sammenbrud, at elektronerne ikke altid er i en god pæn rækkefølge som vist her.
dette element er et af overgangselementerne, der ikke placerer de ekstra elektroner i den ydre skal, men i den nedenunder. I den fjerde periode / række bygger alle disse elektroner den tredje skal til maksimalt 18 elektroner. Husk, at de første otte blev placeret under vores tur gennem den tredje periode/række. Den fjerde række i det periodiske system har overgangsmetaller, der spænder fra scandium (21) til sinc (30).
Titanium er et metal. Det er ikke bare noget metal, det er et overgangsmetal. At være et overgangsmetal har det en særlig elektronkonfiguration. Det tilføjer sin næste elektron til den tredje skal, ikke den yderste fjerde skal. Med en konfiguration på 2-8-10-2 er titanium ude i verden og klar til at binde med andre elementer. Det gør mange naturlige forbindelser med halogener og ilt. Da titanium er derude med fire ekstra elektroner, er det ret fleksibelt og danner mange forbindelser.