16.10: Adición Electrofílica: 1,2-Versus 1,4-Adición
Las reacciones de adición de dienos aislados proceden más o menos como se espera del comportamiento de alquenos simples. Así, si se trata un equivalente molar de 1,5-hexadieno con un equivalente de bromo, se obtiene una mezcla de 5,6-dibromo-1-hexeno, 1,2,5,6-tetrabromohexano y dieno no reaccionado, siendo el compuesto dibromo el producto principal (aproximadamente el 50%)
higo
Reacciones similares de dienos conjugados, por otro lado, a menudo dan productos inesperados. La adición de bromo al 1,3-butadieno es un ejemplo. Como se muestra a continuación, se obtiene una mezcla de aproximadamente 50:50 de 3,4-dibromo-1-buteno (el producto esperado) y 1,4-dibromo-2-buteno (principalmente el isómero E). Este último compuesto es notable en que el doble enlace restante se encuentra en un lugar donde no había doble enlace en el reactivo. Esta interesante reubicación requiere una explicación.
CH2 = CH-CH = CH2 + Br2  |
BrCH2CHBr-CH = CH2 + | BrCH2CH = CHCH2Br |
| 3,4-dibromo-1-buteno | 1,4-dibromo-2-buteno |
El producto de adición esperado de reacciones de este tipo es el resultado de la adición de 1,2, es decir, la unión a los carbonos adyacentes de una doble unión. El producto inesperado proviene de la adición de 1,4, es decir, la unión en los átomos de carbono terminales de un dieno conjugado con un desplazamiento del doble enlace restante a la ubicación de 2,3. (Estos números se refieren a los cuatro carbonos del dieno conjugado y no son números de nomenclatura IUPAC.) Las composiciones de los productos suelen depender de la temperatura: a 40 oC, el 85% de la mezcla de productos en la reacción de adición anterior es el producto de 1,4, mientras que a 0 oC, solo alrededor del 30% es el producto de 1,4.
La unión de un átomo o grupo electrofílico a uno de los átomos de carbono finales de un dieno conjugado ( carbono #1 en la figura siguiente) genera un intermedio de catión alílico. Tales cationes se estabilizan por deslocalización de carga, y es esta deslocalización la que explica el producto de 1,4 adiciones producido en tales reacciones de adición. Como se muestra en el diagrama, la carga positiva se distribuye sobre los carbonos #2 y #4, por lo que es en estos sitios donde se une el componente nucleofílico. Tenga en cuenta que la estabilización por resonancia del catión alílico es mayor que la estabilización comparable de 1,3-butadieno, porque la carga se deslocaliza en el primero, pero se crea y separa en el segundo.
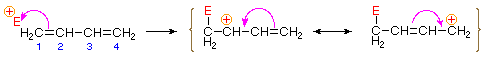
Una explicación de la influencia de la temperatura se muestra en el siguiente diagrama de energía para la adición de HBr al 1,3-butadieno. El paso inicial en el que un protón se une al carbono #1 es el paso determinante de la velocidad, como lo indica la gran energía de activación (flecha gris claro). El segundo paso más rápido es el paso determinante del producto, y hay dos rutas de reacción (color azul para la adición de 1,2 y magenta para la adición de 1,4). La adición de 1,2 tiene una energía de activación menor que la adición de 1,4-ocurre más rápido que la adición de 1,4, porque el nucleófilo de bromuro está más cerca del carbono #2 que del carbono #4. Sin embargo, el producto de 1,4 es más estable que el producto de 1,2. A bajas temperaturas, los productos se forman irreversiblemente y reflejan las tasas relativas de las dos reacciones competidoras. Esto se denomina control cinético. A temperaturas más altas, se establece un equilibrio entre los productos, y domina el producto 1,4 favorecido termodinámicamente.
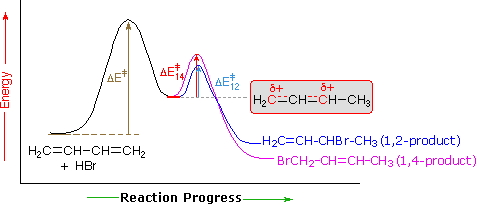
Cuando un dieno conjugado es atacada por un electrófilo, los productos resultantes son una mezcla de 1,2 y 1,4 isómeros. La cinética y la termodinámica controlan una reacción cuando hay dos productos en condiciones de reacción diferentes. El producto cinético (Producto A) se formará rápidamente, y el producto termodinámico (Producto B) se formará más lentamente. Por lo general, el primer producto formado es el producto favorito más estable, pero en este caso, el producto más lento formado es el producto más estable; Producto B.
Introducción
Al igual que los dienos no conjugados, los dienos conjugados están sujetos al ataque de los electrofilos. De hecho, los electrofilos conjugados experimentan una reactividad cinética relativamente mayor cuando reaccionan con electrofilos que los dienos no conjugados. Tras la adición electrofílica, el dieno conjugado forma una mezcla de dos productos, el producto cinético y el producto termodinámico, cuya relación está determinada por las condiciones de reacción. Una reacción que produce un producto más termodinámico está bajo control termodinámico, y del mismo modo, una reacción que produce un producto más cinético está bajo control cinético.
Básicos de Reacción
Mecanismo Detallado
Conclusión
La reactividad de dienos conjugados (hidrocarburos que contienen dos dobles enlaces) varía dependiendo de la ubicación de los enlaces dobles y la temperatura de la reacción.Estas reacciones pueden producir productos termodinámicos y cinéticos. Los enlaces dobles aislados proporcionan a los dienos menos estabilidad termodinámica que los dienos conjugados. Sin embargo, son cinéticamente más reactivos en presencia de electrófilos y otros reactivos. Esto es el resultado de la adición de Markovnikov a uno de los enlaces dobles. Se forma un carbocatión después de que se abre un doble enlace. Este carbocatión tiene dos estructuras de resonancia y la adición puede ocurrir en cualquiera de los carbonos positivos.
Problemas de práctica
- Escriba los productos de la adición 1,2 y la adición 1,4 de a) HBr y Br. b) DBr a 1,3-ciclohexadieno. ¿Qué es inusual en los productos de la adición de 1,2 y 1,4 de HX a 1,3 – dienos cíclicos no sustituidos?
- ¿El producto de 1,2 adiciones se forma más rápidamente a temperaturas más altas, a pesar de que es el producto de 1,4 adiciones el que predomina en estas condiciones?
- ¿Por qué el producto de 1,4 adiciones es el producto termodinámicamente más estable?
- De los siguientes cationes radicales, ¿cuál no es una estructura de resonancia razonable?
5. La adición de 1 equivalente de bromo a 2,4-hexadieno a 0 grados C da 4,5-dibromo-2-hexeno más un isómero. Cuál de los siguientes es ese isómero:
- 5,5-dibromo-2-hexeno
- 2,5-dibromo-3-hexeno
- 2,2-dibromo-3-hexeno
- 2,3-dibromo-4-hexeno
6. ¿Cuál de los siguientes será el producto cinéticamente favorecido de la reacción representada?
7. La adición de HBr a 2,3-dimetil-1,3-ciclohexadieno puede ocurrir en ausencia o presencia de peróxidos. En cada caso se obtienen dos productos isoméricos C8H13Br. Cuál de los siguientes es un producto común de ambas reacciones?
8. y 9.
8. El producto cinéticamente controlado en la reacción anterior es:
- 3-Cloro-1-Buteno
- 1-Cloro-2-Buteno
9. Para la reacción en la pregunta 8, ¿cuál es el resultado de la suma de 1,4?
- 3-Cloro-1-Buteno
- 1-Cloro-2-Buteno
Respuestas a los Problemas
1. A) El mismo producto para ambos modos de adición.
B) Se formarán isómeros cis y trans.
La adición del HX a cicloalcas-1,3-dienos no sustituidos de manera 1,2 o 1,4 da el mismo producto por el uso de la simetría.
2. Sí. el Producto Cinético seguirá formándose más rápido, pero en este caso habrá suficiente energía para formar el producto termodinámico porque el producto termodinámico es aún más estable.
3. El producto de 1,4 es más estable termodinámicamente porque hay dos grupos alquilos a cada lado del doble enlace. Esta forma ofrece estabilidad a la estructura general.
4. Todos estos isómeros son viables.
5. D
6. C
7. D
8. A
9. B
Colaboradores
-
William Reusch, Profesor Emérito (Michigan State U.), Libro de Texto Virtual de Química Orgánica
-
Jim Clark (Chemguide.co.uk)
- Natasha Singh