Artículo
John Plante*, Chelsea Eason, Alan Snyder, Dirk Elston
Departamento de Dermatología y Cirugía Dermatológica, Universidad Médica de Carolina del Sur, Charleston, Carolina del Sur
El liquen planopilaris (LPP) es un alopecia caracterizada por prurito, sensibilidad, espinas foliculares y eritema en la fase activa1-3. Aunque se desconoce la etiología exacta, la patogénesis implica una inflamación crónica mediada por linfocitos que, en última instancia,puede conducir a una pérdida de cabello irreversible y cicatrizante a través de su destrucción selectiva del folículo piloso1, 2. Existen tres variantes de LPP que incluyen la forma clásica, la alopecia fibrosante frontal (AFF)y el síndrome de Graham-Little-Piccardi-Lassueur (alopecia progresiva del cuero cabelludo, las axilas, las cejas y el pubis) 2. La LPP a menudo resulta refractaria a las terapias estándar y sigue un curso impredecible y recidivante, lo que a menudo conduce a una calidad de vida gravemente disminuida1, 2,4,5. Aquí discutimos más a fondo nuestro estudio reciente sobre el uso de tofacitinib en el tratamiento de LPP6 recalcitrante.
Se han utilizado numerosas terapias para tratar la PPL con éxito variable1-3,5,7-9. Dado que los tratamientos disponibles actualmente no suelen conducir al crecimiento del cabello, el manejo está dirigido a disminuir la tasa de pérdida de cabello, controlar los síntomas y reducir la inflamación2, 9. Las terapias de primera línea incluyen corticosteroides tópicos intralesionales y de alta potencia, pero pueden provocar atrofia del cuero cabelludo y comprometer el éxito de futuros trasplantes de cabello. Otros fármacos tópicos tienen menos riesgo de atrofia e incluyen los inhibidores de la calcineurina tacrolimus y pimecrolimus2. Aunque no controla el proceso inflamatorio subyacente, el minoxidil tópico y oral también se puede usar para maximizar el crecimiento del cabello en pacientes que también sufren de alopecia de patrón hereditario,casi el 50% de la población9, 10. Las terapias sistémicas adicionales incluyen hidroxicloroquina, micofenolato mofetilo, ciclosporina, metotrexato, talidomida, doxiciclina, retinoides, pioglitazona, inhibidores de la 5-alfa reductasa y prednisolona1,2,9 a corto plazo. Estudios recientes han sugerido el potencial de dosis bajas de naltrexona oral, inyecciones de plasma rico en plaquetas e intervenciones no farmacológicas como el láser excimer, pero ninguna ha sido uniformemente eficaz5, 7,8. Aunque las piezas y extensiones de cabello pueden aumentar el volumen y cubrir áreas alopécicas, se debe tener precaución para evitar la tracción9.
En un estudio publicado recientemente, investigamos el potencial de las formulaciones tópicas y orales (sistémicas) de tofacitinib6. Tofacitinib es un inhibidor de la quinasa Janus (JAK) 1/3 con eficacia contra varias afecciones dermatológicas mediadas por el sistema inmunitario, como dermatitis atópica, alopecia areata y vitiligo11-14. Su actividad inmunomoduladora está mediada por la inhibición de la vía de señalización JAK/STAT12, 13. En LPP, los interferones se han implicado en facilitar el reclutamiento linfocítico y la pérdida del privilegio inmune de las células epiteliales protuberantes 1. A través de los efectos de tofacitinib sobre la vía JAK/STAT, esta inflamación mediada por interferón puede reducirse, mejorando así los síntomas y previniendo una mayor destrucción folicular1,11-13.
Exploramos el potencial terapéutico del tofacitinib en el tratamiento de la PPL refractaria a través de una revisión retrospectiva de la cartografía6. Hasta donde saben los autores, este es el segundo estudio que investiga el uso de tofacitinib en el manejo de LPP 1. Nuestro estudio incluyó a nueve pacientes que habían fracasado a otra terapia, tres de ellos de uso tópico, cinco de uso oral y uno de ambas formulaciones.
Se logró una respuesta inicial favorable en todos los pacientes excepto uno. El sujeto restante respondió mal a la terapia tópica, pero mejoró con la terapia sistémica con tofacitinib. Aunque el número absoluto de pacientes es pequeño, hubo una tendencia hacia una mejor respuesta clínica en los sistémica en comparación con aquellos en terapia tópica. El tiempo hasta una respuesta favorable varió de 1 a 7 meses, con 5 y 8 pacientes que mostraron mejoría en los primeros 3 y 5 meses de tratamiento, respectivamente.
Nuestro patrón de práctica actual es tratar la enfermedad de progresión rápida con un ciclo corto de prednisona o ciclosporina y luego tratar de pasar a la terapia con inhibidores de calcineurina tópicos cuando sea posible (Figura 1). Un subgrupo de pacientes logrará la remisión de su enfermedad con pioglitazona a dosis de 15-45 mg al día. Se debe informar a los pacientes de la indicación etiquetada, los datos mixtos con respecto a la eficacia y la advertencia en caja sobre el cáncer de vejiga con uso prolongado. Nuestra práctica es no continuar con la pioglitazona después de un máximo de 9 meses con dosis crecientes en incrementos. Los agentes adyuvantes incluyen naltrexona a dosis de 5 mg diarios y N-acetilcisteína a dosis de 600-1200 mg tres veces al día. La terapia con láser excimer, UVB de banda estrecha de mano o con tapa de láser de baja intensidad se usa a menudo como terapia complementaria en aquellos con una respuesta parcial. Ocasionalmente, la hidroxicloroquina puede ser beneficiosa, pero la mayoría de los pacientes remitidos a nuestra clínica ya han fracasado en el tratamiento con hidroxicloroquina. Aquellos que no responden pueden requerir tratamiento con metotrexato, micofenolato mofetilo o tofacitinib. Los resultados de nuestro estudio reciente apoyan la idea de que el tofacitinib tópico y sistémico pueden ser modalidades de tratamiento adyuvante viables en casos refractarios. Los trastornos del cabello a menudo responden lentamente, y reevaluamos a intervalos de 3 meses para determinar la respuesta a la terapia y la necesidad de escalamiento.
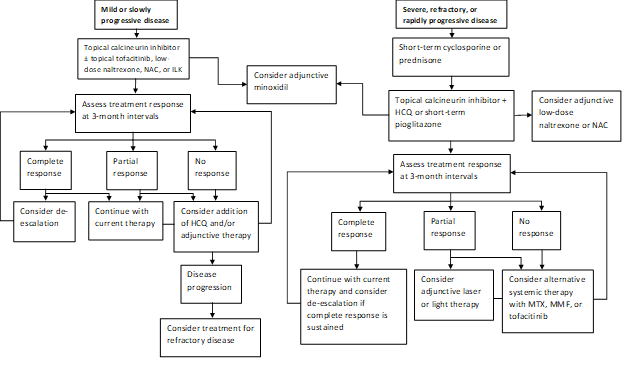
Figura 1: Algoritmo de tratamiento escalonado para LPP
NAC, N-acetilcisteína; ILK, corticosteroides intralesionales; HCQ, hidroxicloroquina; MTX, metotrexato, MMF, micofenolato mofetilo
Al considerar el uso de tofacitinib en la práctica, los profesionales deben equilibrar los beneficios de este medicamento con sus riesgos. Nuestra cohorte solo experimentó anomalías de laboratorio menores (una en terapia tópica y dos en terapia sistémica) que no requirieron intervención. Sin embargo, los proveedores deben ser conscientes de los posibles efectos secundarios al recetar este medicamento, incluido un mayor riesgo de infección, citopenias, hiperlipidemia, anomalías hepáticas y renales, así como el potencial de eventos tromboembólicos14-16. Aunque la formulación tópica ha demostrado concentraciones plasmáticas más bajas que su homóloga sistémica, se han notificado acontecimientos adversos menores y anomalías de laboratorio con la terapia tópica13.
Si bien nuestros resultados son prometedores, deben interpretarse después de considerar varias limitaciones. Se utilizó un diseño de estudio retrospectivo y no se pudo emplear una medida validada de la gravedad de la enfermedad, como el Índice de Actividad del Liquen Planopilaris (IABPL)1,3. La LPPAI es adecuada para estudios prospectivos y proporciona una herramienta estandarizada mediante la cual los proveedores pueden comparar directamente los resultados en varias modalidades de tratamiento. Se utilizaron signos y síntomas como eritema, sensibilidad, presencia de espinas foliculares y área afectada para evaluar la respuesta terapéutica, pero los estudios futuros también deben incluir una medida de la calidad de vida. No se puede excluir la posibilidad de sesgo del observador, ya que nuestro estudio no fue ciego ni aleatorizado.
Además, toda nuestra cohorte utilizó tofacitinib de forma concomitante, lo que dificultó la evaluación de la contribución independiente del fármaco. En un estudio previo, una parte (N=5) de la cohorte utilizó tofacitinib en monoterapia, y la mayoría de los sujetos lograron resultados favorables, pero este estudio también se vio limitado por su pequeño tamaño de muestra y diseño retrospectivo1.
Los estudios actuales están limitados por sus pequeños tamaños de muestra y diseños de estudios retrospectivos, y se necesitan urgentemente estudios prospectivos bien diseñados. Recomendamos un enfoque gradual de la terapia para minimizar el riesgo de efectos adversos. Se debe sopesar el riesgo de cicatrices permanentes frente al riesgo de acontecimientos adversos graves a la luz de los factores individuales y las comorbilidades del paciente, y los pacientes deben ser socios activos en la toma de decisiones. El trasplante de cabello se puede considerar una vez que se ha logrado el control de la enfermedad y la inflamación disminuyó. Es importante tener en cuenta que la terapia agresiva, como la prednisona o la ciclosporina, generalmente se necesita durante las semanas posteriores al trasplante para evitar brotes de enfermedad. Es de esperar un desgaste gradual de los pelos trasplantados, incluso después de un trasplante exitoso, pero los datos sugieren que los pacientes generalmente están satisfechos con los resultados y descubren que el trasplante mejora la calidad de vida.
Abreviaturas
LPP: liquen planopilaris; FFA: alopecia fibrosante frontal; JAK: cinasa Janus; STAT: transductor de señal y activador de proteínas de transcripción; LPPAI: Índice de Actividad de Liquen Planopilaris.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
- Yang CC, Khanna T, Sallee B, et al. Tofacitinib para el tratamiento del liquen planopilaris: Una serie de casos. Dermatol Ter. 2018; 31 (6): e12656. doi: 10.1111 / dth.12656
- Babahosseini H, Tavakolpour S, Mahmoudi H, et al. Liquen planopilaris: estudio retrospectivo sobre las características y el tratamiento de 291 pacientes. J Tratamiento Dermatológico. 2019; 30(6): 598–604. doi:10.1080/09546634.2018.1542480
- Chiang C, Sah D, Cho BK, et al. Hydroxychloroquine and lichen planopilaris: efficacy and introduction of Lichen Planopilaris Activity Index scoring system. J Am Acad Dermatol. 2010; 62(3): 387-392. doi: 10.1016 / j.jaad.2009.08.054
- Alirezaei P, Ahmadpanah M, Rezanejad A, et al. En comparación con los Controles, los Individuos con Liquen Planopilaris Tienen Más Depresión, Una Autoestima Más Baja y una Calidad de Vida Más Baja. Neuropsicobiología. 2019; 78(2): 95-103. doi:10.1159/000499135
- Jha AK. Plasma rico en plaquetas como tratamiento complementario en liquen planopilaris. J Am Acad Dermatol. 2019; 80 (5): e109-e110. doi: 10.1016 / j.jaad.2018.09.013
- Plante J, Eason C, Snyder A, et al. Tofacitinib en el tratamiento del liquen planopilaris: una revisión retrospectiva . J Am Acad Dermatol. 2020; S0190-9622 (20) 30979-8. doi:10.1016 / j.jaad.2020.05.104
- Lajevardi V, Salarvand F, Ghiasi M, et al. Eficacia y seguridad de la naltrexona en dosis bajas orales versus placebo en pacientes con liquen planopilaris: un ensayo clínico controlado aleatorizado . J Tratamiento Dermatológico. 2020; 1-5. doi:10.1080/09546634.2020.1774488
- Lee B, Elston DM. Los usos de la naltrexona en afecciones dermatológicas. J Am Acad Dermatol. 2019; 80(6): 1746-1752. doi: 10.1016 / j.jaad.2018.12.031
- Bolduc C, Sperling LC, Shapiro J. Alopecia cicatricial primaria: Alopecias cicatriciales primarias linfocíticas, que incluyen lupus eritematoso cutáneo crónico, liquen planopilar, alopecia fibrosante frontal y síndrome de Graham-Little. J Am Acad Dermatol. 2016; 75(6): 1081-1099.
- Vano-Galvan S, Trindade de Carvalho L, Saceda-Corral D, et al. El minoxidil oral mejora el grosor del cabello de fondo en liquen planopilaris . J Am Acad Dermatol. 2020; S0190-9622 (20)30566-1. doi: 10.1016 / j.jaad.2020.04.026
- Tegtmeyer K, Zhao J, Maloney NJ, et al. Estudios extraoficiales sobre tofacitinib en dermatología: una revisión . J Tratamiento Dermatológico. 2019; 1–11. doi: 10.1080/09546634.2019.1673877
- Montilla AM, Gomez-Garcia F, Gomez-Arias PJ, et al. Revisión de Alcance sobre el Uso de Medicamentos Dirigidos a la Vía JAK/STAT en Dermatitis Atópica, Vitiligo y Alopecia Areata. Dermatol Otros (Heidelb). 2019; 9(4): 655–683. doi: 10.1007 / s13555-019-00329-y
- Hosking AM, Juhasz M, Mesinkovska NA. Inhibidores tópicos de la cinasa Janus: Una revisión de aplicaciones en dermatología. J Am Acad Dermatol. 2018; 79(3): 535–544. doi: 10.1016 / j.jaad.2018.04.018
- Shreberk-Hasidim R, Ramot Y, Zlotogorski A. Inhibidores de la cinasa Janus en dermatología: Una revisión sistemática. J Am Acad Dermatol. 2017; 76(4): 745-753.e19. doi: 10.1016 / j.jaad.2016.12.004
- Xeljanz / Xeljanz XR (tofacitinib). Nueva York, NY: División de Pfizer Laboratories de Pfizer Inc. https://labeling.pfizer.com/showlabeling.aspx?id=959; 2019. Consultado el 7 de julio de 2020.
- FDA. Un ensayo de seguridad encuentra riesgo de coágulos de sangre en los pulmones y muerte con dosis más altas de tofacitinib (Xeljanz, Xeljanz XR) en pacientes con artritis reumatoide; la FDA lo investigará. https://www.fda.gov/drugs/drug-safety-and-availability/safety-trial-finds-risk-blood-clots-lungs-and-death-higher-dose-tofacitinib-xeljanz-xeljanz-xr; 2019. Consultado el 6 de julio de 2020.