Cromato de potasio
Propiedades químicas del cromato de potasio, Usos,Producción
Compuesto inorgánico
El cromato de potasio, comúnmente conocido como tarapacaita, es un compuesto inorgánico, que es un cristal ortorrómbico o hexagonal amarillo a temperatura ambiente. La densidad relativa es de 2,732, y el punto de fusión es de 968 °C. Es tóxico y puede disolverse en agua para formar una solución de hidrólisis de iones de cromato alcalino. Y es insoluble en alcohol y éter. Después de añadir ácido, la solución amarilla de cromato de potasio se volverá naranja, que es el color del dicromato. Hay un equilibrio entre la conversión de cromato y dicromato en la solución: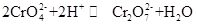
Cuando el ácido se agrega a la solución de cromato de potasio, el equilibrio cambiará hacia la dirección de generación de dicromato de potasio, y cuando el álcali se agrega a la solución de dicromato de potasio, el equilibrio cambiará a la dirección de generación de cromato de potasio. El cromato de potasio tiene propiedades oxidantes, y puede reaccionar con el agente reductor en medio alcalino para formar Cr(OH)4-(a saber, CrO2-). La adición de diferentes soluciones que contienen, respectivamente, iones de bario, iones de plomo y iones de plata a la solución de cromato de potasio formará el cromato insoluble correspondiente: cromato de bario BaCrO4 (amarillo), cromato de plomo PbCrO4 (amarillo), cromato de plata Ag2CrO4(rojo ladrillo). Y la presencia de iones de cromato se puede demostrar por el color característico de estos cromatos insolubles. El cromato de potasio se puede usar como reactivo analítico, oxidante, mordiente, inhibidor de óxido metálico y se puede usar para el análisis de trazas de bario y plata. También se puede utilizar como materia prima de la industria del curtido y la medicina y otros compuestos de cromo. El polvo de cromita Fe (CrO2) 2 se puede utilizar como materia prima y calcinarse con hidróxido de potasio, piedra caliza (dolomita) en el aire, y luego extraerse con solución de sulfato de potasio para obtener cromato de potasio.
La información anterior es editada por Xiao Nan de Chemicalbook.
Método indicador de cromato de potasio
Método indicador de cromato de potasio, también conocido como Moore (Mohr), es un método de titulación de precipitación (método de plata) que utiliza cromato de potasio (K2CrO4) como indicador y nitrato de plata (AgNO3) como solución patrón. Este método se utiliza principalmente para la determinación de iones de cloro (Cl-) o iones de bromuro (Br-). Añadir una pequeña cantidad de K2CrO4 como indicador antes de indicar la determinación, y luego valorar con la solución patrón AgNO3. Después del inicio de la valoración, el precipitado de color blanco (cloruro de plata) o amarillo pálido (bromuro de plata) precipita primero. Cuando Cl o Br precipitan cuantitativamente, un poco de exceso de solución de nitrato de plata hará que la concentración de Ag+ aumente repentinamente para generar inmediatamente precipitación de cromato de plata rojo ladrillo (Ag2CrO4), lo que indica el punto final de valoración. La cantidad de indicador y la acidez de la solución son dos problemas principales de este método de valoración. Si la concentración de K2CrO4 es demasiado alta, el color de la solución de titulación será demasiado profundo para dificultar la observación del color de precipitación de Ag2CrO4 al final; si la concentración de K2CrO4 es demasiado baja, se necesitará una cantidad excesivamente considerable de solución de nitrato de plata después de la precipitación cuantitativa de haluro de plata para generar precipitación de cromato de plata para indicar el punto final de titulación, lo que resultará en un aumento del error de titulación. Cuando se utiliza la solución AgNO3 de 0,1 mol/l para valorar el 0.haluro de 1mol/l, si la concentración de K2CrO4 es de 5× 10-3mol / l, el error de punto final es solo +0,06%, lo que se puede pensar que la precisión del resultado del análisis no se ve afectada. El método del indicador K2CrO4 no se puede llevar a cabo en solución ácida o alcalina, porque K2CrO4 se convertirá en dicromato de potasio (K2Cr2O7) a un valor de pH pequeño, y Ag+ se precipitará en forma de óxido de plata (Ag2O) cuando el pH es demasiado alto. Comúnmente, el rango de acidez adecuado es pH = 6.5~ 10.5, pero cuando hay sales de amonio en la solución, la acidez de la solución pH = 6.5~7.2 es apropiada.
El método indicador de cromato de potasio solo se puede utilizar para la valoración directa de iones Cl o Br, y el resultado de la valoración es su total cuando coexisten. Este método no es adecuado para la determinación de iod yoduro (I-) o ion tiocianato (SCN-), porque se absorben con demasiada facilidad por sedimentación y el punto final no está claro. Este método tampoco es adecuado para valorar Ag + con Cl -, pero el Ag+ se puede determinar utilizando la valoración posterior, es decir, agregar una cantidad excesiva de solución patrón de NaCl en la solución de prueba y luego usar la solución patrón AgNO3 para valorar el exceso de iones Cl. En la solución, todos los cationes que pueden formar precipitados con CrO2-4 o los aniones que pueden precipitar con Ag+ interferirán con la determinación. El método indicador de cromato de potasio se utiliza principalmente para la determinación de los iones Cl en solución muy diluida, como la determinación de Cl en impurezas de agua potable y productos industriales.
Dicromato de potasio
El dicromato de potasio, también conocido como potasio de alumbre rojo, es cristal triclínico de color rojo anaranjado o cristal con forma de aguja. La densidad es de 2,676 g / cm3. La temperatura de fusión es de 398 °C. Es soluble en agua e insoluble en etanol. Tiene una fuerte propiedad oxidante y se descompone a 1300 °C.
En la producción, el dicromato de potasio siempre se usa para introducir cromo para colorear el esmalte cuando se derrite. Es el agente colorante del esmalte amarillo leche de titanio coloreado y el esmalte amarillo titanio, y la dosis utilizada generalmente es de 0,06%~0,12%. El dicromato de potasio y el óxido de cobre también se pueden mezclar para obtener glaseado de color verde, verde bambú, verde fruta y otros colores. Sin embargo, estos esmaltes de colores son generalmente menos brillantes debido a la influencia del cromato.
El esmalte de color obtenido a partir de óxido de cromo o dicromato de potasio (sodio) a menudo es de color amarillo verdoso debido al cambio de valencia de los iones de cromo en el proceso de fusión. El dicromato de potasio también se usa comúnmente para hacer varios pigmentos verdes y pigmentos rosados.
El dicromato de potasio debe cumplir los objetivos requeridos: contenido de dicromato de potasio ≥ 99%, contenido de cloruro (Cl) ≤ 0,08%, insoluble en agua ≤ 0,05%.
La información anterior es compilada por Yaoyao de Chemicalbook.
Solubilidad en agua (g/100 ml)
Gramos disueltos por 100 ml de agua a diferentes temperaturas (°C):
60 g/10 °C; 63,7 g/20 °C; 66,7 g/30 °C; 67,8 g/40 °C
70,1 g/60 °C; 74,5 g/90 °C
Toxicidad
Véase cromato de sodio
Propiedades químicas
Cristal ortorrómbico amarillo limón; Soluble en agua; insoluble en alcohol
Aplicación
Utilizado como reactivo analítico, oxidante, mordiente e inhibidor de óxido metálico;utilizado para la fabricación de cromato,utilizado como oxidante y mordiente de impresión y teñido. Utilizado para tinta, pintura, esmalte,corrosión de metales, etc., utilizado principalmente en la fabricación de reactivos químicos y pigmentos.
Preparación
Método de neutralización: Disuelva el dicromato de potasio en el licor madre y el agua, y luego agregue la mezcla al reactor. A continuación, agregue hidróxido de potasio bajo agitación para llevar a cabo la reacción de neutralización. El cromato de potasio producido es débilmente alcalino, y luego se evapora para la concentración, se enfría para la cristalización, se separa y se seca para obtener los productos terminados de cromato de potasio.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
El licor madre separado se devolverá a la etapa de disolución para disolver el dicromato de potasio.
Propiedades químicas
Cristales amarillo limón
Propiedades químicas
El cromato de potasio (VI) es un sólido cristalino amarillo.
Usos
El cromato de potasio (K2CrO4) es soluble en agua y se utiliza para fabricar tintas y pigmentos de pintura de color amarillo brillante. También se utiliza como reactivo en laboratorios químicos y como mordiente para»fijar» tintes en textiles de colores.
Usos
Se utiliza como agente oxidante.
Usos
Tiene una aplicación limitada en esmaltes, acabado de cuero, impermeabilización de metales, siendo reemplazado por la sal de sodio; como reactivo en química analítica.
Definición
ChEBI: Sal de potasio compuesta de iones de potasio y cromato en una proporción de 2:1.
Definición
A sal que contiene ionCrO42 -.
Definición
cromato de potasio: sólido cristalino de color amarillo brillante, K2CrO4, soluble en agua e insoluble en alcohol; rómbico; r. d.2,73; p. m. 968,3°C; se descompone sin hervir. Se produce industrialmente tostando mineral de cromita en polvo con hidróxido de potasio y piedra caliza y lixiviando la ceniza resultante con solución de sulfato de potasio caliente. El cromato de potasio se utiliza en el acabado de cuero, como mordiente textil, e inamelas y pigmentos. En el laboratorio se utiliza como agente analítico y como indicador. Al igual que otros compuestos de cromo(III), es tóxico cuando se ingiere o inhala.
Descripción general
El cromato de potasio es un sólido cristalino amarillo. El cromato de potasio es soluble en agua. El principal peligro es la amenaza para el medio ambiente. Deben adoptarse medidas inmediatas para limitar su propagación al medio ambiente. El cromato de potasio se utiliza en análisis químicos, en la fabricación de pigmentos para pinturas y tintas, como fungicida y para fabricar otros compuestos de cromo.
Reacciones al aire & Al agua
Solubles en agua.
Perfil de reactividad
Los agentes oxidantes , como el cromato de potasio, pueden reaccionar con agentes reductores para generar calor y productos que pueden ser gaseosos (causando la presurización de contenedores cerrados). Los propios productos pueden ser capaces de reacciones adicionales (como la combustión en el aire). La reducción química de los materiales de este grupo puede ser rápida o incluso explosiva, pero a menudo requiere iniciación (calor, chispa, catalizador, adición de un solvente). Las mezclas explosivas de agentes oxidantes inorgánicos con agentes reductores suelen persistir inalteradas durante largos períodos si se impide su iniciación. Tales sistemas son típicamente mezclas de sólidos, pero pueden involucrar cualquier combinación de estados físicos. Algunos agentes oxidantes inorgánicos son sales de metales solubles en agua; la disolución diluye pero no anula el poder oxidante de dichos materiales. Los compuestos orgánicos, en general, tienen cierto poder reductor y, en principio, pueden reaccionar con compuestos de esta clase. La reactividad real varía mucho con la identidad del compuesto orgánico. Los agentes oxidantes inorgánicos pueden reaccionar violentamente con metales activos, cianuros, ésteres y tiocianatos.
Peligro
Tóxico por ingestión e inhalación.
Peligro para la salud
La inhalación causa irritación local de las membranas mucosas; la irritación nasal continua puede resultar en perforación del tabique nasal. La ingestión puede causar gastroenteritis violenta, colapso circulatorio, vértigo, coma y nefritis tóxica; la ingestión de cantidades excesivas puede ser fatal. El contacto con los ojos causa irritación severa y conjuntivitis. La exposición repetida o prolongada al polvo, la niebla o las soluciones puede causar dermatitis; el contacto con roturas en la piel puede causar `llagas cromadas» que aparecen como úlceras de borde duro de curación lenta que dejan el área vulnerable a la infección.
Riesgo de incendio
Comportamiento en el fuego: Puede aumentar la intensidad del fuego si está en contacto con materiales combustibles. Enfríe los recipientes y el material derramado con abundante agua.
Perfil de seguridad
Carcinógeno confirmado con datos tumorogénicos experimentales. Envenenamiento por ingestión, vía intravenosa, subcutánea e intramuscular. Un teratógeno experimental. Otros efectos reproductivos experimentales. Datos de mutaciones humanas reportados. Un potente oxidante. Cuando se calienta para la composición, emite vapores tóxicos de K2O. Se utiliza como mordiente para la lana, en la oxidación y el tratamiento de tintes en materiales. Véase también COMPUESTOS DE CROMO.
Exposición potencial
El cromato de potasio se utiliza en la impresión: procesamiento fotomecánico; producción de pigmentos de cromo; y métodos conservantes de lana; para hacer tintes, pigmentos, tintas y esmaltes; como agente oxidante; reactivo analítico; en galvanoplastia; explosivos.
Envío
UN1479 Sólido oxidante, n.e. p., Clase de peligro: 5.1; Etiquetas: 5.1-Oxidante, Se Requiere Nombre técnico. UN3288 Sólidos tóxicos, inorgánicos, n.e. p., Clase de peligro: 6.1; Etiquetas: 6.1-Materiales venenosos, Nombre técnico Requerido
Métodos de purificación
Cristalizarlo a partir de agua de conductividad (0,6 g/mL a 20o) y secarlo entre 135o y 170o.
Incompatibilidades
Un potente oxidante. Reacciones violentas con combustibles, sustancias orgánicas, metales en polvo o sustancias fácilmente oxidables. El contacto con hidroxilamina, hidracina causa explosión.