Educación en el tren
Aunque cada día aprendemos más sobre la fisiopatología de la enfermedad de Parkinson, todavía se considera en gran medida idiopática (de causa desconocida). Probablemente implica la interacción de la susceptibilidad del huésped y los factores ambientales. Un pequeño porcentaje de los casos están vinculados genéticamente y los factores genéticos se están estudiando intensamente.
Fisiológicamente, los síntomas asociados con la enfermedad de Parkinson son el resultado de la pérdida de varios neurotransmisores, especialmente la dopamina. Los síntomas empeoran con el tiempo a medida que se pierden más y más células afectadas por la enfermedad. El curso de la enfermedad es muy variable, con algunos pacientes que exhiben muy pocos síntomas a medida que envejecen y otros cuyos síntomas progresan rápidamente.
El Parkinson se ve cada vez más como una enfermedad neurodegenerativa compleja con una secuencia de progresión. Hay fuertes evidencias de que primero afecta el núcleo motor dorsal del nervio vago y los bulbos olfativos y el núcleo, luego el locus coeruleus y, finalmente, la sustancia negra. Las áreas corticales del cerebro se ven afectadas en una etapa posterior. El daño a estos diversos sistemas neuronales explica los cambios fisiopatológicos multifacéticos que causan deficiencias no solo en el sistema motor, sino también en los sistemas cognitivo y neuropsicológico (Kwan & Whitehill, 2011).
El papel de la dopamina
La dopamina, al igual que otros neurotransmisores, transmite mensajes químicos de una célula nerviosa a otra a través de la sinapsis, un espacio entre la célula presináptica y el receptor postsináptico. La dopamina se secreta en la sinapsis desde las vesículas de almacenamiento de membrana en la membrana presináptica. Atraviesa la sinapsis y se une a la membrana postsináptica, donde activa los receptores de dopamina. La dopamina no utilizada que queda en la sinapsis se absorbe de nuevo en la célula presináptica; una vez de vuelta en la célula presináptica, el exceso de dopamina se reempaca en vesículas de almacenamiento y se libera una vez más en la sinapsis.
Dentro de la sinapsis, a medida que la dopamina viaja de una célula a otra, puede ser degradada e inactiva por dos enzimas, MAO (monoaminooxidasa) y COMT (catecol-O-metil transferasa). Una estrategia terapéutica introduce un inhibidor de MAO en la sinapsis, que interrumpe la acción de la enzima MAO y previene la descomposición de la dopamina. Esto permite que más dopamina permanezca en la sinapsis y aumenta la probabilidad de que se una a la membrana postsináptica.
Transmisión sináptica química
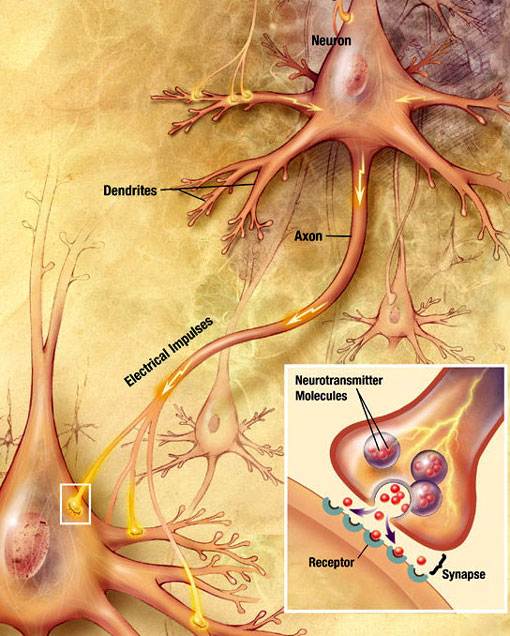
Una onda electroquímica llamada potencial de acción viaja a lo largo del axón de una neurona. Cuando el potencial de acción alcanza el terminal presináptico, provoca la liberación de una pequeña cantidad de moléculas neurotransmisoras, que se unen a moléculas receptoras químicas ubicadas en la membrana de la neurona postsináptica, en el lado opuesto de la hendidura sináptica. Fuente: Wikimedia Commons.
Pérdida progresiva de Dopamina
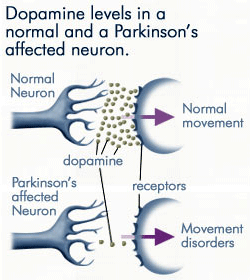
A medida que las neuronas afectadas por la enfermedad de Parkinson producen cada vez menos dopamina, se dispone de mucha menos dopamina para unirse a los receptores de dopamina de la membrana postsináptica. Fuente: anti-agingfirewalls.com.
Aunque la pérdida de células de dopamina no se puede medir directamente, las mediciones en personas neurológicamente normales y en primates no humanos revelan una pérdida lenta y progresiva de dopamina con la edad. En la enfermedad de Parkinson, la pérdida ocurre a un ritmo mucho mayor y tanto las medidas bioquímicas como los estudios de imagen sugieren que hay una disminución significativa de la dopamina en el momento en que aparecen los síntomas motores. En este punto de vista, la enfermedad de Parkinson es una versión acelerada de la muerte celular observada con el envejecimiento normal (Cookson, 2009). Esto se ilustra en el gráfico a continuación, que muestra la disminución de las neuronas dopaminérgicas durante el envejecimiento normal, en la EP idiopática, en la EP causada por factores ambientales o genéticos, y en la EP de inicio temprano.
Evolución de la Depleción de Dopamina en la Enfermedad de Parkinson
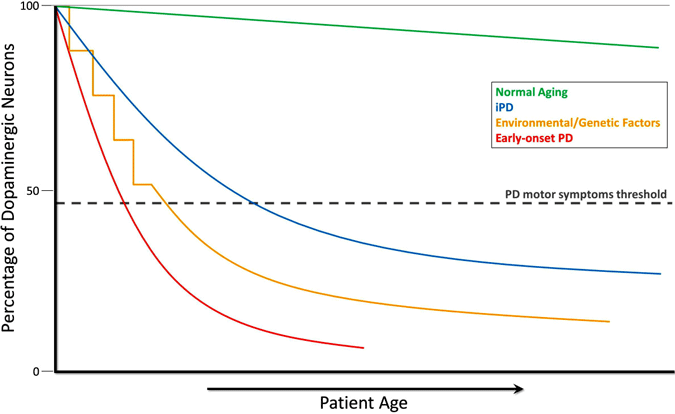
Durante el curso del envejecimiento normal (línea verde), se produce una degeneración dopaminérgica pequeña pero lenta sin ningún síntoma motor. La EP idiopática (ENI, línea azul) es de origen desconocido, pero se cree que se desarrolla gradualmente, con una degeneración lenta de las neuronas dopaminérgicas que conduce a los síntomas motores clásicos de la EP más adelante en la vida. Otro modelo de neurodegeneración de dopamina que conduce a síntomas motores de DP implica la exposición repetida a tóxicos ambientales a lo largo del tiempo en combinación con una predisposición genética a la pérdida de neuronas dopaminérgicas (línea amarilla). La EP de inicio temprano (línea roja), causada por mutaciones en el gen PARKIN, implica una disminución precipitada de las neuronas dopaminérgicas, y los síntomas motores de la EP pueden presentarse décadas antes de los de la EP idiopática. Un escenario más (no mostrado) de desarrollo de síntomas motores de DP involucra posibles tóxicos ambientales en el útero o factores genéticos que conducen a un número atípicamente bajo de neuronas dopaminérgicas al nacer y una mayor susceptibilidad al desarrollo de DP (Haas et al., 2012).
La degeneración de las neuronas dopaminérgicas es particularmente evidente en una parte de la sustancia negra llamada pars compacta. Significativamente, la pérdida de dopamina en la pars compacta aumenta el impulso excitatorio general en los ganglios basales, * interrumpiendo el control motor voluntario y causando los síntomas característicos de la EP. La normalización de la función motora se observa inicialmente con el tratamiento con levodopa (Gasparini et al., 2013).
*Los principales componentes de los ganglios basales son el cuerpo estriado (núcleo caudado y putamen), el globo pálido, la sustancia negra, el núcleo accumbens y el núcleo subtalámico.
A medida que aumenta la gravedad de la EP, el agotamiento de dopamina conduce a cambios adicionales en las vías de los ganglios basales, incluida la función alterada de otros neurotransmisores de los ganglios basales, como el glutamato, el GABA y la serotonina (Gasparini et al., 2013). Aunque hay una vulnerabilidad relativa de las neuronas productoras de dopamina en la sustancia negra, no todas las células dopaminérgicas se ven afectadas en la enfermedad de Parkinson; en algunas partes del cerebro, las neuronas productoras de dopamina se salvan relativamente (Cookson, 2009).
La Vía Nigroestriatal
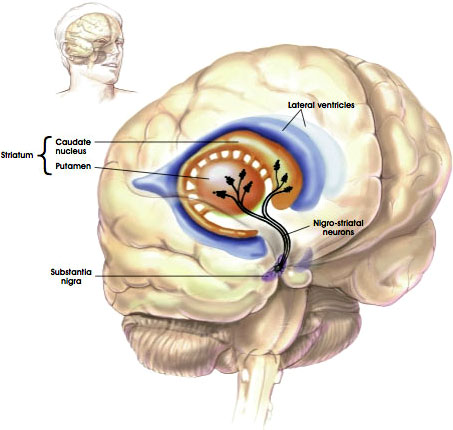
Fuente: NIH, n.d..
Los cuerpos de Lewy y la Alfa-Sinucleína
Los cuerpos de Lewy son agregados e inclusiones anormales de proteínas que se desarrollan dentro de las células nerviosas en personas con enfermedad de Parkinson. Las agregaciones generalmente consisten en agregados fibrilares insolubles que contienen proteínas mal plegadas. Un gran número de moléculas se han identificado en cuerpos de Lewy, pero una proteína llamada alfa-sinucleína es el componente principal.
Cuerpos de Lewy (Inclusiones de Alfa-Sinucleína)
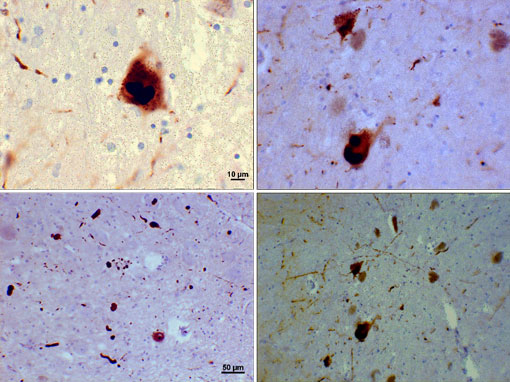
Fotomicrografía de regiones de sustancia negra en un paciente con Parkinson que muestra cuerpos de Lewy y neuritas de Lewy en varios aumentos. Los paneles superiores muestran un aumento de 60x de las inclusiones intraneuronales de alfa-sinucleína agregadas para formar cuerpos de Lewy. Los paneles inferiores son imágenes de aumento de 20× que muestran neuritas de Lewy en forma de hebra y cuerpos redondeados de Lewy de varios tamaños. Imágenes cortesía de Suraj Rajan.
La patología de Lewy abarca muchas regiones del cerebro y algunos informes han sugerido que la sustancia negra no es el primer lugar donde se forman cuerpos de Lewy en la enfermedad de Parkinson. Inclusiones y agregados probablemente simbolizan la etapa final de una cascada de eventos complicados. Una etapa más temprana puede estar más directamente relacionada con la patogénesis del trastorno que las inclusiones en sí, que pueden o no representar las características distintivas del diagnóstico.
Los cuerpos de Lewy también se ven en «demencia con cuerpos de Lewy», lo que sugiere que estas afecciones están relacionadas entre sí por patología compartida y posiblemente por etiología compartida. Ni la pérdida de células ni la formación de cuerpos de Lewy son absolutamente específicas para la EP, pero ambas son necesarias para un diagnóstico de EP según las definiciones actuales (Cookson, 2009).
Los trastornos neurodegenerativos como la enfermedad de Alzheimer, la degeneración frontal-temporal, la enfermedad de priones, la corea de Huntington y las enfermedades de motoneuron se están dando cuenta cada vez más de que tienen mecanismos celulares y moleculares comunes, incluida la agregación de proteínas y la formación de cuerpos de inclusión en ciertas áreas del sistema nervioso (Jellinger, 2011).
Inflamación y Respuesta inmunitaria
El desencadenante de la degeneración dopaminérgica parece ser multifactorial, afectado tanto por elementos endógenos como ambientales. La inflamación y las respuestas inmunitarias se consideran cada vez más como mediadores importantes de la degeneración dopaminérgica. Estudios poblacionales amplios han sugerido que las personas que toman medicamentos antiinflamatorios no esteroideos (AINE) tienen menos riesgo de desarrollar EP idiopática, lo que sugiere que los medicamentos antiinflamatorios pueden ser un tratamiento prometedor que modifica la enfermedad para los pacientes parkinsonianos (Barcia, 2013).
Las nuevas fases de los ensayos han incluido tratamientos antiinflamatorios, buscando específicamente un biomarcador objetivo en los tratamientos destinados a reducir los cambios inflamatorios en pacientes con EP. Los investigadores están utilizando herramientas de neuroimagen para desarrollar un biomarcador relevante con la intención de probarlo en grandes ensayos clínicos de imágenes. El resultado de estos ensayos proporcionará datos para probar y monitorear la progresión de los tratamientos antiinflamatorios para la EP y ayudará a identificar la ventana terapéutica oportuna para detener, o al menos retardar, la degeneración dopaminérgica mediada por inflamación (Barcia, 2013).
Parkinsonismo
El parkinsonismo, también conocido como «Parkinson atípico», «Parkinson secundario» o «síndrome de Parkinson», es un síndrome neurológico en el que un paciente presenta algunos de los síntomas asociados con la enfermedad de Parkinson: temblor, rigidez, bradicinesia e inestabilidad postural. Pero el parkinsonismo no es la enfermedad de Parkinson. No se cree que el parkinsonismo sea causado por la enfermedad de Parkinson y los pacientes generalmente responden mal a la intervención farmacológica. El parkinsonismo a menudo tiene una causa identificable, como la exposición a toxinas, metanfetamina, traumatismos, accidentes cerebrovasculares múltiples, otros trastornos del sistema nervioso o enfermedades. En general, los cuerpos de Lewy no se ven en el parkinsonismo.
El término parkinsonismo también se asocia con trastornos como parálisis supranuclear progresiva, atrofia de múltiples sistemas, demencia con cuerpos de Lewy, degeneración corticobasal, parkinsonismo vascular, parkinsonismo inducido por medicamentos y parkinsonismo secundario a infección y otras causas (Hohler et al., 2012). Una forma de parkinsonismo reversible puede ocurrir por el uso de ciertos medicamentos neurolépticos, particularmente reserpina, antipsicóticos (haloperidol) y metoclopramida. La exposición a ciertas toxinas, el envenenamiento severo por monóxido de carbono y el envenenamiento por mercurio también pueden conducir al parkinsonismo.
La aparición a principios de la década de 1980 de síntomas de parkinsonismo en un grupo de drogadictos que habían consumido un lote contaminado de un opiáceo sintético llevó al descubrimiento de la sustancia química MPTP como agente causante del síndrome de parkinsonismo en primates no humanos, así como en humanos. El MPTP se puede producir al fabricar una forma de heroína (el MPTP se convierte en una neurotoxina que destruye selectivamente las células de dopamina en la sustancia negra). Estos casos son poco frecuentes y han afectado sobre todo a los consumidores de drogas a largo plazo.
El abuso de metanfetamina también se ha relacionado con el parkinsonismo. En animales experimentales, la exposición a la metanfetamina daña las fibras dopaminérgicas en el cuerpo estriado*, así como los cuerpos celulares en la sustancia negra, haciéndose eco de la degeneración observada en pacientes humanos con EP. También se ha observado daño selectivo a los terminales dopaminérgicos en el cuerpo estriado en consumidores humanos de metanfetamina, aunque hasta ahora no hay evidencia de que el abuso de metanfetamina dañe los cuerpos celulares dopaminérgicos en la sustancia negra (Granado et al., 2013).
* El núcleo más grande de los ganglios basales, el estriado, consiste en el núcleo caudado y el putamen.
Se ha planteado la hipótesis de que el consumo de metanfetamina puede predisponer a los consumidores al desarrollo futuro de la enfermedad de Parkinson. Esta hipótesis ha sido respaldada por trabajos epidemiológicos recientes que indican que los consumidores de metanfetamina tienen un mayor riesgo de desarrollar EP. Esto es consistente con los efectos neurotóxicos persistentes de la metanfetamina en animales de experimentación (Granado et al., 2013).
Los pacientes con parkinsonismo a menudo son difíciles de manejar como pacientes ambulatorios. La complejidad de sus síntomas, los déficits cognitivos y autonómicos adicionales, la mala respuesta a la mayoría de los medicamentos para la EP y el descenso relativamente rápido del estado contribuyen a los desafíos en el manejo de estos pacientes, particularmente a medida que la enfermedad progresa (Hohler et al., 2012).