MO para HF
Orbitales moleculares para Moléculas Diatómicas Heterogéneas
Un enfoque simple de la teoría de orbitales moleculares (MO) para moléculas diatómicas heterogéneas es mostrar el diagrama de nivel de energía. Los niveles de energía MO se pueden calcular siguiendo estos pasos:
Recuerde que la energía \(E_n\) para el número cuántico n es para un elemento con Z atómica es aproximadamente
\
Usamos \(Z_ {eff}\) en lugar de Z para significar que tenemos que modificar el número atómico para obtener una carga atómica efectiva para el núcleo. Dado que estamos tratando con valores aproximados, se puede usar Z directamente. El nivel de energía orbital de 1s es de -13,6 eV para los átomos de hidrógeno, medido como la energía de ionización de H.
Por lo tanto, para el número cuántico n = 1, el nivel de energía para 1s de He es de aproximadamente – 54 eV. Del mismo modo, el nivel de energía 1s para F es de – 1101 eV. Los niveles de energía 2s y 2p para He son aproximadamente – 13.6 eV, que es similar al de 1s orbital de H.
Por lo tanto, el nivel de energía 2s para Li es aproximadamente -6 eV. Sin embargo, para átomos multielectrónicos, la subcapa p y la subcapa s tienen diferentes energías debido a la penetración. A este nivel, no podemos ser precisos al respecto, sino simplemente pensar que los orbitales 2p tienen una energía más alta que el orbital 2s. Por lo general, los orbitales atómicos con niveles de energía similares entre sí se superponen para formar orbitales moleculares. Por lo tanto, igualamos los niveles de energía de los orbitales atómicos, y luego hacemos MOs de unión y anti-unión de ellos.
Sin embargo, en caso de que el nivel de energía orbital atómica sea muy diferente, usamos orbitales atómicos de la subcapa incompleta para formar MOs.
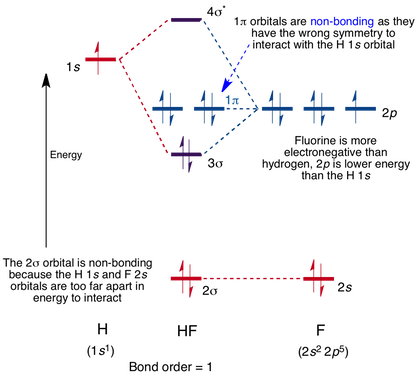
Diagrama Orbital molecular para la molécula de HF
La interacción ocurre entre el orbital 1s en hidrógeno y el orbital 2p en flúor causando la formación de un orbital molecular sigma-bonding y un orbital molecular sigma-antibonding, como se muestra a continuación.