No, Los científicos Nunca Podrán Eliminar El Espacio Vacío De Los Átomos
Si tomaras cualquier objeto en el Universo que esté hecho de materia normal, cualquier cosa que un ser humano pueda tocar, ver o detectar de otra manera una interacción con el uso de nuestros cuerpos, descubrirías que podrías dividirlo en componentes cada vez más pequeños. Un cuerpo humano entero se puede dividir en órganos, que a su vez están compuestos de células. Cada célula se compone de orgánulos, que son estructuras más pequeñas con funciones especializadas, y los orgánulos dependen de las interacciones que ocurren a nivel molecular.
La composición del conjunto completo de moléculas son átomos: el componente más pequeño de la materia normal que conserva el carácter individual y las propiedades del elemento en cuestión. Los elementos se definen por el número de protones en el núcleo de cada átomo, donde un átomo consiste en electrones que orbitan ese núcleo. Pero a pesar del hecho de que los átomos son en su mayoría espacio vacío en su interior, no hay forma de eliminar ese espacio. Esta es la historia del por qué.

Un átomo, en el nivel más básico, consiste en un núcleo atómico de carga positiva que es extremadamente pequeño en volumen. Para cada protón en el núcleo atómico, hay un cuántico de carga igual y opuesto que orbita alrededor de él, creando un sistema neutral general: el electrón.
Sin embargo, mientras que el núcleo atómico está confinado a un volumen extremadamente pequeño — el diámetro de un protón está alrededor de 1 femtómetro, o 10^-15 m—, los electrones en órbita, que a su vez son partículas puntuales, ocupan un volumen que es aproximadamente 1 ångstrom (10^-10 m) en las tres dimensiones.
El primer experimento que demostró esta enorme diferencia tiene más de un siglo de antigüedad, cuando el físico Ernest Rutherford bombardeó una delgada lámina de oro con partículas radiactivas.
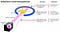
Lo que Rutherford hizo fue simple y directo. El experimento comenzó con un aparato en forma de anillo diseñado para detectar partículas que lo encontraran desde cualquier dirección. En el centro del anillo, se colocó una lámina de oro finamente martillado de un grosor tan pequeño que no se podía medir con herramientas de principios del siglo XX: probablemente solo unos pocos cientos o miles de átomos de ancho.
Fuera del anillo y de la lámina, se colocó una fuente radiactiva, de modo que bombardeara la lámina de oro desde una dirección en particular. La expectativa era que las partículas radiactivas emitidas verían la lámina de oro de la misma manera que un elefante en carga vería un trozo de papel de seda: simplemente pasarían a través como si la lámina no estuviera en absoluto allí.
Pero esto resultó ser solo cierto para la mayoría de las partículas radiactivas. Algunos de ellos, pequeños en número pero de vital importancia, se comportaron como si salieran de algo duro e inamovible.

Algunos de ellos se dispersaron hacia un lado u otro, mientras que otros parecían rebotar hacia su dirección de origen. Este primer experimento proporcionó la primera evidencia de que el interior de un átomo no era una estructura sólida como se había previsto anteriormente, sino que consistía en un núcleo pequeño y extremadamente denso y una estructura exterior mucho más difusa. Como señaló el propio Rutherford, mirando hacia atrás décadas después,
«Fue el evento más increíble que me haya pasado en mi vida. Era casi tan increíble como si te despidieran de 15 pulgadas shell en un pedazo de papel de seda y se volvió y golpeó.»
Este tipo de experimento, en el que se dispara una partícula de baja, media o alta energía a una partícula compuesta, se conoce como dispersión inelástica profunda, y sigue siendo nuestro mejor método para sondear la estructura interna de cualquier sistema de partículas.

Para el átomo, desde uno simple como el hidrógeno hasta uno complejo como el oro, el plomo o el uranio, los electrones se pueden encontrar mucho más allá de la extensión del núcleo atómico. Mientras que un núcleo atómico está confinado a un volumen que es de aproximadamente 1 femtómetro cúbico (10^-15 metros en cada lado), se puede encontrar un electrón distribuido probabilísticamente sobre un volumen que es aproximadamente un cuatrillón (101 times) veces mayor. Esta propiedad es independiente del elemento que consideremos, del número de electrones presentes (siempre que sea al menos uno), o del método que utilicemos para medir el electrón o el núcleo.
El hecho de que los átomos son en su mayoría espacios vacíos es conocido, hoy en día, incluso para la mayoría de los escolares, que aprenden este hecho aproximadamente al mismo tiempo que aprenden sobre la estructura de los átomos. Al enterarse de esto, muchos de ellos se preguntan, como estoy seguro de que muchos de ustedes se preguntan, ¿por qué no pueden simplemente eliminar ese espacio vacío y átomos compactos a escalas mucho más pequeñas, como el tamaño de un núcleo atómico?

En el mundo clásico, donde la naturaleza juega con reglas con las que estamos familiarizados y que coinciden con lo que predice nuestra intuición, es muy fácil controlar las posiciones de las partículas. Pero a nivel cuántico, hay una limitación fundamental establecida por las reglas de la naturaleza: el principio de incertidumbre de Heisenberg.
Incluso si sabes todo lo que hay que saber sobre un electrón orbitando un núcleo atómico, incluyendo:
- qué nivel de energía ocupa,
- cuál es su estado cuántico,
- y cuántos otros electrones hay en los niveles de energía circundantes,
seguirá habiendo una serie de propiedades que son inherentemente inciertas. En particular, una de las propiedades inherentemente inciertas es la posición del electrón; solo podemos trazar la distribución de probabilidad de dónde es probable que esté el electrón.
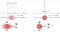
La razón de esto es la incertidumbre cuántica inherente entre la posición y el momento. El momento de un electrón, que podemos considerar como la unidad de movimiento que tendrá cualquier partícula, se puede conocer con cierta precisión al realizar una medición específica.
Sin embargo, cuanto más precisa sea su medición reveladora de momento, mayor será la incertidumbre inherente que el acto de medirla impartirá a la posición del electrón. Por el contrario, cuanto más preciso se intente medir la posición del electrón, mayor será la incertidumbre que se induzca en el momento del electrón. Solo puede conocer esas dos cantidades, posición e impulso, con una precisión limitada al mismo tiempo, ya que medir una con más precisión creará una incertidumbre inherentemente mayor en la que no mida.

El electrón ocupa naturalmente el gran volumen que hemos llegado a esperar alrededor del núcleo atómico por dos razones.
- El tamaño de la nube de probabilidad que ocupa el electrón depende de la relación carga-masa del electrón. Con la misma carga de magnitud que el protón, pero solo 1/1836 de la masa, incluso la fuerza electromagnética ultra fuerte no puede confinar el electrón a un volumen más pequeño de lo que vemos.
- La fuerza externa que comprime un electrón hacia abajo sobre un núcleo atómico, restringiendo los componentes externos de la nube de probabilidad, es extremadamente pequeña incluso para átomos unidos en una red ultra fuerte. Las fuerzas entre los electrones en dos átomos diferentes, incluso en átomos que están unidos, son muy pequeñas en comparación con la fuerza entre el núcleo atómico y un electrón.
Cada una de estas razones nos da la esperanza de una solución alternativa que funcione en la práctica, pero con aplicabilidad limitada.

Puedes reemplazar el electrón con una partícula más masiva con la misma carga eléctrica. Hay dos partículas similares a electrones que existen en el Modelo Estándar con la misma carga que el electrón: el muón y el tau. El muón es aproximadamente 200 veces más masivo que un electrón, por lo que un átomo de hidrógeno muónico (con un protón para un núcleo, pero un muón en lugar de un electrón que lo orbita) es aproximadamente 200 veces más pequeño que el hidrógeno estándar.
Si se une hidrógeno muónico a una serie de otros átomos, servirán como catalizador para la fusión nuclear, lo que le permitirá proceder con temperaturas y energías mucho más bajas que la fusión estándar. Sin embargo, los muones solo viven ~2 microsegundos antes de decaer, y el tau más masivo vive menos de un picosegundo. Estos átomos exóticos son demasiado transitorios para permanecer útiles por mucho tiempo.

Alternativamente, puede aumentar enormemente la presión sobre los átomos acumulando cantidades increíbles de masa en un solo lugar en el espacio. Un átomo individual en aislamiento podría ser solo un ångstrom en tamaño, pero si se apila el valor de una estrella de material a su alrededor, ese átomo sentirá una presión externa que «aprieta» el electrón para ocupar un volumen mucho más limitado.
Cuanto mayor es la presión, más confinados están los electrones, y más pequeños son los átomos en términos de extensión física. Hay un límite a la presión exterior que los átomos pueden soportar antes de que ocurra la misma catástrofe que antes: los núcleos atómicos se acercan tanto que sus funciones de onda se superponen y puede ocurrir la fusión nuclear. En una enana blanca, este umbral se produce a aproximadamente 1,4 masas solares; si lo supera, terminará iniciando una reacción de fusión incontrolada, que en este caso dará lugar a una supernova de tipo Ia.

Podría ser un sueño de ciencia ficción delicioso eliminar el espacio vacío de los átomos, disminuyendo el volumen que ocupa la materia por factores de millones, billones o incluso más. Sin embargo, no es que los electrones que orbitan el núcleo ocupen inherentemente un volumen extremadamente grande de espacio, sino que las propiedades cuánticas inherentes a las partículas — masas, cargas, fuerza de interacción e incertidumbre cuántica — se combinan para crear los átomos que existen en nuestro Universo.
Incluso si tuviéramos una contraparte estable y más pesada del electrón, o la capacidad de comprimir la materia a estados arbitrariamente densos, nos encontraríamos con un umbral cuántico donde los núcleos atómicos en los centros de los átomos se fusionarían espontáneamente, evitando que existieran configuraciones estables de múltiples átomos. El hecho de que nuestros átomos sean en su mayoría espacios vacíos permite la existencia de moléculas, química y vida.
Eliminar el espacio vacío de los átomos puede ser un divertido experimento mental, pero los átomos tienen el tamaño que tienen debido a las reglas del Universo. Nuestra existencia depende de que ese espacio vacío esté presente, pero con las constantes de la naturaleza teniendo los valores que tienen, no te preocupes. No puede ser de otra manera.