Química Bioorgánica y Orgánica
Reacción de hidroboración-oxidación
La adición cis de diborano a un enlace de alqueno proporciona un método extremadamente útil de hidratación. El diborano puede generarse mediante la adición de borohidruro de sodio al éter de trifluoruro de boro en tetrahidrofurano o éter a 0o-5oC. El diborano es el dímero del borano (BH3) y es la forma estable de este reactivo (Esquema 1).
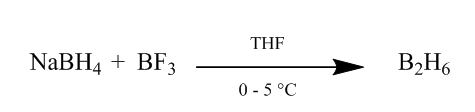
Figura 1 Obtención de Diborano a partir de borohidruro de sodio
La adición de diborano al alqueno es extremadamente rápida y, en general, el reactivo se agrega desde la menos obstaculizada de las dos caras del sistema π. La adición de cis ha sido racionalizada por un estado de transición de cuatro centros. El complejo de borano resultante de la adición de diborano a un alqueno se convierte, con retención de estereoquímica, en un alcohol mediante tratamiento con peróxido de hidrógeno básico. Así, el 1-metilciclohexeno 1 en la hidroboración-oxidación conduce a la formación de trans-2-metilciclo-hexanol 2. El camino mecanicista se ha descrito en (Esquema 2). El método para la conversión de alqueno en alcohol por hidroboración-oxidación se ha aplicado para la síntesis de muchos productos naturales. A continuación se ilustran algunos ejemplos.

Figura 2 Mecanismo de reacción para la formación de trans-2-metilciclo-hexanol 2
Síntesis de ( ± ) junenol y ( ± ) acalomona
El uso de reacción de hidroboración-oxidación fue observado por Banerjee y compañeros de trabajo durante la sintesis3 de sesquiterpenos de eudesmona (±) junenol y (±) acalomona. Para lograr la síntesis de estos sesquiterpenos, se seleccionó el alqueno 3 como material de partida y se sometió a hidroboración-oxidación para producir el alcohol 4 (Esquema 3). La cetona 5, obtenida por la oxidación del alcohol con reactivo Jones 4, reaccionó con carbonato de dietilo. El producto resultante se trató con metil litio para obtener el cetol 6 cuya conversión a isopropilcetona 7 se efectuó por deshidratación e hidrogenación, respectivamente. La reducción de la cetona con hidruro metálico seguida de oxidación con tetraacetato de plomo 5 en el ciclohexano produjo el éter cíclico 8, que se convirtió en cetoácido 9 por oxidación con ácido crómico y ácido acético. Descarboxilación con tetraacetato de plomo en benceno y piridina, seguida de purificación en gel de sílice impregnado con AgNO3 al 10%, con (±) acolamona 10. La reducción de la acolamona 10 con borohidruro de sodio en metanol, seguida de la sublimación del producto resultante, produjo junenol 11.
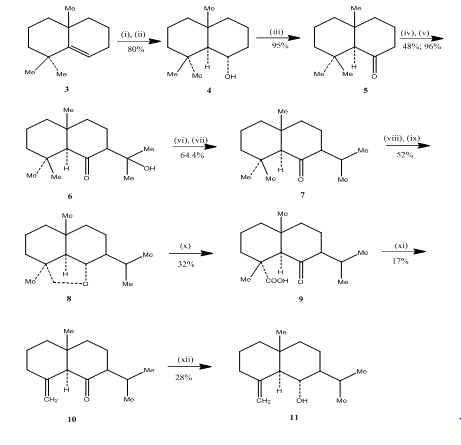
Figura 3 Síntesis de sesquiterpenos de eudesmona (±) junenol y (±)-acalomona
Reactivos: i) BF3.Et2O, NaBH4, THF, 0-5°C; ii) NaOH (10%), H2O2 (30%); iii) CrO3/HMPT; iv) NaH, CO (OEt)2, DME; v) MeLi, Et2O, reflujo, 2h; vi) HCl(conc), MeOH; (vii) H2, PtO2, MeOH; viii) Na, EtOH, reflujo; ix)Pb (OAc) 4, C6H12; x) CrO3, AcOH; xi)Pb(OAc) 4, C6H6, Py, reflujo; xii) NaBH4, EtOH.
Síntesis de ácido pisiferico
El uso de hidroboración-oxidación se ha registrado durante la síntesis de ácido pisiferico,6 un diterpeno tricíclico que muestra actividades antibacterianas contra todas las bacterias gram positivas probadas.7 La ruta sintética se ha representado en el Esquema 4. Hidroboración-oxidación del alqueno 13, preparado a partir del conocido cetoalcohol 128, se oxidó con reactivo jones 4 y se redujo, respectivamente, con hidruro metálico para dar alcohol 14. La oxidación con tetraacetato de plomo en benceno con lámpara de tungsteno de 250W dio al éter cíclico 15. La escisión del éter cíclico con zinc, yoduro de zinc y ácido acético 8 proporcionó pisiferol 16. La transformación del pisiferol al éster 17 se logró en seis pasos:
- Metilación con sulfato de dimetilo
- Oxidación con reactivo jones
- Esterificación con diazometano
- Reducción con borohidruro de sodio
- Tosilación
- Detosilación
El éster l7 se convirtió en ácido pisiferico 18 calentándose con bromuro de aluminio y etano tiol.
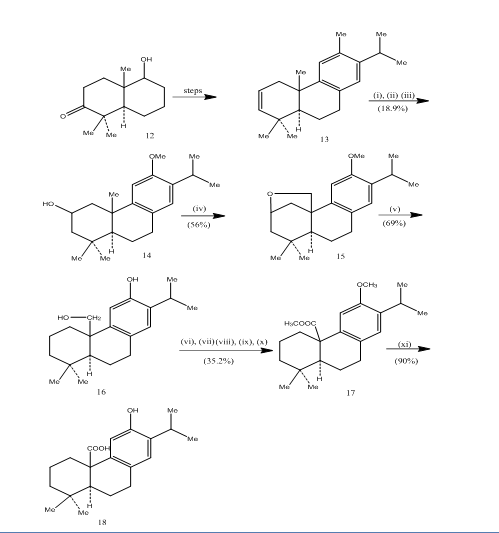
Figura 4 Síntesis de reactivos de ácido pisiferico 18
: i) BF3.Et2O, NaBH4; ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; iii) LiAlH4, THF; iv) Lámpara de tungsteno Pb (OAc)4, CaCO3, C6H6, 250w; v) Zn, ZnI, MeCOOH; vi) MeSO4, Me2CO; vii) H2SO4-HCrO4; viii) CH2N2, Et2O; ix) NaBH4, MeOH; x) TsCl, Py; xi) NaI, polvo Zn, DMF; xii)AlBr3, (CH2SH) 2.
La reacción de hidroboración-oxidación se ha aplicado para la síntesis de ( ± ) eudes-4(14),7(11)-dieno-8-one, 9 taxodiona, 10 alcoholes norditerpenos11 y muchos otros terpenos.12 Estos ejemplos indican claramente el uso del éter de tifluoruro de boro en la conversión de los alquenos en alcoholes y, posteriormente, en sus transformaciones en compuestos terpenoides.
Escisión de epóxidos
Los epóxidos puede ser escindida por varios reactivos. El etérico de borontrifluoruro de ácido de Lewis también se ha utilizado para la escisión de epóxidos y, en muchos casos, el producto resultante se reorganiza en cetona. La escisión de los epóxidos también se acompaña de ciclización. En esta revisión se ha discutido la escisión de algunos epóxidos con trifluoruro de boro eterato y el uso de los productos resultantes en la síntesis de productos naturales.
Síntesis de 6-metoxi-2-tetralona
La escisión de epóxido con éter de trifluoruro de boro se ha utilizado13 para la síntesis de 6-metoxi-2-tetralona 20 (Esquema 5), un importante material de partida seleccionado para la síntesis de muchos compuestos orgánicos. La epoxidación del alqueno13 19 seguida del tratamiento del producto bruto en diclorometano con trifluoruro de boro permitió obtener la tetralona 20 en un rendimiento del 36%. Cuando se probó la escisión con ácido sulfúrico, se mejoró el rendimiento de la teralona 20 (39%) junto con la formación de otros productos secundarios y, por lo tanto, la purificación cromatográfica fue muy laboriosa.
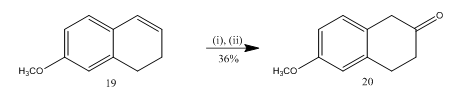
Figura 5 Síntesis de reactivos 6-metoxi-2-tetralona 20
: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
Síntesis de cuprano
El reordenamiento de los epóxidos por el trifluoruro de boro etérico demostró ser muy útil durante la síntesis de cuprano sesquiterpénico 14. La ruta sintética se describe en el esquema 6. el 6,6-dimetil-1-p-tolilciclohexeno 21 en la epoxidación produjo el epóxido 22 en buen rendimiento, que en el tratamiento con trifluoruro de boro éter en benceno produjo el aldehído 23 en bajo rendimiento. La semicarbazona del aldehído se calentó con hidróxido de potasio para proporcionar el sesquiterpeno cuprane 24 en un rendimiento aceptable. La síntesis es atractiva debido a su brevedad en los pasos. Las condiciones utilizadas para el reordenamiento del epóxido 22 son críticas porque tiene la tendencia a sufrir un reordenamiento adicional a la cetona 25.
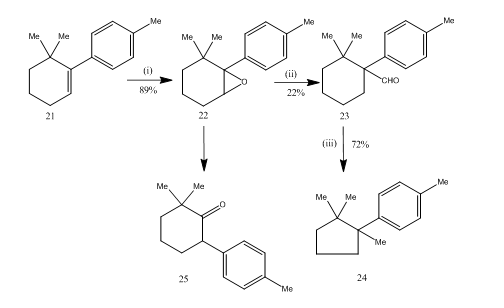
Figura 6 Síntesis de reactivos cuprane
: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
La síntesis de ( ± ) éter de karahana
El trifluoruro de boro también se utilizó para la escisión del epóxido durante la sintesis15 del éter de karahana, un monoterpeno volátil que se aisló16 del lúpulo japonés. La ruta sintética se describe en el esquema 7. El epóxido 27, obtenido a partir del dieno 26, al ser tratado con trifluoruro de boro, se sometió a una ciclización que dio como resultado el producto 28. La ciclización probablemente ocurrió a través del intermedio 27 (i). La reducción de hidruros metálicos proporcionó diol que en la tosilación produjo éter de karahan 29. El rendimiento no está especificado. La escisión de los epóxidos se ha utilizado para la síntesis de muchos terpenos como rosenolactona,17 ciperolona,18 maritimol.19
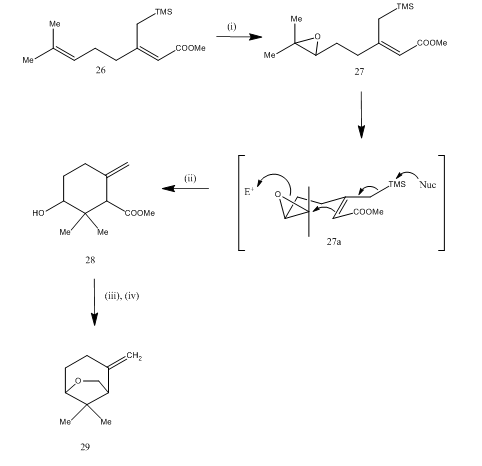
Figura 7 Síntesis de reactivos (±) éter Karahana
: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
Esterificación
La esterificación es una reacción de uso frecuente para la síntesis de muchos compuestos orgánicos. El trifluoruro de boro etérico –alcohol es un reactivo muy conveniente para la esterificación de muchos ácidos p-amino benzoicos, aromáticos, heterocíclicos e insaturados.20 En algunas reacciones de esterificación, el uso de este reactivo proporcionó un rendimiento superior en comparación con otros reactivos. En el esquema 8 se dan algunos ejemplos. Los ácidos 30-32 se convirtieron a los ésteres 33-35 respectivamente en alto rendimiento en el tratamiento con reactivo de alcohol etérico trifluoruro de boro. Marshall y sus colaboradores21 utilizaron el mismo reactivo para la esterificación de ácidos carboxílicos. Dymicky22 preparó varios formatos de alto rendimiento a partir de ácido fórmico y alcohol en presencia de una cantidad catalítica de complejo trifluoruro de boro y metanol. Los otros catalizadores, por ejemplo, el ácido sulfúrico, el ácido p-tolueno sulfónico no era tan eficiente como el complejo trifluoruro de boro y metanol.
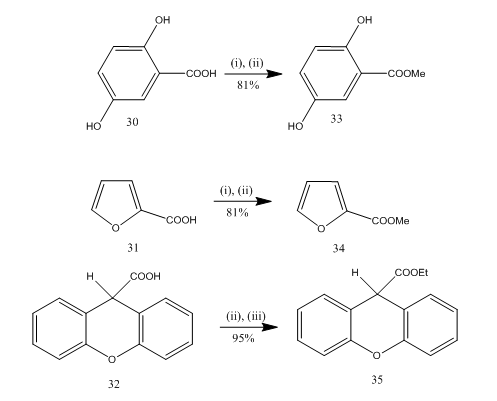
Figura 8 Esterificación de ácidos 32-35
Reactivos: i) MeOH; ii) BF3.Et2O; iii) EtOH
Jackson y sus colaboradores23 han desarrollado un método eficiente para la conversión de alcoholes 37-39 y ácidos 40-42 directamente a los derivados t-butilo correspondientes con buen rendimiento utilizando tricloroacetimidato de t-butilo 36 en presencia de una cantidad catalítica de trifluoruro de boro eterato como se muestra en el Esquema 9. Este método funciona mejor con los grupos sensibles a los ácidos que los métodos tradicionales que utilizan isobuteno. El grupo hidroxilo de un diol menos obstaculizado se puede proteger y también es susceptible de trabajo a pequeña escala (evitando el manejo de isobuteno gaseoso). El 2,2,2-tricloroacetimidato de t-butilo 36 se prepara fácilmente mediante la adición de t-butanol al tricloroacetonitrilo. La mayoría de los experimentos se llevaron a cabo en presencia de una mezcla de diclorometano y ciclohexano. El anhídrido acético en presencia de éter de trifluoruro de boro se ha utilizado para la acetilación del grupo hidroxilo.24

Figura 9 Conversión de alcoholes y ácidos a partir de derivados t-butilo.
Reactivos: 36, i) BF3.Et2O, ii) CH2Cl2, C6H12
Ciclización
El éter de trifluoruro de boro ha desempeñado un papel importante en la ciclización de muchos ácidos carboxílicos, alenos, etc. Los siguientes ejemplos ilustrarán el papel del trifluoruro de boro como agente ciclizante. El cloruro ácido 49 y el alqueno 50 se condensaron para producir divinilcetona 25 51 que se sometió a la ciclización nazarov26,27 suministrando cetona cíclica 52 que se convirtió en el sesquiterpeno tricodieno 53 (Esquema 10).
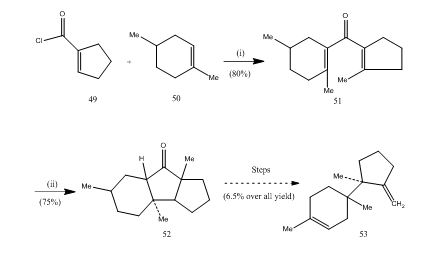
Figura 10 Síntesis de reactivos sesquiterpénicos tricodieno 53
: (i) SnCl4, NaOMe; (ii) BF3Et2O
Varias cetonas alenilaril se someten a ciclización con trifluoruro de boro eterato que proporciona metilen benzociclopentenona a través de una nueva ciclización en modo 5 endo.28 Las cetonas 54-56 proporcionaron benzociclopentenonas 57-59 respectivamente (Esquema 11). Probablemente la transformación ocurrió como se muestra en la ciclización de alenil aril cetona 54 a 57. Se puede observar que la presencia de grupos sustituyentes en el anillo aromático determina el rendimiento del producto ciclizado. Kos y Loewenthal28 informaron de la ciclización del ácido 60 con trifluoruro de boro eterato a la cetona 61, que se convirtió en giberona 62 (Esquema 12) en tres pasos:
- Cetalización
- Reducción de Huang-Minlon e hidrólisis ácida
- . Los ejemplos mencionados anteriormente muestran el uso de trifluoruro de boro eterato en la ciclización de compuestos orgánicos
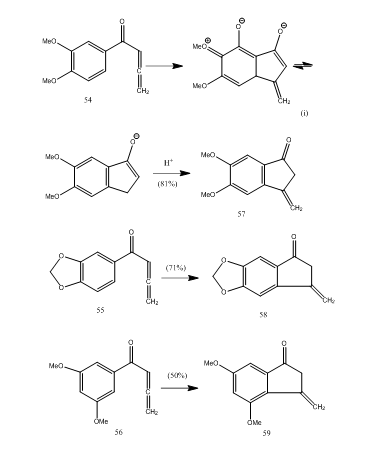
Figura 11 Síntesis de Ciclopentenonas

Figura 12 Síntesis de reactivos de giberona
: i) BF3. Et2O; ii) a) C2H6O2; b) DEG, N2H4, KOH, 190-200°C; C) H+