18.6: Epoksidien reaktiot: Ring-opening
Epoksidien ring-opening reactions-SN1 vs. SN2, regioselectivity ja stereoselectivity
epoksidien nonentsymaattiset ring-opening reactions-reaktiot tarjoavat mukavan yleiskuvan monista käsitteistä, joita olemme jo nähneet tässä luvussa. Rengasaukeamisreaktiot voivat edetä joko SN2-tai SN1-mekanismeilla riippuen epoksidin luonteesta ja reaktio-olosuhteista. Jos epoksidi on epäsymmetrinen, tuotteen rakenne vaihtelee sen mukaan, mikä mekanismi hallitsee. Kun asymmetrinen epoksidi käy solvolyysin läpi emäksisessä metanolissa, rengas avautuu SN2-mekanismilla, ja vähemmän substituoitu hiili on nukleofiilisen hyökkäyksen kohde, mikä johtaa siihen, mitä kutsumme tuotteeksi B:

vastaavasti, kun solvolyysiä tapahtuu happamassa metanolissa, reaktio tapahtuu mekanismilla, jolla on huomattava SN1-luonne, ja mitä substituoituneempi hiili on hyökkäyskohtana. Tämän seurauksena tuote A on vallitseva.

nämä molemmat ovat hyviä esimerkkejä regioselektiivisistä reaktioista. Regioselektiivisessä reaktiossa kaksi (tai useampia) erilaista perustuslaillista isomeeriä ovat mahdollisia tuotteina, mutta yksi muodostuu preferentiaalisesti (tai joskus yksinomaan).
Tarkastellaanpa ensin perusasiaa SN2. Lähtevä ryhmä on alkoksidianioni, koska happoa ei ole saatavilla protonoimaan happea ennen renkaan avautumista. Alkoksidi on huono lähtevä ryhmä, joten rengas ei todennäköisesti avaudu ilman nukleofiilin ”työntöä”.
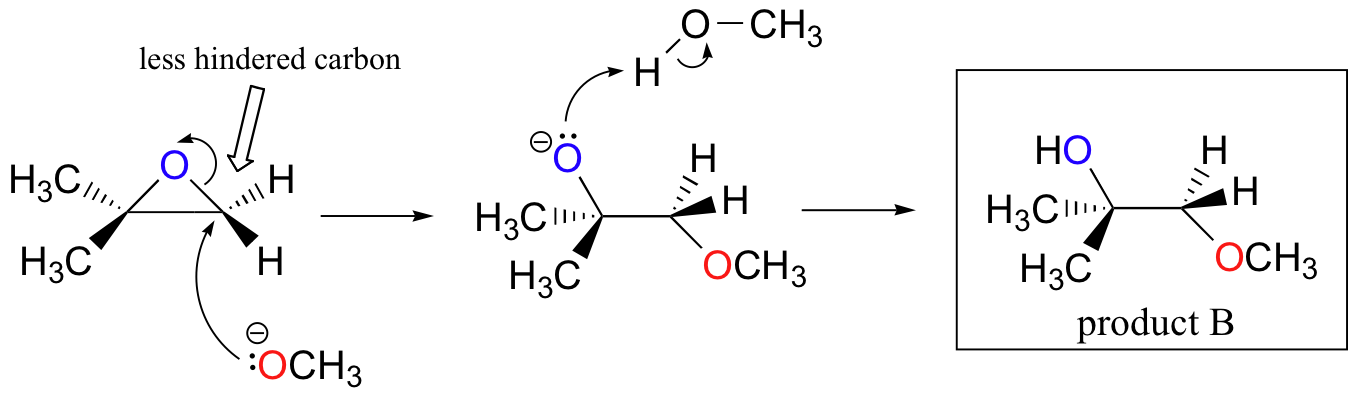
nukleofiili itsessään on voimakas: deprotonoitunut, negatiivisesti varautunut metoksidi-ioni. Kun nukleofiilisessa substituutioreaktiossa on mukana huono lähtevä ryhmä ja voimakas nukleofiili, se etenee hyvin todennäköisesti SN2-mekanismilla.
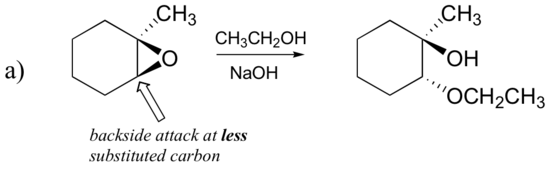
entä elektrofiili? Epoksidissa on kaksi elektrofiilista hiiltä, mutta nukleofiilin paras kohde SN2-reaktiossa on hiili, joka on vähiten estynyt. Tämä selittää havaitun regiokemiallisen tuloksen. Kuten muissakin SN2-reaktioissa, nukleofiilinen hyökkäys tapahtuu takapuolelta, jolloin elektrofiilisen hiilen kohdalla tapahtuu inversio.
luultavasti paras tapa kuvata happokatalysoitu epoksirenkaan avautumisreaktio on SN2: n ja SN1: n mekanismin hybridinä eli risteytyksenä. Ensin happi protonoituu, jolloin syntyy hyvä lähtijäryhmä (Vaihe 1 alla) . Sitten hiili-happi-sidos alkaa murtua (Vaihe 2) ja positiivinen varaus alkaa kerääntyä substituoidummalle hiilelle (muista 8.4 B kohdan keskustelu karbokationin stabiilisuudesta).

toisin kuin SN1-reaktiossa, nukleofiili hyökkää elektrofiilisen hiilen kimppuun (Vaihe 3) ennen kuin täydellinen karbokationiväli ehtii muodostua.
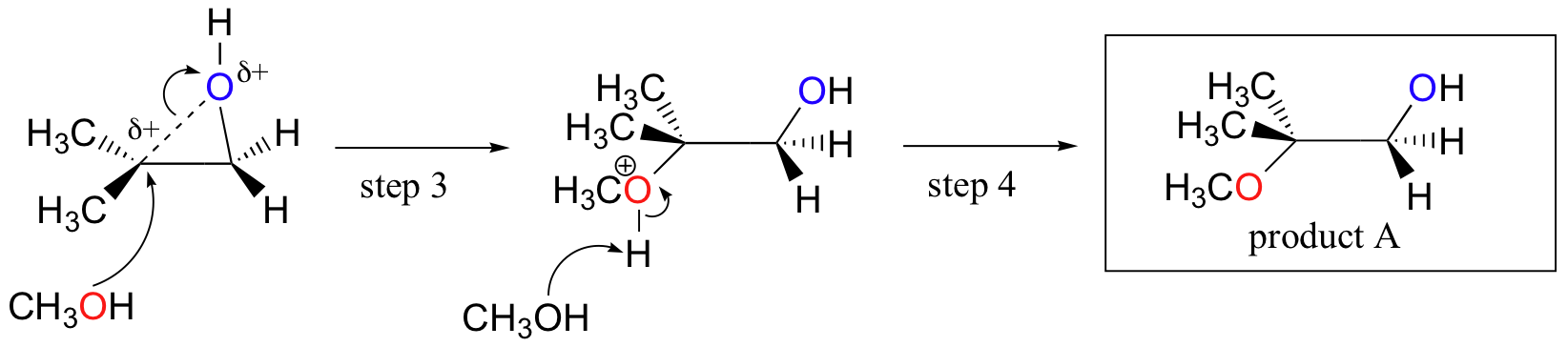
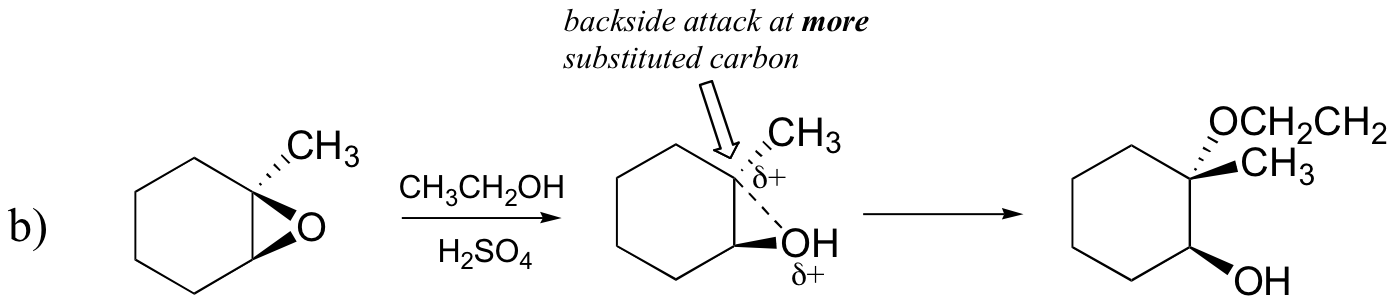
hyökkäys tapahtuu mieluiten takapuolelta (kuten SN2-reaktiossa), koska hiili-happi-sidos on vielä jossain määrin paikallaan ja happi estää hyökkäyksen etupuolelta. Huomaa kuitenkin, miten regiokemiallinen tulos eroaa emäskatalysoidusta reaktiosta: happokatalysoidussa prosessissa nukleofiili hyökkää enemmän substituoitua hiiltä vastaan, koska juuri tällä hiilellä on suurempi positiivinen varaus.
esimerkki 18.6.1
ennusta renkaan avautumisreaktion päätuote(Päätuotteet), joka tapahtuu, kun alla olevaa epoksidia käsitellään:
- etanoli ja pieni määrä natriumhydroksidia
- etanolia ja pieni määrä rikkihappoa
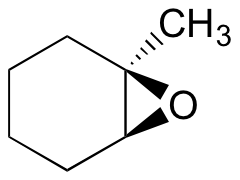
vinkki: muista harkita sekä regiokemiaa että stereokemiaa!
vastaus