ATrain Education
vaikka opimme päivittäin lisää Parkinsonin taudin patofysiologiasta, sitä pidetään edelleen suurelta osin idiopaattisena (tuntemattomasta syystä). Siihen liittyy todennäköisesti isäntäalttiuden ja ympäristötekijöiden yhteisvaikutus. Pieni osa tapauksista liittyy geneettisesti toisiinsa ja geneettisiä tekijöitä tutkitaan intensiivisesti.
fysiologisesti Parkinsonin tautiin liittyvät oireet johtuvat useiden välittäjäaineiden, erityisesti dopamiinin, häviämisestä. Oireet pahenevat ajan myötä, kun yhä useampi sairauteen sairastuneista soluista katoaa. Taudin kulku vaihtelee suuresti, ja joillakin potilailla on hyvin vähän oireita ikääntyessään ja toisilla oireet etenevät nopeasti.
Parkinsonin tauti nähdään yhä useammin monimutkaisena hermorappeumasairautena,jonka eteneminen etenee. On olemassa vahvoja todisteita siitä, että se vaikuttaa ensin vagushermon selkämoottoriytimeen ja hajulampuihin ja tumaan, sitten locus coeruleukseen ja lopulta substantia nigraan. Aivojen aivokuoren alueet vaikuttavat myöhemmässä vaiheessa. Näiden eri hermojärjestelmien vaurioituminen selittää monitahoiset patofysiologiset muutokset, jotka heikentävät motorisen järjestelmän lisäksi kognitiivisia ja neuropsykologisia järjestelmiä (Kwan & Whitehill, 2011).
dopamiinin rooli
dopamiini, kuten muutkin välittäjäaineet, välittää kemiallisia viestejä hermosolusta toiseen synapsissa, presynaptisen solun ja postsynaptisen reseptorin välisessä tilassa. Dopamiinia erittyy synapsiin presynaptisen kalvon kalvorakkuloista. Se läpäisee synapsin ja sitoutuu postsynaptiseen kalvoon, jossa se aktivoi dopamiinireseptoreita. Synapsiin jäänyt käyttämätön dopamiini imeytyy takaisin presynaptiseen soluun; presynaptiseen soluun palattuaan ylimääräinen dopamiini pakataan uudelleen varastorakkuloiksi ja vapautuu jälleen synapsiin.
synapsissa dopamiinin kulkeutuessa solusta toiseen kaksi entsyymiä, MAO (monoamiinioksidaasi) ja COMT (katekoli-O-metyylitransferaasi), voivat hajottaa sen ja tehdä sen inaktiiviseksi. Eräässä terapeuttisessa strategiassa synapsiin tuodaan Mao-inhibiittori, joka keskeyttää MAO-entsyymin toiminnan ja estää dopamiinin hajoamisen. Tämä mahdollistaa enemmän dopamiinia jäädä synapsiin ja lisää todennäköisyyttä, että se sitoutuu postsynaptiseen kalvoon.
Kemiallinen synaptinen transmissio
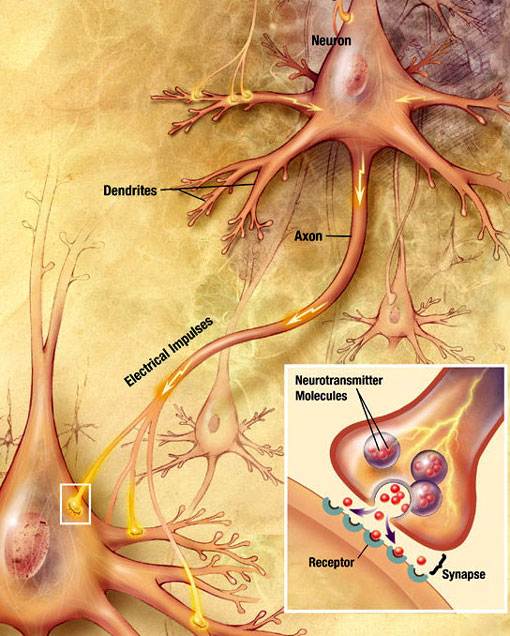
sähkökemiallinen aalto, jota kutsutaan aktiopotentiaaliksi, kulkee neuronin aksonia pitkin. Kun vaikutuspotentiaali saavuttaa presynaptisen terminaalin, se aiheuttaa pienen määrän välittäjäainemolekyylejä, jotka sitoutuvat kemiallisiin reseptorimolekyyleihin, jotka sijaitsevat postsynaptisen hermosolun kalvossa synaptisen halkeaman vastakkaisella puolella. Lähde: Wikimedia Commons.
dopamiinin asteittainen häviäminen
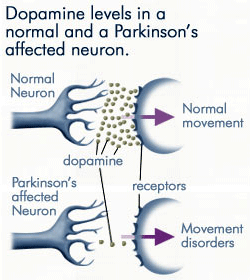
koska Parkinsonin taudin vaikutuspiirissä olevat hermosolut tuottavat yhä vähemmän dopamiinia, paljon vähemmän dopamiinia on saatavilla sitoutumaan postsynaptisen kalvon dopamiinireseptoreihin. Lähde: anti-agingfirewalls.com.
vaikka dopamiinisolujen häviämistä ei voida mitata suoraan, mittaukset neurologisesti normaaleilla ihmisillä ja kädellisillä paljastavat hitaasti etenevän dopamiinin häviämisen iän myötä. Parkinsonin taudissa menetys tapahtuu paljon nopeammin ja sekä biokemialliset toimenpiteet että kuvantamistutkimukset viittaavat siihen, että dopamiini vähenee merkittävästi motoristen oireiden ilmaantuessa. Tämän näkemyksen mukaan Parkinsonin tauti on nopeutettu versio solukuolemasta, joka nähdään normaalin ikääntymisen myötä (Cookson, 2009). Tämä käy ilmi alla olevasta graafista, joka näyttää dopaminergisten neuronien laskun normaalin ikääntymisen aikana, idiopaattisessa PD: ssä, ympäristö-tai perintötekijöiden aiheuttamassa PD: ssä ja varhain alkavassa PD: ssä.
Dopamiinivajeen kehittyminen Parkinsonin taudissa
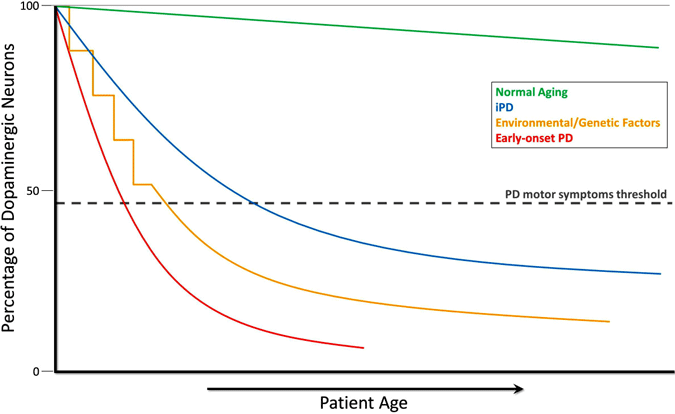
normaalin ikääntymisen aikana (vihreä viiva) esiintyy pientä mutta hidasta dopaminergistä degeneraatiota ilman motorisia oireita. Idiopaattisen PD: n (IPD, sininen viiva) alkuperää ei tunneta, mutta sen uskotaan kehittyvän vähitellen, ja dopaminergisten neuronien hidas rappeutuminen johtaa klassisiin PD-motorisiin oireisiin myöhemmin elämässä. Toinen dopamiinineurodegeneraatiomalli, joka johtaa PD-motorisiin oireisiin, sisältää toistuvan altistuksen ympäristön toksisille aineille ajan myötä yhdistettynä geneettiseen taipumukseen dopaminergisen neuronin menetykseen (keltainen viiva). Varhain alkava PD (red line), joka johtuu mutaatioista PARKIN geeni, liittyy äkillinen lasku dopaminergisten neuronien, ja PD motoriset oireet voivat esittää vuosikymmeniä ennen kuin idiopaattinen PD. Vielä yksi skenaario (ei esitetty) PD motoristen oireiden kehittymisestä liittyy mahdolliseen kohdussa ympäristöön toksisiin aineisiin tai geneettisiin tekijöihin, jotka johtavat atypisesti alhaiseen dopaminergisten neuronien määrään syntyessään ja lisääntyneeseen alttiuteen PD: n kehittymiselle (Haas et al., 2012).
dopamiinineuronien rappeutuminen on erityisen ilmeistä Pars compacta-nimisessä substantia nigran osassa. Merkittävästi, dopamiinin menetys pars compacta lisää yleistä excitatory drive tyvitumakkeessa, * häiritsee vapaaehtoista motorista valvontaa ja aiheuttaa tyypillisiä oireita PD. Motorisen toiminnan normalisoituminen nähdään aluksi levodopahoidolla (Gasparini et al., 2013).
* tyvitumakkeen pääkomponentit ovat striatum (caudate tuma ja putamen), globus pallidus, substantia nigra, nucleus accumbens ja subtalaami Tuma.
PD: n vaikeusasteen kasvaessa dopamiinin loppuminen johtaa uusiin muutoksiin tyvitumakkeissa, mukaan lukien muiden tyvitumakkeiden välittäjäaineiden kuten glutamaatin, GABA: n ja serotoniinin toiminnan muutokset (Gasparini et al., 2013). Vaikka substantian nigrassa on suhteellista alttiutta dopamiinia tuottaville neuroneille, Parkinsonin tauti ei vaikuta kaikkiin dopamiinisoluihin; joissakin aivojen osissa dopamiinia tuottavat neuronit säästyvät suhteellisen paljon (Cookson, 2009).
Nigrostriataalireitti
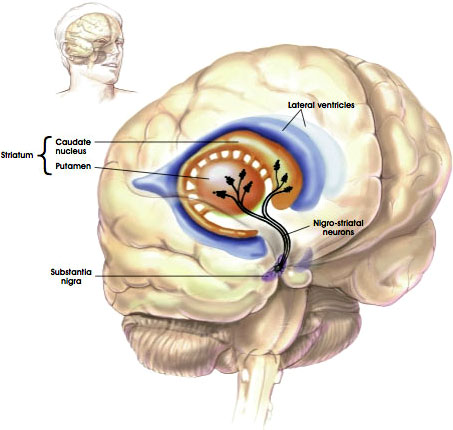
lähde: NIH, n. d.
Lewyn kappale ja Alfasynukleiini
Lewyn kappale ovat Parkinsonin tautia sairastavilla poikkeavia hermosolujen sisällä kehittyvien proteiinien aggregaatteja ja sulkeumia. Aggregaatit koostuvat yleensä liukenemattomista fibrillaarisista aggregaateista, jotka sisältävät väärin sekoittuneita proteiineja. Lewyn kappaleista on tunnistettu suuri määrä molekyylejä, mutta pääkomponenttina on alfa-synukleiini-niminen proteiini.
Lewyn kappaleet (Alfasynukleiinisulkeumat)
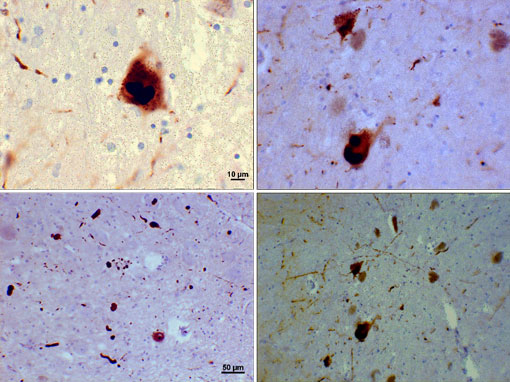
Memorial nigra-alueen Fotomikrografi Parkinson-potilaalla, jossa Lewyn kappale ja Lewyn neuriitti näkyvät erilaisina suurennoksina. Yläpaneeleissa on 60-kertainen suurennos alfasynukleiinin intraneuronaalisesta sulkeumasta, joka on yhdistetty Lewyn kappaleiksi. Alapaneelit ovat 20× suurennuskuvia, joissa on nauhamaisia Lewyn neuriitteja ja erikokoisia pyöristettyjä Lewyn kappaleita. Kuvia Suraj Rajan.
Lewyn patologia käsittää monia aivojen alueita, ja joidenkin raporttien mukaan substantia nigra ei ole ensimmäinen paikka, jossa Lewyn kappaleita muodostuu Parkinsonin taudissa. Sulkeumat ja aggregaatit symboloivat todennäköisesti monimutkaisten tapahtumien kaskadin loppuvaihetta. Varhaisempi vaihe voi olla suoremmin sidoksissa häiriön patogeneesiin kuin itse sulkeumat, jotka voivat tai eivät voi edustaa diagnostisia tunnusmerkkejä.
Lewyn kappale esiintyy myös ”Lewyn kappale-dementiassa”, mikä viittaa siihen, että nämä tilat liittyvät toisiinsa jaetun patologian ja mahdollisesti yhteisen etiologian kautta. Solujen häviäminen tai Lewyn kappaleiden muodostuminen ei ole ehdottoman spesifistä PD: lle, mutta molempia tarvitaan PD: n diagnosointiin nykyisten määritelmien mukaisesti (Cookson, 2009).
Neurodegeneratiivisilla sairauksilla, kuten Alzheimerin taudilla, frontaalisella ja temporaalisella degeneraatiolla, prionitaudilla, Huntingtonin Korealla ja motoneuron-taudeilla, on yhä useammin yhteisiä solu-ja molekyylimekanismeja, mukaan lukien proteiinin aggregaatio ja inkluusiorungon muodostuminen tietyillä hermoston alueilla (Jellinger, 2011).
tulehdus ja immuunivaste
dopaminergisen rappeuman laukaisevilla tekijöillä näyttää olevan useita tekijöitä, joihin vaikuttavat sekä endogeeniset että ympäristöön liittyvät tekijät. Tulehdus-ja immuunivasteita pidetään yhä useammin dopaminergisen rappeuman tärkeinä välittäjinä. Suuret väestötutkimukset ovat osoittaneet, että steroideihin kuulumattomia tulehduskipulääkkeitä (NSAID) käyttävillä henkilöillä on pienempi riski sairastua idiopaattiseen PD: hen, mikä viittaa siihen, että tulehduskipulääkkeet voivat olla lupaava tautia muokkaava hoito parkinsonialaisille potilaille (Barcia, 2013).
uusissa tutkimusvaiheissa on ollut mukana tulehdusta ehkäiseviä hoitoja-erityisesti objektiivisen biomarkkerin etsimistä hoidoissa, joilla pyritään vähentämään PD—potilaiden tulehdusmuutoksia. Tutkijat kehittävät neuroimaging-työkaluilla relevanttia biomarkkeria tarkoituksenaan testata tätä suurissa kliinisissä kuvantamistutkimuksissa. Näiden tutkimusten tulokset antavat tietoa PD: n anti-inflammatoristen hoitojen testaamiseksi ja seuraamiseksi ja auttavat tunnistamaan oikea-aikaisen terapeuttisen ikkunan lopettamiseksi tai ainakin hitaaksi tulehdusvälitteiseksi dopaminergiseksi rappeumaksi (Barcia, 2013).
parkinsonismi
parkinsonismi, tunnetaan myös nimillä ”epätyypillinen Parkinsonin tauti”, ”sekundaarinen Parkinsonin tauti” tai ”Parkinsonin oireyhtymä”, on neurologinen oireyhtymä, jossa potilaalla esiintyy joitakin Parkinsonin tautiin liittyviä oireita—vapinaa, jäykkyyttä, bradykinesiaa ja posturaalista epävakautta. Parkinsonismi ei kuitenkaan ole Parkinsonin tauti. Parkinsonismin ei uskota johtuvan Parkinsonin taudista, ja farmakologiset toimenpiteet tehoavat potilaisiin tyypillisesti huonosti. Parkinsonismilla on usein tunnistettava syy, kuten altistuminen myrkyille, metamfetamiini, trauma, useat halvaukset, muut hermoston häiriöt tai sairaus. Yleensä Lewyn kappaleita ei parkinsonismissa nähdä.
termi parkinsonismi liittyy myös häiriöihin, kuten etenevään supranukleaariseen halvaukseen, monijärjestelmän atrofiaan, Lewyn kappale-dementiaan, kortikobasaalirappeumaan, verisuonten parkinsonismiin, lääkkeiden aiheuttamaan parkinsonismiin ja infektiosta ja muista syistä johtuvaan parkinsonismiin (Hohler et al., 2012). Reversiibeliä parkinsonismia voi esiintyä tiettyjen neuroleptisten lääkkeiden, erityisesti reserpiinin, psykoosilääkkeiden (haloperidoli) ja metoklopramidin, käytön seurauksena. Altistuminen tietyille myrkyille, vakava häkämyrkytys ja elohopeamyrkytys voivat myös johtaa parkinsonismiin.
parkinsonismin oireiden ilmaantuminen 1980-luvun alussa huumeriippuvaisten ryhmässä, joka oli käyttänyt saastunutta synteettistä opiaattierää, johti siihen, että kemikaali MPTP löydettiin aineena, joka aiheuttaa parkinsonismin oireyhtymää kädellisillä ja ihmisillä. MPTP: tä voidaan valmistaa valmistettaessa eräänlaista heroiinia (MPTP muuttuu neurotoksiiniksi, joka tuhoaa selektiivisesti dopamiinisoluja substantia nigrassa). Tapaukset ovat harvinaisia, ja ne ovat koskeneet lähinnä pitkäaikaisia huumeidenkäyttäjiä.
metamfetamiinin väärinkäyttö on yhdistetty myös parkinsonismiin. Koe-eläimillä metamfetamiinille altistuminen vaurioittaa dopaminergisiä kuituja striatumissa* sekä substantia nigran soluelimissä, mikä heijastaa PD-potilailla havaittua rappeutumista. Striatumin dopaminergisten terminaalien selektiivisiä vaurioita on havaittu myös ihmisen metamfetamiinin käyttäjillä, vaikka toistaiseksi ei ole näyttöä siitä, että metamfetamiinin väärinkäyttö vahingoittaisi dopaminergisiä soluelimiä substantia nigrassa (Granado et al., 2013).
*tyvitumakkeen suurin Tuma, striatum koostuu tyvitumakkeesta ja putamenista.
on arveltu, että metamfetamiinin käyttö saattaa altistaa käyttäjiä PD: n tulevalle kehittymiselle. Tätä hypoteesia tukevat viimeaikaiset epidemiologiset tutkimukset, joiden mukaan metamfetamiinin käyttäjillä on suurentunut riski sairastua PD: hen. Tämä vastaa metamfetamiinin pysyviä neurotoksisia vaikutuksia koe-eläimissä (Granado et al., 2013).
parkinsonismia sairastavia potilaita on usein vaikea hoitaa avohoitopotilaina. Monimutkaisuus niiden oireita, lisätty kognitiivinen ja autonominen vaje, huono vastaus useimmat PD lääkitys, ja suhteellisen nopea lasku tilan osaltaan haasteita hallita näitä potilaita, erityisesti sairauden edetessä (Hohler et al., 2012).