Bioorgaaninen & Orgaaninen kemia
Hydroboraatio-hapetusreaktio
diboraanin CIS-lisäys alkeenisidokseen tarjoaa erittäin hyödyllisen hydrausmenetelmän. Diboraania voidaan valmistaa lisäämällä natriumborohydridiä booritrifluoridieteraattiin tetrahydrofuraanissa tai eetterissä 0o-5oC. Diboraani on boraanin (BH3) dimeeri ja stabiili muoto tästä reagenssista (Scheme1).
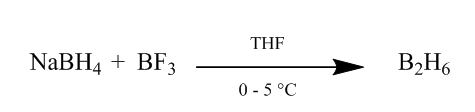
Kuva 1 natriumborohydridistä saatava Diboraani
diboraanin lisääminen alkeeniin on erittäin nopeaa ja yleensä reagenssi lisääntyy π-systeemin kahden Tahkon vähemmän esteisestä vaikutuksesta. Cis-lisäys on rationalisoitu neljän Keskuksen siirtymätilalla. Diboraanin lisäämisestä alkeeniin syntyvä boraanikompleksi muutetaan stereokemian säilyessä alkoholiksi käsittelemällä emäksistä vetyperoksidia. Näin 1-metyylisyklohekseeni 1 hydroboraatio-oksidaatiossa johtaa Trans-2-metyylisyklo-heksanoli 2: n muodostumiseen. Mekanistinen polku on kuvattu (Scheme 2). Menetelmää alkeenin muuttamiseksi alkoholiksi hydroboraatio-oksidaatiolla on sovellettu monien luonnontuotteiden synteesissä. Alla on muutamia esimerkkejä.

kuva 2 Reaktiomekanismi Trans-2-metyylisyklo-heksanolin muodostamiseksi 2
(±) junenolin ja (±) akalomonin synteesi
Banerjee ja työkaverit havaitsivat hydroboraatio-hapetusreaktion synteesissä3 eudesmoni-seskviterpeenit (±) junenoli ja (±) akalomoni. Näiden seskviterpeenien synteesin aikaansaamiseksi lähtöaineeksi valittiin alkeeni 3, joka alistettiin hydroboraatio-hapetukselle, jolloin saadaan alkoholi 4 (Scheme 3). Ketoni 5, jota saatiin hapettamalla alkoholia Jonesin reagenssilla 4, saatiin reagoimaan dietyylikarbonaatin kanssa. Saatu tuote käsiteltiin metyylilitiumilla, jolloin saatiin ketoli 6, jonka muuttuminen isopropyyliketoni 7: ksi tapahtui dehydraamalla ja hydraamalla vastaavasti. Metallihydridi pelkistää ketonin, jota seuraa hapetus lyijytetra-asetaatti5: llä sykloheksaanissa, jolloin syklinen eetteri 8 muuttui ketohapoksi 9 hapettamalla kromihapon ja etikkahapon kanssa. Dekarboksylointi lyijytetra-asetaatilla bentseenissä ja pyridiinissä, minkä jälkeen puhdistetaan yli 10% agno3-kyllästettyä silikageeliä, johon on lisätty (±) akolamonia 10. Akolamoni 10: n pelkistäminen natriumborohydridillä metanolissa, minkä jälkeen syntyneen tuotteen sublimointi tuotti junenoli 11: n.
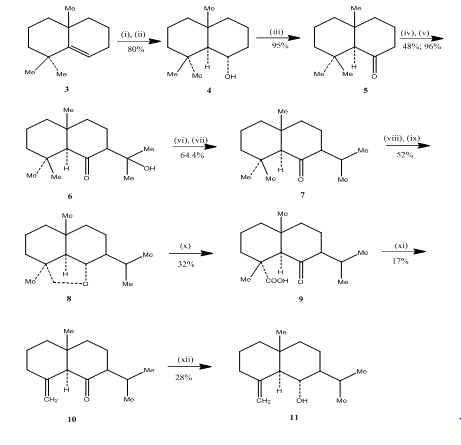
kuva 3 Eudesmonien seskviterpeenien (±) junenolin ja (±)-akalomonin synteesi
reagenssit: i) BF3.Et2O, NaBH4, THF, 0-5°C; ii) NaOH (10%), H2O2 (30%); iii) CrO3/Hmpt; iv) NaH, CO (OEt)2, DME; v) MeLi, Et2o, refluksi, 2h; vi) HCl(conc), meoh; (VII) H2, pto2, meoh; (viii) Na, EtOH, refluksi; (ix)Pb(OAc) 4, C6H12; (x) CrO3, AcOH; (xi)Pb(OAc) 4, C6H6, Py, refluksi; (xii) NaBH4, EtOH.
pisiferiinihapon synteesi
pisiferiinihapon,6 trisyklisen diterpeenin, synteesissä on havaittu hydroboraatio-hapetus, jolla on antibakteerinen vaikutus kaikkiin testattuihin grampositiivisiin bakteereihin.7 synteettinen reitti on kuvattu kaaviossa 4. Known8-ketoalkoholista 12 valmistettu alkeeni 13: n hydroboraatio-hapetus hapetettiin jones-reagenssilla4 ja pelkistettiin vastaavasti metallihydridillä, jolloin alkoholiksi saatiin 14. Hapetus lyijytetra-asetaatin kanssa bentseenissä 250w volframilampulla antoi sykliselle eetterille 15. Syklisen eetterin pilkkominen sinkillä, sinkkijodidilla ja etikkahapolla8 sai aikaan pisiferolin 16. Pisiferolin muuntuminen esteri 17: ksi tapahtui kuudessa vaiheessa:
- metylointi dimetyylisulfaatilla
- hapetus jones-reagenssilla
- esteröinti diatsometaanilla
- pelkistys natriumborohydridillä
- Tosylointi
- Detosylaatio
esteri L7 muunnettiin pisiferiaanihapoksi 18 kuumentamalla alumiinibromidin ja etaanitiolin kanssa.
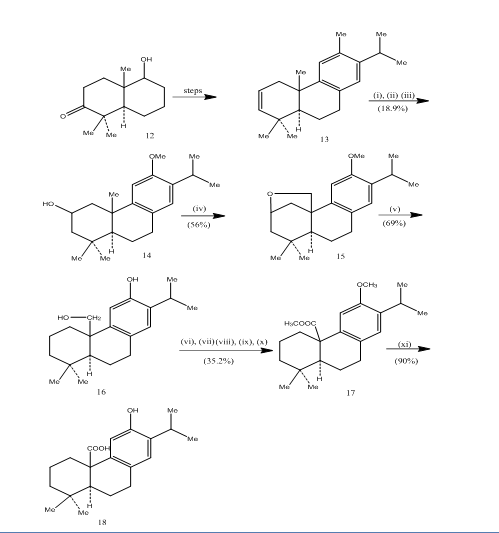
Kuva 4 pisiferiaanihapon 18 synteesi
reagenssit: i) BF3.Et2O, NaBH4; ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; iii) LiAlH4, THF; iv) Pb (OAc) 4, CaCO3, C6H6, 250w volframilamppu; v) Zn, ZnI, Mekooh; (vi) MeSO4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; ix) NaBH4, MeOH; (x) TsCl, Py; (xi) NaI, Zn dust, DMF; (xii)AlBr3, (CH2SH) 2.
hydroboraatio-hapetusreaktiota on käytetty (±) eudesin synteesissä-4(14),7(11)-dieeni-8-oni,9 taksodioni,10 norditerpeenialkoholia11 ja monia muita terpeenejä.12 nämä esimerkit osoittavat selvästi booritifluoridieteraatin käytön alkeenien muuntamisessa alkoholeiksi ja myöhemmin niiden muuntamisessa terpenoidiyhdisteiksi.
epoksidien pilkkominen
epoksidit voidaan halkaista useilla reagensseilla. Lewis-happoa booritrifluoridieteraattia on käytetty myös epoksidien pilkkomiseen ja monissa tapauksissa syntyvä tuote järjestyy uudelleen ketoniksi. Epoksidien pilkkoutumiseen liittyy myös syklisoituminen. Tässä tarkastelussa on käsitelty joidenkin epoksidien pilkkomista booritrifluoridieteraatilla ja syntyvien tuotteiden käyttöä luonnontuotteiden synteesissä.
6-Metoksi-2-tetralonin synteesi
epoksidin pilkkomista booritrifluoridieteraatin kanssa on hyödynnetty13 6-Metoksi-2-tetraloni 20: n (Scheme 5) synteesissä, joka on tärkeä valittu lähtöaine monien orgaanisten yhdisteiden synteesissä. Alkeeni13 19: n epoksidointi, jota seurasi raakatuotteen käsittely dikloorimetaanissa booritrifluoridieteraatilla, antoi tetraloni 20: lle 36 prosentin tuoton. Kun pilkkoutumista kokeiltiin rikkihapolla, teraloni 20: n saanto parani (39%) muiden sekundaarituotteiden muodostumisen ohella ja siten kromatografinen puhdistus oli hyvin työlästä.
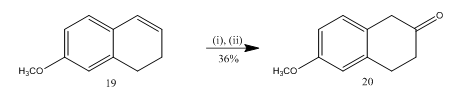
kuva 5 6-Metoksi-2-tetraloni 20: n synteesi
reagenssit: i) MCPBA, CH2Cl2; ii) BF3OEt2
kupraanin synteesi
epoksidien uudelleenjärjestely booritrifluoridieteraatilla osoittautui erittäin hyödylliseksi seskviterpeenikupraanin synteesissä14. Synteettinen reitti on kuvattu järjestelmässä 6. 6,6-dimetyyli-1-p-tolyylisyklohekseeni 21 antoi epoksidaatiossa hyvän tuoton epoksidi 22: lle, joka bentseenin booritrifluoridieteraatilla käsiteltäessä sai alhaisen tuoton aldehydi 23: lle. Aldehydin semikarbatsonia kuumennettiin kaliumhydroksidin kanssa, jolloin seskviterpeenikupraani 24 saatiin hyväksyttävällä tavalla. Synteesi on houkutteleva, koska sen lyhyys vaiheet. Epoksidi 22: n uudelleenjärjestäytymisessä käytetyt olosuhteet ovat kriittiset, koska sillä on taipumus uudelleenjärjestäytyä edelleen Ketoni 25: ksi.
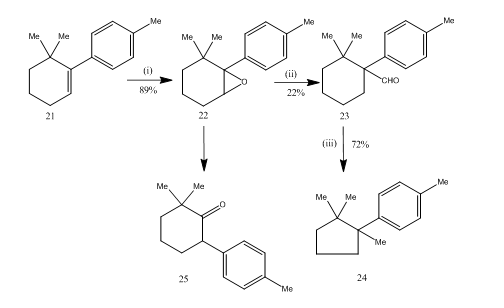
kuva 6 kupraanin synteesi
reagenssit: i) PhCO3H, CHCl3; ii) C6H6, BF3Et2O; iii) NH2NHCONH2, KOH
(±) karahana-eetterin synteesi
Booritrifluoridieteraattia käytettiin myös epoksidin pilkkomiseen syntetisoidessa15 karahana-eetteriä, haihtuvaa monoterpeeniä, joka eristettiin japanilaisesta humalasta 16. Synteettinen reitti on kuvattu kaavassa 7. Dieeni 26: sta saatava epoksidi 27, jota käsitellään booritrifluoridieteraatilla, syklisoidaan ja saadaan tuote 28. Syklisaatio tapahtui todennäköisesti välivaiheen 27 (i) kautta. Metallihydridi pelkisti diolia, joka tosyloituessaan tuotti karahanaeetteriä 29. Tuotto on määrittelemätön. Epoksidien pilkkominen on käytetty monien terpeenien,kuten rosenolaktonin,17 cyperolonin, 18 maritimolin, synteesissä.19
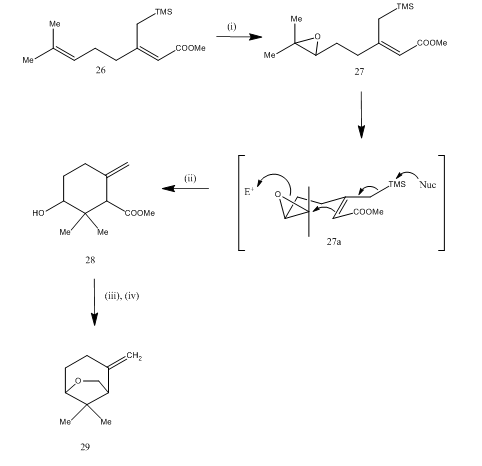
Kuva 7 (±) Karahana-eetterin synteesi
reagenssit: i) MCPBA; ii) BF3Et2O; iii) LiAlH4; iv) TsCl, Py
esteröinti
esteröinti on usein käytetty reaktio monien orgaanisten yhdisteiden synteesissä. Booritrifluoridieteraatti-alkoholi on erittäin kätevä reagenssi monien P-aminobentsoehappojen, aromaattisten, heterosyklisten ja tyydyttymättömien happojen esteröintiin.20 joissakin esteröintireaktioissa tämän reagenssin avulla saatiin parempi saanto kuin muilla reagensseilla. Joitakin esimerkkejä annetaan kaaviossa 8. Hapot 30-32 muunnettiin vastaavasti estereiksi 33-35 korkeasaantoisessa käsittelyssä booritrifluoridieteraatti-alkoholireagenssilla. Marshall ja collaborators21 käyttivät samaa reagenssia karboksyylihappojen esteröintiin. Dymicky22 valmisti useita formaatteja suuressa määrin muurahaishaposta ja alkoholista katalyyttisen määrän booritrifluoridi-metanolikompleksin läsnä ollessa. Muut katalyytit kuten rikkihappo, p – tolueenisulfonihappo eivät olleet yhtä tehokkaita kuin booritrifluoridi-metanolikompleksi.
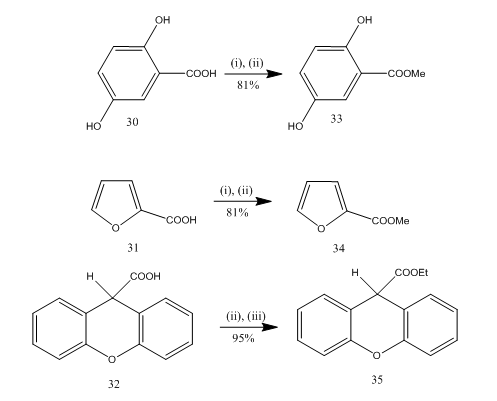
Kuva 8 happojen esteröinti 32-35
reagenssit: i) MeOH; ii) BF3. Et2O; (iii) EtOH
Jackson ja yhteistyökumppanit23 ovat kehittäneet tehokkaan menetelmän alkoholien 37-39 ja happojen 40-42 muuttamiseksi suoraan vastaaviksi t-butyylijohdannaisiksi hyvällä tuotolla käyttäen t-butyylitriklooriasetimidaattia 36 katalyyttisen booritrifluoridieteraatin läsnä ollessa, kuten kuvassa 9 esitetään. Tämä menetelmä toimii paremmin happoherkillä ryhmillä kuin perinteiset isobuteenia käyttävät menetelmät. Vähemmän estynyt hydroksyyliryhmä dioli voidaan suojata ja myös sopii pienimuotoista työtä (välttää luovuttaminen kaasumaisen isobuteenin). T-butyyli-2,2,2-triklooriasetimidaatti 36 valmistetaan helposti lisäämällä t-butanolia triklooriasetonitriiliin. Suurin osa kokeista tehtiin dikloorimetaanin ja sykloheksaanin seoksella. Etikkahappoanhydridiä booritrifluoridieteraatin läsnä ollessa on käytetty hydroksyyliryhmän asetylointiin.24

Kuva 9 alkoholien ja happojen muuntaminen t-butyylijohdannaisista.
reagenssit: 36, (i) BF3.Et2O, ii) CH2Cl2, C6H12
Syklisointi
booritrifluoridieteraatilla on ollut tärkeä rooli monien, karboksyylihappojen, alleenien jne. syklisoinnissa. Seuraavat muutamat esimerkit havainnollistavat booritrifluoridieteraatin roolia syklisoivana aineena. Happokloridi 49 ja alkeeni 50 kondensoituivat divinyyliketoni25 51: ksi,jonka läpi Nazarov syklisoitui 26, 27 sykliseksi Ketoni 52: ksi, joka muuntui seskviterpeenitrikoodieeniksi 53 (Scheme 10).
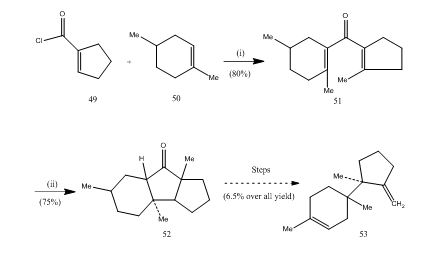
Kuva 10 Seskviterpeenitrichodiene 53
– reagenssien synteesi: i) SnCl4, NaOMe; ii) BF3Et2O
useat allenyyli-aryyliketonit syklisoituvat booritrifluoridieteraatilla, joka tuottaa metyleenibentsosyklopentenonia uudella 5-endo-moodisyklisoinnilla.28 ketonit 54-56 antoivat vastaavasti bentsosyklopentenonit 57-59 (järjestelmä 11). Todennäköisesti muutos tapahtui osoitetusti allenyyli-aryyliketoni 54: n syklisoituessa 57: ksi. Voidaan havaita, että substituenttiryhmien esiintyminen aromaattisessa renkaassa määrää syklisen tuotteen tuoton. Kos ja Loewenthal28 raportoivat hapon 60 syklisoinnin booritrifluoridieteraatilla Ketoni 61: ksi, joka muunnettiin gibberoni 62: ksi (järjestelmä 12) kolmessa vaiheessa:
- Ketalisaatio
- Huang-Minlonin pelkistys ja
- Happohydrolyysi. Edellä mainituissa esimerkeissä esiintyy booritrifluoridieteraatin käyttö orgaanisten yhdisteiden syklisoinnissa
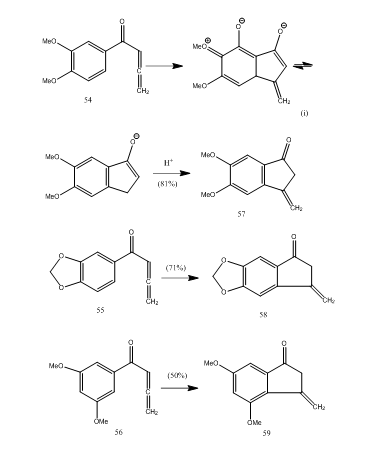
Kuva 11 Syklopentenonien synteesi

Kuva 12 synteesi gibberoniksi
reagenssit: i) BF3. Et2O; ii) a) C2H6O2; b) DEG, N2H4, KOH, 190-200°C; c) H+