elektronit kuorissa
![]()
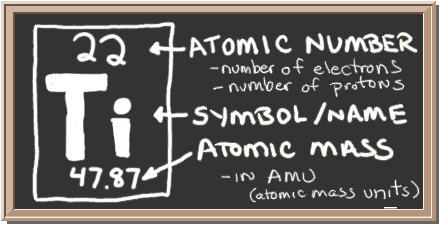
Tarkista liitutaulu. Tuossa laatikossa vasemmalla on kaikki tiedot, jotka sinun tarvitsee tietää yhdestä elementistä. Se kertoo yhden atomin massan, kuinka monta kappaletta sen sisällä on ja mihin se pitäisi jaksollisessa järjestelmässä sijoittaa.
nyt vuorossa on neljäs periodi/rivi elementeistä-taulukossa. Neutraalin atomin elektronien lukumäärä voi olla helppo tietää, mutta elektronien sijoittelu muuttuu hieman monimutkaisemmaksi. Katsotaanpa elektronien järjestelyjä neljännen jakson peruselementeissä (taulukon vasemmalla ja oikealla puolella) ja siirtymäelementtien monimutkaisempia järjestelyjä (rivin keskellä). Jos luulet, että tämä on vähän yli pääsi, mene takaisin ja katso elementtejä 1-18, joilla on organisaatioita, jotka ovat hieman yksinkertaisempia.
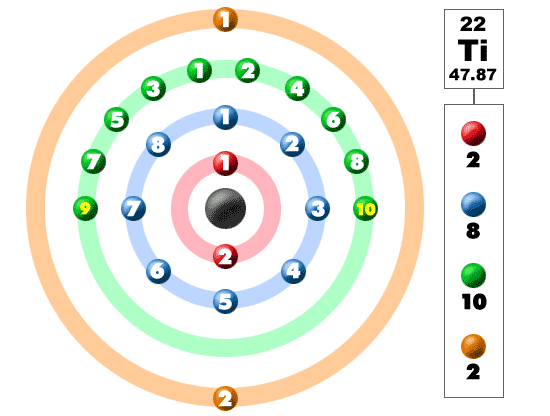
katso alla oleva kuva. Jokainen noista värillisistä palloista on elektroni. Atomissa elektronit pyörivät keskustan ympäri, jota kutsutaan myös ytimeksi. Elektronit haluavat olla erillisissä kuorissa / orbitaaleissa. Kun opit lisää atomin rakenteesta, opit, että elektronit eivät pysy määritellyillä alueilla ytimen ympärillä. Niitä löytyy pilvistä, joilla voi olla erilaisia muotoja, kuten palloja ja käsipainoa muistuttavia muotoja. Joten muista, kun katsot hajoamistamme, että elektronit eivät ole aina mukavassa järjestyksessä, kuten tässä on esitetty.
tämä alkuaine on yksi siirtymäalkioista, joka ei aseta ylimääräisiä elektroneja ulkokuoreen, vaan sen alla olevaan. Neljännellä jaksolla / rivillä kaikki nämä elektronit rakentavat kolmannen kuoren maksimissaan 18 elektroniin. Muista, että kahdeksan ensimmäistä sijoitettiin matkamme aikana läpi kolmannen jakson / rivin. Jaksollisen järjestelmän neljännellä rivillä on siirtymämetalleja, jotka vaihtelevat skandiumista (21) sinkkiin (30).
titaani on metalli. Se ei ole mikä tahansa metalli, se on siirtymämetalli. Koska se on siirtymämetalli, sillä on erityinen elektronikonfiguraatio. Se lisää seuraavan elektroninsa kolmanteen kuoreen, ei uloimpaan neljänteen kuoreen. Kokoonpanolla 2-8-10-2 titaani on maailmassa ja valmis sitoutumaan muihin elementteihin. Se valmistaa monia luonnollisia yhdisteitä halogeenien ja hapen kanssa. Koska titaani on siellä neljä ylimääräistä elektronia, se on melko joustava ja muodostaa monia yhdisteitä.