Kaliumkromaatti
Kaliumkromaatti kemialliset ominaisuudet,käyttötarkoitukset,tuotanto
epäorgaaninen yhdiste
Kaliumkromaatti, joka tunnetaan yleisesti nimellä tarapakaiitti, on epäorgaaninen yhdiste, joka on huoneenlämpötilassa keltaista ortorombista tai heksagonaalista kidettä. Sen suhteellinen tiheys on 2,732 ja sulamispiste 968 °C. Se on myrkyllistä ja voi hajota veteen muodostaen emäksistä kromaatti-ionihydrolyysiliuosta. Se on liukenematonta alkoholiin ja eetteriin. Hapon lisäämisen jälkeen kaliumkromaattiliuos muuttuu oranssiksi, mikä on dikromaatin väri. Liuoksessa olevan kromatin ja dikromaatin konversiossa vallitsee tasapaino: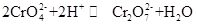
kun happoa lisätään kaliumkromaattiliuokseen, tasapainotila siirtyy kohti kaliumdikromaatin generointisuuntaa, ja kun kaliumdikromaattiliuokseen lisätään emästä, tasapainotila siirtyy kaliumkromaattin generointisuuntaan. Kaliumkromaatti on hapettava ja se voi reagoida pelkistimen kanssa emäksisessä väliaineessa muodostaen Cr(OH)4-(eli CrO2-). Lisäämällä kaliumkromaattiliuokseen erilaisia barium-Ionia, lyijy-Ionia ja hopeaionia sisältäviä liuoksia muodostuu vastaava liukenematon kromaatti: bariumkromaatti BaCrO4 (keltainen), lyijykromaatti pbCrO4 (keltainen), hopeakromaatti Ag2CrO4(tiilenpunainen). Kromaatti-ionien läsnäolo voidaan osoittaa näiden liukenemattomien kromaattien ominaisvärillä. Kaliumkromaattia voidaan käyttää analyyttisenä reagenssina, hapettimena, mordanttina, metallin ruosteenestoaineena sekä barium-ja hopeajäämäanalyysissä. Sitä voidaan käyttää myös parkitus-ja lääketeollisuuden sekä muiden kromiyhdisteiden raaka-aineena. Kromiitti Fe (CrO2) 2-jauhetta voidaan käyttää raaka-aineena ja kalsinoida kaliumhydroksidilla, kalkkikivellä (dolomiitti) ilmassa ja sitten uutetaan kaliumsulfaattiliuoksella kaliumkromaatin saamiseksi.
edellä mainitut tiedot on toimittanut Xiao Nan Chemicalbookista.
Kaliumkromaattiindikaattorimenetelmä
Kaliumkromaattiindikaattorimenetelmä, joka tunnetaan myös nimellä Moore (Mohr), on saostustitrausmenetelmä (hopeamenetelmä), jossa kaliumkromaattia (K2CrO4) käytetään indikaattorina ja hopeanitraattia (AgNO3) standardiliuoksena. Menetelmää käytetään pääasiassa kloori-Ionin (Cl -) tai bromidi-ionin (Br -) määrittämiseen. Lisätään pieni määrä k2cro4: ää indikaattoriksi ennen määrityksen ilmoittamista ja titrataan sitten AgNO3-standardiliuoksella. Titrauksen alkamisen jälkeen Valkoisen (hopeakloridin) tai vaaleankeltaisen (hopeabromidin) saostuma saostuu ensin. Kun cl-tai Br-saostuu kvantitatiivisesti, pieni ylimääräinen hopeanitraattiliuos aiheuttaa AG+: n pitoisuuden äkillisen nousun, jolloin syntyy välittömästi tiilenpunainen hopeakromaatti (Ag2CrO4) saostumista, mikä osoittaa titrauksen päätepisteen. Indikaattorin määrä ja liuoksen happamuus ovat kaksi suurta ongelmaa tässä titrausmenetelmässä. Jos K2CrO4-pitoisuus on liian korkea, titrausliuoksen väri on liian syvä estääkseen Ag2CrO4-saostusvärin havainnon; jos K2CrO4-pitoisuus on liian alhainen, hopeahalidin kvantitatiivisen saostuksen jälkeen tarvitaan liian huomattava määrä hopeanitraattiliuosta tuottamaan hopeakromaattisadetta titrauksen päätepisteen ohjaamiseksi, jolloin titrausvirhe kasvaa. Kun 0, 1 mol/l AgNO3-liuosta käytetään titraamaan 0.1mol / l halidia, jos k2cro4: n pitoisuus on 5× 10-3mol/l, päätepistevirhe on vain +0,06%, mikä voidaan ajatella, että analyysituloksen tarkkuus ei vaikuta. K2CrO4-indikaattorimenetelmää ei voida suorittaa happamassa tai emäksisessä liuoksessa, koska K2CrO4 muuttuu kaliumdikromaatiksi (K2Cr2O7) pienellä pH-arvolla ja Ag+ saostuu hopeaoksidin (Ag2O) muodossa, kun pH on liian korkea. Yleisesti sopiva happamuusalue on pH = 6,5~ 10,5, mutta kun liuoksessa on ammoniumsuoloja, liuoksen happamuus pH = 6,5~7,2 on sopiva.
kaliumkromaatti-indikaattorimenetelmää voidaan käyttää vain cl-tai Br-ionien suoranaiseen titraukseen, ja titraustulos on niiden yhteisarvo samanaikaisessa käytössä. Tämä menetelmä ei sovellu jodidi-ionin (I -) tai Tiosyanaatti-ionin (SCN -) määrittämiseen, koska ne imeytyvät liian helposti sedimentaatioon ja päätepiste on epäselvä. Tämä menetelmä ei myöskään sovellu Ag+: n titraamiseen cl -: llä, mutta Ag+ voidaan määrittää takatitrauksella, eli lisätään liiallinen määrä NaCl-standardiliuosta testiliuokseen ja käytetään sitten AgNO3-standardiliuosta ylimääräisten Cl-ionien titraamiseen. Liuoksessa kaikki kationit, jotka voivat muodostaa saostumia CrO2-4: llä tai anionit, jotka voivat saostua Ag+: lla, häiritsevät määritystä. Kaliumkromaatti-indikaattorimenetelmää käytetään pääasiassa cl-ionien määrittämiseen hyvin laimeassa liuoksessa, kuten cl-ionien määrittämiseen juomavedessä ja teollisuustuotteissa.
kaliumdikromaatti
kaliumdikromaatti, joka tunnetaan myös nimellä red alum-kalium, on oranssinpunainen trikliininen kide tai neulamainen kide. Tiheys on 2,676 g / cm3. Sulamislämpötila on 398 °C. Se liukenee veteen ja liukenematon etanoliin. Sillä on vahva hapettava ominaisuus ja se hajoaa 1300 °C: n lämpötilassa
tuotannossa kaliumdikromaattia käytetään aina kromin käyttöön, jotta emali värjätään sulatettaessa. Se on värillisen titaanimaidon keltaisen lasitteen ja titaanin keltaisen lasitteen väriaine, ja käytetty annos on yleensä 0,06%~0,12%. Kaliumdikromaattia ja kuparioksidia voidaan myös sekoittaa-käyttää vihreän, bambunvihreän, hedelmien vihreän ja muun värin lasittamiseen. Nämä värilliset lasitteet ovat kuitenkin yleensä vähemmän kiiltäviä kromatin vaikutuksesta johtuen.
kromioksidi-tai kalium (natrium) dikromaatista saatu värilasite on usein kellanvihreä Kromi-ionien valenssimuutoksen vuoksi sulamisprosessissa. Kaliumdikromaattia käytetään myös yleisesti erilaisten vihreiden pigmenttien ja vaaleanpunaisten pigmenttien valmistamiseen.
Kaliumdikromaattipitoisuus ≥ 99%, kloridipitoisuus (Cl) ≤ 0, 08%, veteen liukenematon ≤ 0, 05%.
edellä mainitut tiedot on koonnut Yaoyao Chemicalbookista.
liukoisuus veteen (g/100 ml)
liuennut gramma / 100 ml vettä eri lämpötiloissa (°C):
60 g/10 °c; 63,7 g/20 °C; 66,7 g/30 °C; 67,8 g/40 °C
70,1 g/60 °C; 74,5 g/90 °C
myrkyllisyys
KS.natriumkromaatti
kemialliset ominaisuudet
sitruunankeltainen ortorombinen kide; liukenee veteen; liukenematon alkoholiin
hakemus
käytetään analyyttisenä reagenssina, hapettimena, peitteenä ja metallin ruosteenestoaineena;käytetään kromatin valmistukseen,käytetään hapettimena ja peitteenä painatuksessa ja värjäyksessä. Käytetään muste, maali, emali, metalli korroosio ja niin edelleen, käytetään pääasiassa valmistuksessa kemiallisten reagenssien ja pigmenttejä.
valmistelu
Neutralointimenetelmä: Liuota kaliumdikromaatti emäliuokseen ja veteen ja lisää sitten seos reaktoriin. Lisää seuraavaksi kaliumhydroksidia sekoittaen neutralointireaktion suorittamiseksi. Tuotettu kaliumkromaatti on heikosti emäksistä, ja sitten haihdutetaan konsentrointia varten, jäähdytetään kiteytymistä varten, erotetaan ja kuivataan, jotta saadaan valmiit kaliumkromaattituotteet.
K2Cr2O7 + 2koh → 2k2cro4 + H2O
erotettu emäliuos palautetaan liuotusvaiheeseen kaliumdikromaatin liuottamiseksi.
kemialliset ominaisuudet
sitruunankeltaiset kiteet
kemialliset ominaisuudet
Kaliumkromaatti (VI) on keltainen kiteinen kiinteä aine.
käyttää
Kaliumkromaattia (K2CrO4), joka liukenee veteen ja josta valmistetaan kirkkaankeltaisia musteita ja maalipigmenttejä. Sitä käytetään myös reagenssina kemiallisissa laboratorioissa ja peitteenä väriaineiden”kiinnittämiseen” värillisissä tekstiileissä.
käyttää
sitä käytetään hapettimena.
käyttää
on rajoitettu käyttö emaleissa, viimeistelynahassa, metallien ruostesuojauksessa, joka on korvattu natriumsuolalla; reagenssina analyyttisessä kemiassa.
määritelmä
ChEBI: kaliumsuola, joka koostuu kalium-ja kromaatti-ioneista suhteessa 2: 1.
määritelmä
a suola, joka sisältää ionCrO42-.
määritelmä
kaliumkromaatti: kirkkaan keltakiteinen kiinteä aine, K2CrO4, vesiliukoinen ja alkoholiin liukenematon; rombinen; r. d.2.73; m. p.968.3°C; hajoaa kiehumatta. Sitä tuotetaan teollisesti paahtamalla jauhemaista kromiittimalmia kaliumhydroksidilla ja kalkkikivellä ja huuhtelemalla syntyvää karstaa kuumakaliumsulfaattiliuoksella. Potassiumkromaattia käytetään nahkaverhoilussa, Tekstiilien peitteenä sekä inenameleissa ja pigmenteissä. Laboratoriossa sitä käytetään analyyttisenagenttina ja indikaattorina. Kuten muut Kromi (III) yhdisteet se onoksinen nieltynä tai hengitettynä.
yleiskuvaus
Kaliumkromaatti on keltainen kiteinen kiinteä aine. Kaliumkromaatti liukenee veteen. Ensisijainen vaara on ympäristölle aiheutuva uhka. On ryhdyttävä välittömiin toimiin sen leviämisen rajoittamiseksi ympäristöön. Kaliumkromaattia käytetään kemiallisessa analyysissä, maalien ja musteiden pigmenttien valmistuksessa, fungisidina ja muiden kromiyhdisteiden valmistamiseen.
ilma & Vesireaktiot
Liukoinen veteen.
Reaktiivisuusprofiili
hapettavat aineet, kuten Kaliumkromaatti, voivat reagoida pelkistävien aineiden kanssa muodostaen lämpöä ja tuotteita, jotka voivat olla kaasumaisia (aiheuttaen suljettujen säiliöiden paineistumista). Tuotteet voivat itsessään pystyä uusiin reaktioihin (kuten palamiseen ilmassa). Tämän ryhmän materiaalien Kemiallinen pelkistys voi olla nopeaa tai jopa räjähtävää, mutta vaatii usein aloituksen (lämpö, kipinä, katalyytti, liuottimen lisääminen). Epäorgaanisten hapettavien aineiden räjähtävät seokset pelkistävien aineiden kanssa säilyvät usein muuttumattomina pitkiä aikoja, jos initiaatio estetään. Tällaiset järjestelmät ovat tyypillisesti kiinteiden aineiden seoksia, mutta niihin voi sisältyä mitä tahansa fysikaalisten olomuotojen yhdistelmää. Eräät epäorgaaniset hapettavat aineet ovat veteen liukenevien metallien suoloja; liukeneminen laimentaa mutta ei mitätöi tällaisten aineiden hapettavaa voimaa. Orgaanisilla yhdisteillä on yleensä jonkin verran pelkistävää tehoa ja ne voivat periaatteessa reagoida tämän luokan yhdisteiden kanssa. Todellinen reaktiivisuus vaihtelee suuresti orgaanisen yhdisteen identiteetin mukaan. Epäorgaaniset hapettavat aineet voivat reagoida rajusti aktiivisten metallien, syanidien, estereiden ja tiosyanaattien kanssa.
vaara
Myrkyllistä nieltynä ja hengitettynä.
terveysvaara
hengittäminen aiheuttaa paikallista limakalvojen ärsytystä; jatkuva nenän ärsytys voi johtaa nenän väliseinän puhkeamiseen. Nieleminen voi aiheuttaa raju gastroenteriitti, verenkiertokollapsi, huimaus, kooma, ja toksinen nefriitti; nauttiminen liiallisia määriä voi olla kohtalokasta. Silmiin joutuminen aiheuttaa voimakasta ärsytystä ja sidekalvontulehdusta. Toistuva tai pitkäaikainen altistuminen pölylle, sumulle tai liuoksille voi aiheuttaa ihotulehdusta; kosketus ihon taukojen kanssa voi aiheuttaa `kromihaavoja”, jotka näkyvät hitaasti paranevina, kovina haavaumina, jotka jättävät alueen alttiiksi infektiolle.
palovaara
käyttäytyminen palossa: saattaa lisätä tulen voimakkuutta, jos se joutuu kosketuksiin palavien aineiden kanssa. Viilentää astiat ja valunut materiaali runsaalla vedellä.
turvallisuusprofiili
vahvistettu karsinogeeni kokeellisilla tuumorigeenituloksilla. Myrkky nieltynä, laskimonsisäisenä, ihonalaisena ja lihaksensisäisenä. Kokeellinen alteratogeeni. Muut kokeelliset toistovaikutukset. Ihmisen mutaatiotiedot raportoitu. Apowerful hapetin. Kuumennettaessa se muodostaa myrkyllisiä K2O-kaasuja. sitä käytetään villan peitteenä, materiaalien hapettamisessa ja väriaineiden käsittelyssä. Katso myös kromiyhdisteet.
potentiaalinen altistuminen
Kaliumkromaattia käytetään painatuksessa: fotomekaaninen käsittely; Kromi-pigmentti tuotanto; ja Villa säilöntäaine menetelmiä; tehdä väriaineita, pigmenttejä, musteet ja emalit; hapettimena; analyyttinen reagenssi; galvanointi; räjähteitä.
Shipping
UN1479 Oxidizing solid, n. o.s., Hazard Class: 5.1; Labels: 5.1-Oxidizer, Technical Name Required. UN3288 Toxic solids, inorganic, n. o. s., vaaraluokka: 6.1; etiketit: 6.1-myrkylliset materiaalit, tekninen nimi vaaditaan
puhdistusmenetelmät
kiteytetään se johtavuusvedestä (0.6 g/mL 20o: ssa) ja kuivataan välillä 135o-170o.
yhteensopimattomuudet
voimakas hapetin. Väkivaltaisia reaktioita palavilla aineilla, orgaanisilla aineilla, metallijauheilla tai helposti hapettuvilla aineilla. Joutuessaan kosketuksiin hydroksyyliamiinin kanssa hydratsiini aiheuttaa räjähdyksen.