Mo HF
heterogeenisten Diatomimolekyylien Molekyyliorbitaaleille
yksinkertainen lähestymistapa heterogeenisten diatomimolekyylien molekyyliorbitaaliteoriaan on esittää energiatasokaavio. MO-energiatasot voidaan laskea seuraavasti:
muista, että energia \(E_n\) kvanttiluvulle n on alkuaineelle, jolla on atominen Z, on noin
\
käytämme \(Z_{eff}\) Z: n sijasta tarkoittamaan, että meidän on muutettava järjestyslukua saadaksemme tehokkaan atomivarauksen ytimelle. Koska olemme tekemisissä likimääräisiä arvoja, yksi voi käyttää Z suoraan. Vetyatomien 1s – orbitaalin energiataso on -13,6 eV mitattuna h: n ionisaatioenergiana
näin ollen kvanttiluvulle n = 1 HE: n energiataso 1S on noin-54 eV. Vastaavasti F: n 1s-energiataso on-1101 eV. 2s ja 2p energiatasot hän on noin – 13,6 eV, joka on simlar että 1s orbital H.
näin 2s energiataso Li on noin -6 eV. Monielektroniatomeilla P-alikuorella ja s-alikuorella on kuitenkin erilaiset energiat tunkeutumisen vuoksi. Tällä tasolla emme voi olla tarkkoja siitä, vaan yksinkertaisesti ajatella, että 2p-orbitaalit ovat suuremmalla energialla kuin 2s-orbitaalit. Yleensä atomiorbitaalit, joiden energiatasot ovat samanlaiset, menevät päällekkäin muodostaen molekyyliorbitaaleja. Näin, me vastaavat energiatasot atomiorbitaalit, ja sitten tehdä liimaus ja anti-liimaus MOs niistä.
jos atomiorbitaalien energiataso on kuitenkin hyvin erilainen, käytetään epätäydellisen alikerroksen atomiorbitaaleja muodostamaan MOs.
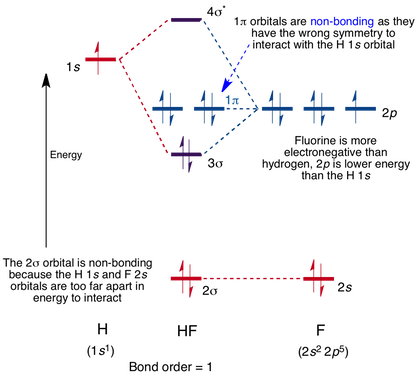
HF-molekyylin Molekyyliorbitaalikaavio
vuorovaikutus tapahtuu vedyn 1s-orbitaalin ja fluorin 2p-orbitaalin välillä aiheuttaen Sigma-sidoksen ja Sigma-antibonding-molekyyliorbitaalin muodostumisen, kuten alla on esitetty.