Molekyylirakenne paljastaa, miten antibiootti streptomysiini toimii | BNL Newsroom
molekyylirakenne paljastaa, miten antibiootti streptomysiini vaikuttaa
5.syyskuuta 2013
streptomysiini oli ensimmäinen tuberkuloosin hoitoon kehitetty antibiootti, mutta viime aikoihin asti tutkijat eivät täysin ymmärtäneet, miten se toimii molekyylitasolla. He tiesivät, että streptomysiini estää kriittisen prosessin, proteiinien synteesin ribosomien avulla, mikä johtaa bakteerisolukuolemaan, mutta tietyt vuorovaikutuksen yksityiskohdat jäivät selvittämättä. Brookhaven National Laboratoryn National Synchrotron-Valonlähteessä tutkijat ovat käyttäneet röntgenkristallografiaa kuvan täydentämiseen.
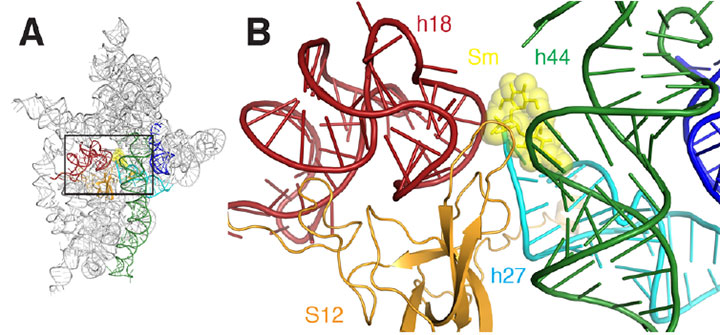
a) nauhakaavio ribosomin streptomysiinin sitoutumiskohdasta. B) lähikuva A. Streptomysiinissä hahmotellusta suorakulmaisesta alueesta esitetään keltaisina shkkeinä ja palloina, helikset ovat väriltään punaisia, tummanvihreitä, syaaneja, oransseja ja sinisiä.
streptomysiini kuuluu antibioottiperheeseen, joka toimii keskeyttämällä bakteerisolujen ribosomien toiminnan, monimutkaisten molekyylikoneiden, jotka luovat proteiineja yhdistämällä aminohappoja toisiinsa. Ribosomeilla, jotka toimivat estämällä proteiinien synteesiä, on kaksi pääosaa eli ”alayksikköä.”
suurempi alayksikkö tekee proteiinin rakentamisen, jota ohjaa lähetti-RNA (mRNA) – niminen RNA-tyyppi, joka sitoutuu siihen. Pieni alayksikkö” lukee ” mRNA: n ja valitsee vastaavan siirtäjä-RNA: n (tRNA) molekyylin, joka valitsee ja toimittaa ribosomille seuraavan aminohapon. Tässä streptomysiinillä on rooli. Se sitoutuu lähelle pientä alayksikköä, jolloin se tulkitsee sekvenssin pahasti väärin. Tämä johtaa satunnaisten proteiinien synteesiin, joka lopulta tappaa bakteerit. Mutta miten tämä väärinkäsitys tapahtui pysyi mysteeri, kunnes äskettäin tutkimuksen tutkijoiden Brown University ja multi-institution Northeastern Collaborative Access Team Argonne National Laboratory (hallinnoi Cornell University).
luomalla streptomysiinin läsnä ollessa mRNA: han sitoutuneesta pienestä ribosomaalisesta alayksiköstä kiderakenteen – järjestyksellisen rakenteen – tutkijat loivat useita yksityiskohtaisia ”tilannekuvia”, jotka paljastivat vuorovaikutuksen Keskeiset molekyylitason yksityiskohdat ja lopulta osoittivat, miten streptomysiini heikentää alayksikön toimintaa. Nsls beamline X25: ssä he käyttivät röntgenkristallografiaksi kutsuttua tekniikkaa, jossa röntgensäteiden säde on suunnattu kidettä kohti, vuorovaikuttaa molekyylien kanssa ja tuottaa monimutkaisen diffraktiokuvion. Kuviosta ryhmä rakensi tietokoneohjelmistojen avulla visuaalisia esityksiä alayksiköstä-mRNA-streptomysiinikompleksi.
lyhyesti sanottuna tutkijat saattoivat ”nähdä” ensimmäistä kertaa ne hienovaraiset tavat, joilla streptomysiini vääristää alayksikön dekoodauskohdan rakennetta ja saa sen lukemaan väärin mRNA: ta. Esimerkiksi streptomysiinin sitoutuminen vähentää kahden alayksikön molekyylirakenteen muodostavan kierteen välistä etäisyyttä. Tämä on erityisen merkittävää, koska nämä kierteet muodostavat varsinaisen dekoodauspaikan, ja dekoodaus tapahtuu oikein vain, jos nämä elementit on suunnattu täsmälleen oikein mRNA: n ja valitun tRNA: n suhteen. Streptomysiinin sitoutuminen saa myös aikaan muutoksen toisen näistä kahdesta kierteestä ja kolmannen kierteen välisessä suhteessa, jolloin toinen vetäytyy pois toisesta tai ” irtoaa.”
kaikkien näiden pienten muutosten lopputulos on se, että streptomysiini horjuttaa alayksikön ja ”oikean” tRNA: n välistä sitoutumista samalla kun se vakauttaa alayksikön sitoutumisen ”väärään” tRNA: han, jolloin oikean ja väärän tRNA: n välinen syrjintä poistuu tehokkaasti. Tämä aiheuttaa tuhoa bakteerien uusien proteiinien toimitusketjussa ja häiritsee bakteerien lisääntymistä ja elinkaarta.
”rakenteelliset tutkimuksemme osoittivat, että streptomysiini aiheuttaa yllättävän suuria vääristymiä bakteerien ribosomissa, mikä auttaa meitä ymmärtämään, miten tämä antibiootti häiritsee bakteerien proteiinisynteesiä”, sanoi johtava tutkija Gerwald Jogl, biologian apulaisprofessori Brownin molekyylibiologian, solubiologian & biokemian osastolta. ”Jatkaen nykyisiä havaintojamme tutkimme nyt, miten bakteerien ribosomien mutaatiot voivat torjua näitä rakenteellisia uudelleenjärjestelyjä ja auttaa bakteereja selviytymään streptomysiinin muuten tappavasta vaikutuksesta.”
tämä tutkimus julkaistiin Nature Communications-lehdessä 15. tammikuuta 2013 otsikolla ”a structural basis for streptomycin-induced misreading of the genetic code.”Tuki tuli National Institutes of Health ja Department of Energy.
2013-4251 | int / EXT / Newsroom