Électrons Dans Les Coquilles
![]()
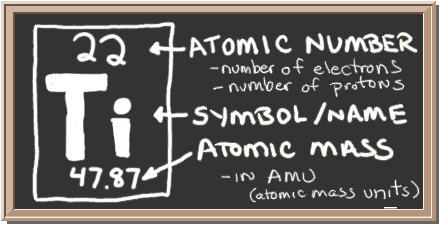
Consultez le tableau noir. Cette case à gauche contient toutes les informations que vous devez savoir sur un élément. Il vous indique la masse d’un atome, combien de pièces se trouvent à l’intérieur et où il doit être placé sur le tableau périodique.
Maintenant, nous travaillons avec la quatrième période / ligne dans le tableau des éléments. Vous avez peut-être un moyen facile de connaître le nombre d’électrons dans un atome neutre, mais le placement de ces électrons devient un peu plus complexe. Jetons un coup d’œil aux dispositions des électrons dans les éléments de base (côtés gauche et droit du tableau) de la quatrième période et aux dispositions plus complexes des éléments de transition (au milieu de la rangée). Si vous pensez que c’est un peu au-dessus de votre tête, revenez en arrière et regardez les éléments 1 à 18 qui ont des organisations un peu plus simples.
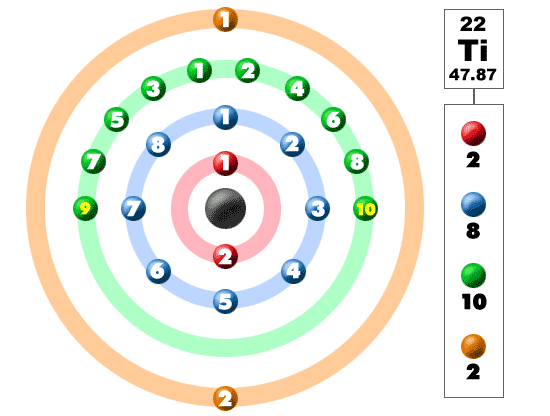
Regardez la photo ci-dessous. Chacune de ces boules colorées est un électron. Dans un atome, les électrons tournent autour du centre, également appelé noyau. Les électrons aiment être dans des coquilles / orbitales séparées. En apprenant plus sur la structure atomique, vous apprendrez que les électrons ne restent pas dans des zones définies autour du noyau. On les trouve dans des nuages qui peuvent avoir différentes formes, notamment des sphères et des formes ressemblant à des haltères. Alors rappelez-vous quand vous regardez notre panne que les électrons ne sont pas toujours dans un bon ordre, comme indiqué ici.
Cet élément est l’un des éléments de transition qui ne place pas les électrons supplémentaires dans l’enveloppe extérieure, mais dans celle en dessous. Pour la quatrième période / ligne, tous ces électrons construisent la troisième coque jusqu’à un maximum de 18 électrons. Rappelez-vous que les huit premiers ont été placés pendant notre voyage à travers la troisième période / ligne. La quatrième rangée du tableau périodique comporte des métaux de transition allant du scandium (21) au zinc (30).
Le titane est un métal. Ce n’est pas n’importe quel métal, c’est un métal de transition. Étant un métal de transition, il a une configuration électronique spéciale. Il ajoute son électron suivant à la troisième coquille, pas à la quatrième coquille la plus externe. Avec une configuration de 2-8-10-2, le titane est dans le monde et prêt à se lier à d’autres éléments. Il fabrique de nombreux composés naturels avec des halogènes et de l’oxygène. Puisque le titane est là avec quatre électrons supplémentaires, il est assez flexible et forme de nombreux composés.