12.8 : Nomenclature des Polycycloalcanes
Il existe de nombreux hydrocarbures et dérivés d’hydrocarbures à deux cycles ou plus ayant des atomes de carbone communs. Une telle substance est la décaline, qui a dix carbones disposés en deux anneaux à six chaînons:
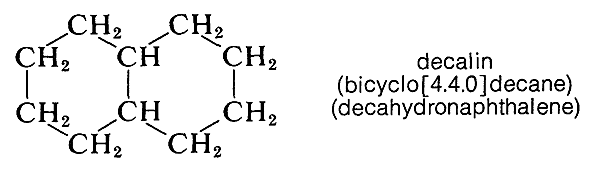
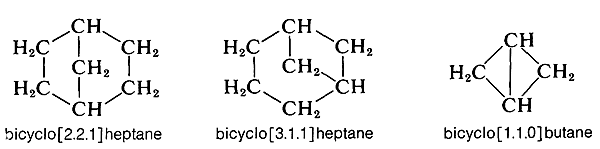
Les composés de ce type sont généralement nommés en attachant le préfixe bicyclo au nom de l’hydrocarbure à chaîne ouverte avec le même nombre total d’atomes de carbone que dans les cycles. Ainsi la décaline, qui a dix carbones dans le système annulaire, est un bicyclodécane. Ensuite, il faut avoir un moyen de spécifier les tailles des anneaux, ce qui se fait en comptant le nombre d’atomes de carbone dans chacune des chaînes reliant les deux atomes qui constituent les jonctions des anneaux ou têtes de pont. La décaline a quatre carbones dans chacune des deux chaînes et aucun dans la troisième. Par conséquent, la décaline est du bicyclodécane. Notez que les chiffres sont placés entre crochets après le préfixe « bicyclo » et avant le nom de l’hydrocarbure. Les nombres sont répertoriés par ordre de grandeur décroissant et sont correctement séparés par des points, pas par des virgules. D’autres exemples suivent:
Pour nommer les polycycloalcanes substitués, un système de numérotation est nécessaire. Dans le système IUPAC, le cycle principal est celui contenant le plus grand nombre d’atomes de carbone. Deux des carbones de l’anneau principal servent de jonctions pour le pont principal, qui est choisi pour être le plus grand possible, en accord avec le choix de l’anneau principal. Des règles supplémentaires sont nécessaires pour les cas plus complexes, mais celles-ci ne nous intéressent pas ici.
Dans la numérotation des systèmes cycliques qui ont deux jonctions annulaires, l’un d’eux est choisi comme \(\ce{C_1}\). La numérotation se poursuit le long de la plus longue chaîne de carbones jusqu’à la jonction suivante, puis se poursuit le long de la chaîne la plus longue suivante et se termine finalement le long de la chaîne la plus courte. Par exemple,
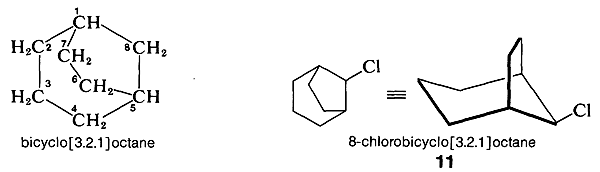
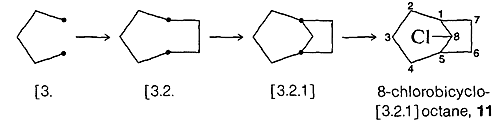
Ici, l’anneau principal a sept carbones (\(\ce{C_1}\) à \(\ce{C_7}\)) et il y a un pont à un carbone \(\left(\ce{C_8}\right)\).
Lorsque les cycles hydrocarbonés n’ont qu’un seul carbone en commun, ils sont appelés spiranes et reçoivent des noms systématiques en accord avec les exemples suivants:
Notez que pour les spiranes, la numérotation commence à côté du point de jonction dans le plus petit anneau.
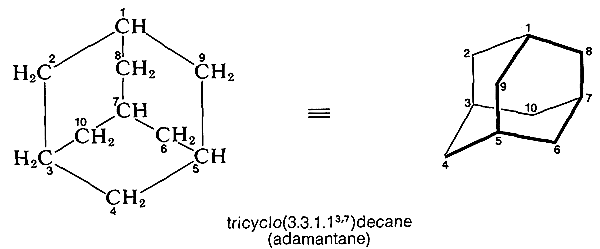
La dénomination des tricycloalcanes suit le même système général.\(^7 \) Le plus grand anneau et sa liaison principale forment un système bicyclique, et l’emplacement de la quatrième liaison ou de la liaison secondaire est indiqué par des exposants. Le nom systématique de l’hydrocarbure intéressant adamantane est donné ci-dessous à titre d’exemple ; sa conformation est également montrée. Le plus grand cycle de l’adamantane est à huit chaînons et les carbones qui le constituent pourraient être sélectionnés de plusieurs manières différentes. Le carbone choisi comme \(\ce{C_9}\) se situe entre \(\ce{C_1}\) et \(\ce{C_5}\), pas entre les \(\ce{C_3}\) et \(\ce{C_7}\):
Pour générer une structure à partir d’un nom tel que le 8-chlorobicyclooctane, \(11\), commencez par une paire d’atomes de jonction, connectez-les comme prescrit, puis numérotez le squelette initial, effectuez les connexions finales et localisez les substituants. Les étapes suivantes:
Un autre exemple plus compliqué est le 1,4-dichloropentacyclooctane:
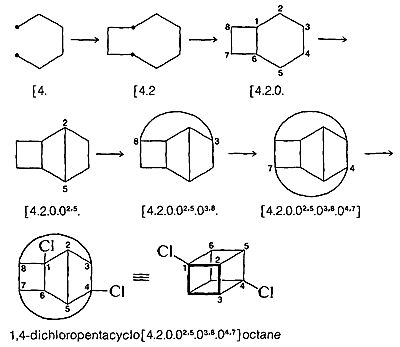
La partie la plus difficile de toute la procédure peut être de générer la structure finale dans une perspective appropriée. La tâche de le faire peut être grandement simplifiée par l’utilisation de modèles moléculaires.
\(^7\) Pour déterminer si un système cyclique polycylique ponté donné doit être bicyclo, tricyclo, etc., utilisez la règle selon laquelle le nombre de cycles est égal au nombre minimum de clivages de liaison pour convertir le système cyclique en un hydrocarbure acyclique ayant le même nombre de carbones.
Contributeurs et attributions
- John D. Robert et Marjorie C. Caserio (1977) Principes de base de la chimie organique, deuxième édition. W.A. Benjamin, Inc. , Parc de Menlo, CA. ISBN 0-8053-8329-8. Ce contenu est protégé par le droit d’auteur dans les conditions suivantes: « Vous êtes autorisé à reproduire, distribuer, afficher et exécuter cette œuvre de manière individuelle, éducative, à des fins de recherche et à des fins non commerciales dans n’importe quel format. »