16.10 : Addition électrophile : 1,2-Versus 1,4-Addition
Les réactions d’addition de diènes isolés se déroulent plus ou moins comme prévu du comportement des alcènes simples. Ainsi, si l’on traite un équivalent molaire de 1,5-hexadiène avec un équivalent de brome, on obtient un mélange de 5,6-dibromo-1-hexène, de 1,2,5,6-tétrabromohexane et de diène n’ayant pas réagi, le composé dibromo étant le produit principal (environ 50%)
fig
Des réactions similaires de diènes conjugués, en revanche, donnent souvent des produits inattendus. L’ajout de brome au butadiène-1,3 en est un exemple. Comme indiqué ci-dessous, on obtient un mélange approximativement 50:50 de 3,4-dibromo-1-butène (le produit attendu) et de 1,4-dibromo-2-butène (principalement l’isomère E). Ce dernier composé est remarquable en ce que la double liaison restante se trouve dans un endroit où il n’y avait pas de double liaison dans le réactif. Cette relocalisation intéressante nécessite une explication.
CH2 =CH-CH = CH2 + Br2  |
BrCH2CHBr-CH = CH2+ | BrCH2CH =CHCH2Br |
| 3,4- dibromo-1-butène | 1,4-dibromo-2-butène |
Le produit d’addition attendu de telles réactions est le résultat de l’addition 1,2, c’est-à-dire de la liaison aux carbones adjacents d’une double liaison. Le produit inattendu provient de l’addition 1,4, c’est-à-dire de la liaison aux atomes de carbone terminaux d’un diène conjugué avec un déplacement de la double liaison restante vers l’emplacement 2,3. (Ces nombres se réfèrent aux quatre carbones du diène conjugué et ne sont pas des numéros de nomenclature IUPAC.) Les compositions de produits sont souvent dépendantes de la température : à 40 oC, 85% du mélange de produits dans la réaction d’addition ci-dessus est le produit 1,4, alors qu’à 0 oC, seulement environ 30% est le produit 1,4.
La liaison d’un atome ou d’un groupe électrophile à l’un des atomes de carbone terminaux d’un diène conjugué (carbone #1 sur la figure ci-dessous) génère un intermédiaire de cation allylique. De tels cations sont stabilisés par délocalisation de charge, et c’est cette délocalisation qui explique le produit d’addition 1,4 produit dans de telles réactions d’addition. Comme le montre le diagramme, la charge positive est répartie sur les carbones #2 et #4, c’est donc à ces sites que le composant nucléophile se lie. On notera que la stabilisation par résonance du cation allyle est supérieure à une stabilisation comparable du 1,3-butadiène, car la charge est délocalisée dans le premier, mais créée et séparée dans le second.
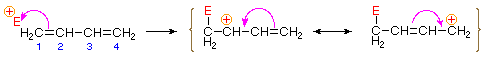
Une explication de l’influence de la température est présentée dans le diagramme d’énergie suivant pour l’addition d’HBr au butadiène-1,3. L’étape initiale dans laquelle un proton se lie au carbone #1 est l’étape de détermination du taux, comme l’indique la grande énergie d’activation (flèche gris clair). La deuxième étape la plus rapide est l’étape de détermination du produit, et il existe deux voies de réaction (de couleur bleue pour l’addition 1,2 et magenta pour l’addition 1,4). L’addition 1,2 a une énergie d’activation plus faible que l’addition 1,4 – elle se produit plus rapidement que l’addition 1,4, car le nucléophile du bromure est plus proche du carbone #2 puis du carbone # 4. Cependant, le produit 1,4 est plus stable que le produit 1,2. À basse température, les produits se forment de manière irréversible et reflètent les vitesses relatives des deux réactions concurrentes. C’est ce qu’on appelle le contrôle cinétique. À des températures plus élevées, l’équilibre est établi entre les produits et le produit 1,4 favorisé thermodynamiquement domine.
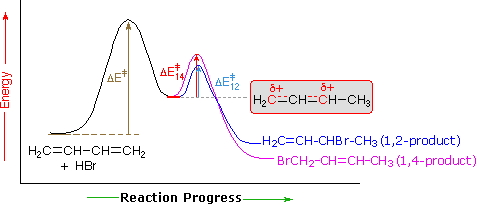
Lorsqu’un diène conjugué est attaqué par un électrophile, les produits résultants sont un mélange d’isomères 1,2 et 1,4. La cinétique et la thermodynamique contrôlent une réaction lorsqu’il y a deux produits dans des conditions de réaction différentes. Le produit cinétique (Produit A) se formera rapidement et le produit thermodynamique (Produit B) se formera plus lentement. Habituellement, le premier produit formé est le produit favorisé le plus stable, mais dans ce cas, le produit formé le plus lentement est le produit le plus stable; Produit B.
Introduction
Comme les diènes non conjugués, les diènes conjugués sont sujets à des attaques par électrophiles. En fait, les électrophiles conjugués ont une réactivité cinétique relativement plus grande lorsqu’ils réagissent avec des électrophiles que les diènes non conjugués. Lors de l’addition électrophile, le diène conjugué forme un mélange de deux produits — le produit cinétique et le produit thermodynamique — dont le rapport est déterminé par les conditions de réaction. Une réaction produisant plus de produit thermodynamique est sous contrôle thermodynamique, et de même, une réaction produisant plus de produit cinétique est sous contrôle cinétique.
Réaction de Base
Mécanisme Détaillé
Conclusion
La réactivité des diènes conjugués (hydrocarbures contenant deux doubles liaisons) varie en fonction de l’emplacement des doubles liaisons et de la température de la réaction.Ces réactions peuvent produire des produits thermodynamiques et cinétiques. Les doubles liaisons isolées fournissent aux diènes une stabilité thermodynamique inférieure à celle des diènes conjugués. Cependant, ils sont plus réactifs cinétiquement en présence d’électrophiles et d’autres réactifs. Ceci est le résultat de l’ajout de Markovnikov à l’une des doubles liaisons. Un carbocation est formé après l’ouverture d’une double liaison. Ce carbocation a deux structures de résonance et l’addition peut se produire à l’un ou l’autre des carbones positifs.
Problèmes de pratique
- Écrivez les produits de l’addition 1,2 et de l’addition 1,4 de a) HBr et Br. b) DBr en 1,3-cyclo-hexadiène. Qu’est-ce qui est inhabituel dans les produits de l’addition de 1,2- et 1,4-de HX à des 1,3-diènes cycliques non substitués?
- Le produit d’addition 1,2 se forme-t-il plus rapidement à des températures plus élevées, même si c’est le produit d’addition 1,4 qui prédomine dans ces conditions ?
- Pourquoi le produit à 1,4 addition est-il le produit thermodynamiquement plus stable?
- Parmi les cations radicaux suivants, lequel n’est pas une structure de résonance raisonnable?
5. L’addition de 1 équivalent de brome à l’hexadiène-2,4 à 0 degré C donne le dibromo-4,5 hexène-2 plus un isomère. Lequel des éléments suivants est cet isomère:
- 5,5- dibromo-2-hexène
- 2,5-dibromo-3-hexène
- 2,2-dibromo-3-hexène
- 2,3-dibromo-4-hexène
6. Lequel des éléments suivants sera le produit cinétiquement favorisé de la réaction représentée?
7. L’addition d’HBr au 2,3-diméthyl-1,3-cyclohexadiène peut se produire en l’absence ou en présence de peroxydes. Dans chaque cas, deux produits isomères C8H13Br sont obtenus. Lequel des éléments suivants est un produit commun des deux réactions?
8. et 9.
8. Le produit cinétiquement contrôlé dans la réaction ci-dessus est:
- 3- Chloro-1-Butène
- 1-Chloro-2-Butène
9. Pour la réaction à la question 8, laquelle est le résultat de l’addition 1,4?
- 3- Chloro-1-Butène
- 1-Chloro-2-Butène
Réponses aux problèmes
1. A) Même produit pour les deux modes d’addition.
B) Des isomères cis et trans se formeront.
L’addition de l’HX aux cycloalka-1,3-diènes non substitués de manière 1,2- ou 1,4- donne le même produit en raison de la symétrie.
2. Oui. le Produit cinétique se formera toujours plus rapidement mais dans ce cas, il y aura suffisamment d’énergie pour former le produit thermodynamique car le produit thermodynamique est encore plus stable.
3. Le produit 1,4 est plus stable thermodynamiquement car il y a deux groupes alkyles de chaque côté de la double liaison. Cette forme offre une stabilité à la structure globale.
4. Tous ces isomères sont viables.
5. D
6. C
7. D
8. A
9. D
Contributeurs
-
William Reusch, Professeur émérite (Michigan State U.), Manuel Virtuel de Chimie Organique
-
Jean-Pierre (Chemguide.co.uk)
- Natasha Singh