Article
John Plante*, Chelsea Eason, Alan Snyder, Dirk Elston
Département de Dermatologie et de Chirurgie Dermatologique, Université médicale de Caroline du Sud, Charleston, Caroline du Sud
Le lichen planopilaire (LPP) est une cicatrice primaire alopécie caractérisée par un prurit, une sensibilité, des épines folliculaires et un érythème dans la phase active1-3. Bien que l’étiologie précise soit inconnue, la pathogenèse implique une inflammation chronique médiée par les lymphocytes qui peut finalement entraîner une perte de cheveux irréversible et cicatrisante par sa destruction sélective du follicule pileux.1,2. Trois variantes de LPP existent et comprennent la forme classique, l’alopécie fibrosante frontale (FFA) et le syndrome de Graham-Little-Piccardi-Lassueur (alopécie progressive du cuir chevelu, des aisselles, des sourcils et du pubis)2. La LPP s’avère souvent réfractaire aux thérapies standard et suit une évolution imprévisible et récurrente, conduisant fréquemment à une qualité de vie gravement diminuée1,2,4,5. Nous discutons ici de notre étude récente concernant l’utilisation du tofacitinib dans le traitement de la LPP6 récalcitrante.
De nombreux traitements ont été utilisés pour traiter la LPP avec un succès variable 1-3,5,7-9. Étant donné que les traitements actuellement disponibles ne conduisent généralement pas à la repousse des cheveux, la prise en charge vise à réduire le taux de perte de cheveux, à contrôler les symptômes et à réduire l’inflammation2,9. Les traitements de première intention comprennent des corticostéroïdes topiques intralésionnels et à haute puissance, mais ceux-ci peuvent entraîner une atrophie du cuir chevelu et compromettre le succès d’une future greffe de cheveux. D’autres agents topiques présentent moins de risque d’atrophie et comprennent les inhibiteurs de la calcineurine tacrolimus et pimécrolimus2. Bien qu’il ne contrôle pas le processus inflammatoire sous–jacent, le minoxidil topique et oral peut également être utilisé pour maximiser la repousse des cheveux chez les patients qui souffrent également d’alopécie héréditaire – près de 50% de la population9,10. Les traitements systémiques supplémentaires comprennent l’hydroxychloroquine, le mycophénolate mofétil, la cyclosporine, le méthotrexate, la thalidomide, la doxycycline, les rétinoïdes, la pioglitazone, les inhibiteurs de la 5-alpha réductase et la prednisolone à court terme1,2,9. Des études récentes ont suggéré le potentiel de naltrexone orale à faible dose, d’injections de plasma riche en plaquettes et d’interventions non pharmacologiques telles que le laser excimère, mais aucune n’a été uniformément efficace5,7,8. Bien que les morceaux de cheveux et les extensions puissent augmenter le volume et couvrir les zones alopéciques, il faut faire preuve de prudence pour éviter la traction9.
Dans une étude récemment publiée, nous avons étudié le potentiel des formulations topiques et orales (systémiques) de tofacitinib6. Le tofacitinib est un inhibiteur de la Janus kinase (JAK) 1/3 efficace contre plusieurs affections dermatologiques à médiation immunitaire, notamment la dermatite atopique, l’alopécie areata et le vitiligo11-14. Son activité immunomodulatrice est médiée par l’inhibition de la voie de signalisation JAK/stat12,13. Dans la LPP, les interférons ont été impliqués dans la facilitation du recrutement lymphocytaire et la perte du privilège immunitaire des cellules épithéliales bombées1. Grâce aux effets du tofacitinib sur la voie JAK/ STAT, cette inflammation médiée par l’interféron peut être réduite, améliorant ainsi les symptômes et empêchant une destruction folliculaire ultérieure.1,11-13.
Nous avons exploré le potentiel thérapeutique du tofacitinib dans le traitement de la LPP réfractaire par le biais d’une revue rétrospective6. À la connaissance des auteurs, il s’agit de la deuxième étude portant sur l’utilisation du tofacitinib dans la gestion des LPP1. Notre étude a inclus neuf patients qui avaient échoué à un autre traitement – trois ont utilisé une formule topique, cinq par voie orale et un a utilisé les deux formulations.
Une réponse initiale favorable a été obtenue chez tous les patients sauf un. Le sujet restant a mal répondu au traitement topique mais s’est amélioré avec le traitement systémique au tofacitinib. Bien que le nombre absolu de patients soit faible, il y avait une tendance à une meilleure réponse clinique chez les patients sous traitement systémique par rapport à ceux sous traitement topique. Le délai de réponse favorable variait de 1 à 7 mois, 5 et 8 patients présentant une amélioration au cours des 3 et 5 premiers mois de traitement, respectivement.
Notre schéma de pratique actuel consiste à traiter la maladie à évolution rapide avec une courte cure de prednisone ou de cyclosporine, puis à essayer de passer à un traitement topique par inhibiteur de la calcineurine lorsque cela est possible (figure 1). Un sous-ensemble de patients obtiendra une rémission de leur maladie avec de la pioglitazone à des doses de 15 à 45 mg par jour. Les patients doivent être informés de l’indication étiquetée, des données mixtes concernant l’efficacité et des mises en garde en boîte contre le cancer de la vessie en cas d’utilisation prolongée. Notre pratique est de ne pas continuer la pioglitazone après un maximum de 9 mois avec des doses croissantes par incréments. Les agents d’appoint comprennent la naltrexone à une dose de 5 mg par jour et la N-acétylcystéine à des doses de 600 à 1200 mg trois fois par jour. Le laser excimer, les UVB à bande étroite à main ou la thérapie par capuchon laser à faible intensité sont souvent utilisés comme thérapie d’appoint chez les personnes ayant une réponse partielle. L’hydroxychloroquine peut parfois être bénéfique, mais la plupart des patients référés à notre clinique ont déjà échoué au traitement par l’hydroxychloroquine. Ceux qui ne répondent pas peuvent nécessiter un traitement au méthotrexate, au mycophénolate mofétil ou au tofacitinib. Les résultats de notre étude récente renforcent l’idée que le tofacitinib topique et systémique peut être des modalités de traitement d’appoint viables dans les cas réfractaires. Les troubles capillaires réagissent souvent lentement, et nous réévaluons à intervalles de 3 mois pour déterminer la réponse au traitement et le besoin d’escalade.
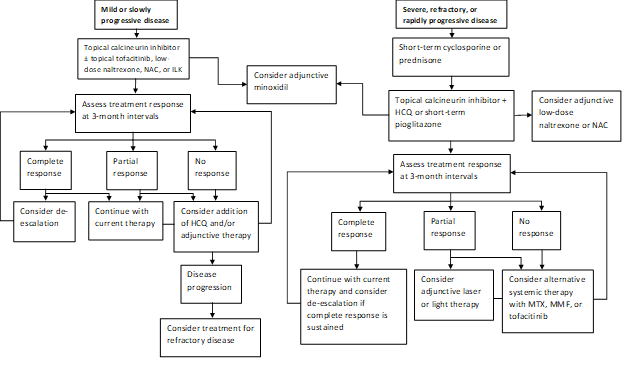
Figure 1: Algorithme de traitement par étapes pour le LPP
NAC, N-acétylcystéine; ILK, corticostéroïdes intralésionnels; HCQ, hydroxychloroquine; MTX, méthotrexate, MMF, mycophénolate mofétil
Lors de l’examen de l’utilisation du tofacitinib en pratique, les praticiens doivent équilibrer les avantages de ce médicament avec ses risques. Notre cohorte n’a présenté que des anomalies de laboratoire mineures (une sur un traitement topique et deux sur un traitement systémique) qui n’ont pas nécessité d’intervention. Cependant, les fournisseurs doivent être conscients des effets secondaires potentiels lors de la prescription de ce médicament, y compris un risque accru d’infection, de cytopénies, d’hyperlipidémie, d’anomalies hépatiques et rénales, ainsi que le risque d’événements thromboemboliques 14-16. Bien que la formulation topique ait montré des concentrations plasmatiques plus faibles que son homologue systémique, des événements indésirables mineurs et des anomalies de laboratoire ont toujours été rapportés avec un traitement topique13.
Bien que nos résultats soient prometteurs, ils doivent être interprétés après avoir pris en compte plusieurs limites. Nous avons utilisé un plan d’étude rétrospective et n’avons pas été en mesure d’utiliser une mesure validée de la gravité de la maladie telle que l’Indice d’activité Lichen Planopilaris (IPPL) 1,3. Le LPPAI est adapté aux études prospectives et fournit un outil standardisé grâce auquel les prestataires peuvent comparer directement les résultats entre différentes modalités de traitement. Des signes et symptômes tels que l’érythème, la sensibilité, la présence d’épines folliculaires et la zone touchée ont été utilisés pour évaluer la réponse thérapeutique, mais les études futures devraient également inclure une mesure de la qualité de vie. La possibilité d’un biais de l’observateur ne peut être exclue car notre étude n’a pas été aveugle et non randomisée.
De plus, toute notre cohorte a utilisé le tofacitinib en association, ce qui rend difficile l’évaluation de la contribution indépendante du médicament. Dans une étude antérieure, une partie (N = 5) de la cohorte a utilisé le tofacitinib en monothérapie, et la plupart des sujets ont obtenu des résultats favorables, mais cette étude a également été limitée par sa petite taille d’échantillon et son plan rétrospective1.
Les études actuelles sont limitées par leur petite taille d’échantillon et leur conception d’études rétrospectives, et des études prospectives bien conçues sont grandement nécessaires. Nous conseillons une approche progressive du traitement pour minimiser le risque d’effets indésirables. Le risque de cicatrisation permanente doit être mis en balance avec le risque d’événements indésirables graves à la lumière des facteurs individuels du patient et des comorbidités, et les patients doivent être des partenaires actifs dans la prise de décision. Une greffe de cheveux peut être envisagée une fois que le contrôle de la maladie a été atteint et que l’inflammation a disparu. Il est important de noter qu’un traitement agressif tel que la prednisone ou la cyclosporine est généralement nécessaire pendant les semaines suivant la transplantation pour éviter les poussées de maladie. Une attrition progressive des poils transplantés est à prévoir, même après une transplantation réussie, mais les données suggèrent que les patients sont généralement satisfaits des résultats et constatent que la transplantation améliore la qualité de vie.
Abréviations
LPP, lichen planopilaris; FFA, alopécie fibrosante frontale; JAK, Janus kinase; STAT, transducteur de signal et activateur des protéines de transcription; LPPAI, Indice d’activité du lichen Planopilaris.
Conflits d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts.
- Yang CC, Khanna T, Sallee B, et al. Tofacitinib pour le traitement du lichen planopilaris: Une série de cas. Dermatol Ther. 2018; 31(6): e12656. doi: 10.1111/ srd.12656
- Babahosseini H, Tavakolpour S, Mahmoudi H, et al. Lichen planopilaris: étude rétrospective sur les caractéristiques et le traitement de 291 patients. J Traitement dermatologique. 2019; 30(6): 598–604. doi:10.1080/09546634.2018.1542480
- Chiang C, Sah D, Cho BK, et al. Hydroxychloroquine et lichen planopilaris: efficacité et introduction du système de notation de l’indice d’activité Lichen Planopilaris. J Am Acad Dermatol. 2010; 62(3): 387-392. doi: 10.1016/ j. jaad.2009.08.054
- Alirezaei P, Ahmadpanah M, Rezanejad A, et al. Par rapport aux Témoins, les personnes atteintes de Lichen Planopilaris Ont Plus de Dépression, une Estime de Soi Inférieure et une Qualité de Vie Inférieure. Neuropsychobiologie. 2019; 78(2): 95-103. doi:10.1159/000499135
- Jai AK. Plasma riche en plaquettes comme traitement d’appoint chez le lichen planopilaris. J Am Acad Dermatol. 2019; 80(5): e109-e110. doi: 10.1016/ j. jaad.2018.09.013
- Plante J, Eason C, Snyder A, et al. Tofacitinib dans le traitement du lichen planopilaris: une revue rétrospective. J Am Acad Dermatol. 2020; S0190-9622 (20) 30979-8. doi:10.1016 / j. jaad.2020.05.104
- Lajevardi V, Salarvand F, Ghiasi M, et al. L’efficacité et l’innocuité de la naltrexone à faible dose par voie orale par rapport au placebo chez les patients atteints de lichen planopilaris: un essai clinique contrôlé randomisé. J Traitement dermatologique. 2020; 1-5. doi:10.1080/09546634.2020.1774488
- Lee D, Elston DM. Les utilisations de la naltrexone dans des conditions dermatologiques. J Am Acad Dermatol. 2019; 80(6): 1746-1752. doi: 10.1016/ j. jaad.2018.12.031
- Bolduc C, Sperling LC, Shapiro J. Alopécie cicatricielle primaire: Alopécies cicatricielles primaires lymphocytaires, y compris le lupus érythémateux cutané chronique, le lichen planopilaire, l’alopécie fibrosante frontale et le syndrome de Graham-Little. J Am Acad Dermatol. 2016; 75(6): 1081-1099.
- Vano-Galvan S, Trindade de Carvalho L, Saceda-Corralo D, et al. Le minoxidil oral améliore l’épaisseur des cheveux de fond chez le lichen planopilaris. J Am Acad Dermatol. 2020; S0190-9622 (20) 30566-1. doi: 10.1016/ j. jaad.2020.04.026
- Tegtmeyer K, Zhao J, Maloney NJ, et al. Études hors étiquette sur le tofacitinib en dermatologie: une revue. J Traitement dermatologique. 2019; 1–11. doi: 10.1080/09546634.2019.1673877
- Montilla AM, Gomez-Garcia F, Gomez-Arias PJ, et al. Examen de la portée de l’utilisation de Médicaments Ciblant la voie JAK / STAT dans la Dermatite Atopique, le Vitiligo et l’Alopécie Areata. Dermatol Ther (Heidelb). 2019; 9(4): 655–683. doi: 10.1007/s13555-019-00329- y
- Hosking AM, Juhasz M, Mesinkovska NA. Inhibiteurs topiques de la Janus kinase: Examen des applications en dermatologie. J Am Acad Dermatol. 2018; 79(3): 535–544. doi: 10.1016/ j. jaad.2018.04.018
- Shreberk-Hassidim R, Ramot Y, Zlotogorski A. Inhibiteurs de la kinase de Janus en dermatologie: Une revue systématique. J Am Acad Dermatol. 2017; 76(4): 745-753.e19. doi: 10.1016/ j. jaad.2016.12.004
- Xeljanz/Xeljanz XR (tofacitinib). New York, NY : Division des Laboratoires Pfizer de Pfizer Inc. https://labeling.pfizer.com/showlabeling.aspx?id=959; 2019. Consulté le 7 juillet 2020.
- FDA. Un essai de sécurité révèle un risque de caillots sanguins dans les poumons et de décès avec une dose plus élevée de tofacitinib (Xeljanz, Xeljanz XR) chez les patients atteints de polyarthrite rhumatoïde; La FDA doit enquêter. https://www.fda.gov/drugs/drug-safety-and-availability/safety-trial-finds-risk-blood-clots-lungs-and-death-higher-dose-tofacitinib-xeljanz-xeljanz-xr; 2019. Consulté le 6 juillet 2020.