Bloc Nerveux Intercostal – Repères et Technique de Stimulateur Nerveux
Anthony M.-H. Ho, Robbert Buck, Malikah Latmore, Matthew Levine et Manoj K. Karmakar
INTRODUCTION
Les nerfs intercostaux (NCI) innervent les principales parties de la peau et de la musculature de la paroi thoracique et abdominale . Le bloc de ces nerfs a été décrit pour la première fois par Braun en 1907 dans le manuel Die Lokalanastesie. Dans les années 1940, les cliniciens ont remarqué que les blocs nerveux intercostaux (ICNBs) peuvent réduire les complications pulmonaires et les besoins en opioïdes après une chirurgie abdominale supérieure. En 1981, l’ICNB continu a été introduit pour surmonter les problèmes associés aux injections multiples répétées. Aujourd’hui, l’ICNB est utilisé dans une variété de conditions de douleur aiguë et chronique affectant le thorax et le haut de l’abdomen, y compris la chirurgie du sein et de la paroi thoracique. L’introduction du guidage par ultrasons à la pratique de l’anesthésie régionale facilite encore sa pratique. Les inconvénients du bloc intercostal, cependant, incluent l’exigence d’expertise technique, les risques de pneumothorax et la toxicité anesthésique locale avec plusieurs niveaux de blocage.
INDICATIONS
L’ICNB fournit une excellente analgésie chez les patients présentant des fractures des côtes et pour les douleurs post-chirurgicales après une chirurgie thoracique et abdominale supérieure telles que thoracotomie, thoracostomie, mastectomie, gastrostomie et cholécystectomie. Les paramètres respiratoires montrent généralement des améliorations impressionnantes sur le soulagement de la douleur. Le blocage des deux dermatomes au-dessus et des deux en dessous du niveau de l’incision chirurgicale est nécessaire. L’ICNB ne bloque pas les douleurs abdominales viscérales, pour lesquelles un bloc de plexus coeliaque est nécessaire. L’ICNB neurolytique est utilisé pour gérer les conditions de douleur chronique telles que la douleur postmastectomie (T2) et la douleur postthoracotomie.
CONTRE-INDICATIONS
- Troubles de la coagulation, bien que ce ne soit pas une contre-indication absolue
- Infection locale, manque d’expertise et d’équipement de réanimation
ANATOMIE FONCTIONNELLE
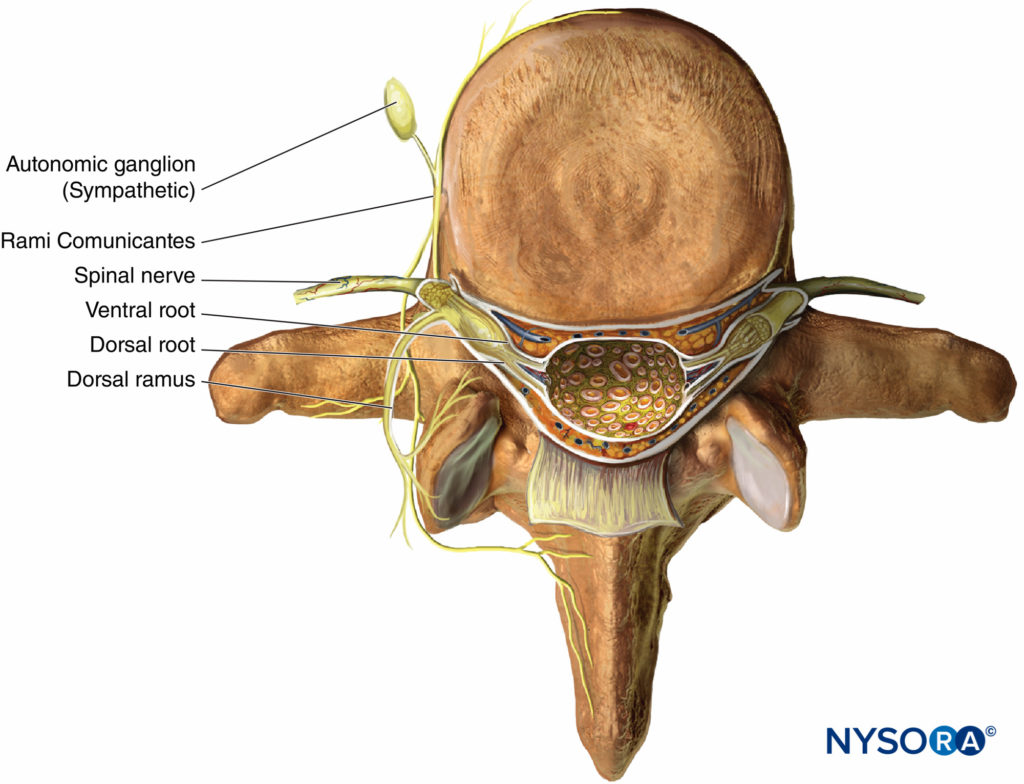
Lorsque les nerfs thoraciques T1 à T12 émergent de leurs foramines intervertébrales respectives, ils se divisent en rami suivants (Figure 1):
- Les rami communicantes antérieures grises et blanches appariées, qui passent antérieurement au ganglion sympathique et à la chaîne.
- Le ramus cutané postérieur, alimentant la peau et le muscle dans la région paravertébrale.
- Le ramus ventral (ICN, l’objet principal de ce chapitre).
T1 et T2 envoient des fibres nerveuses aux membres supérieurs et au thorax supérieur, T3 à T6 alimentent le thorax, T7 à T11 alimentent le thorax inférieur et l’abdomen, et T12 innerve la paroi abdominale et la peau de la partie antérieure de la région fessière (figure 2).

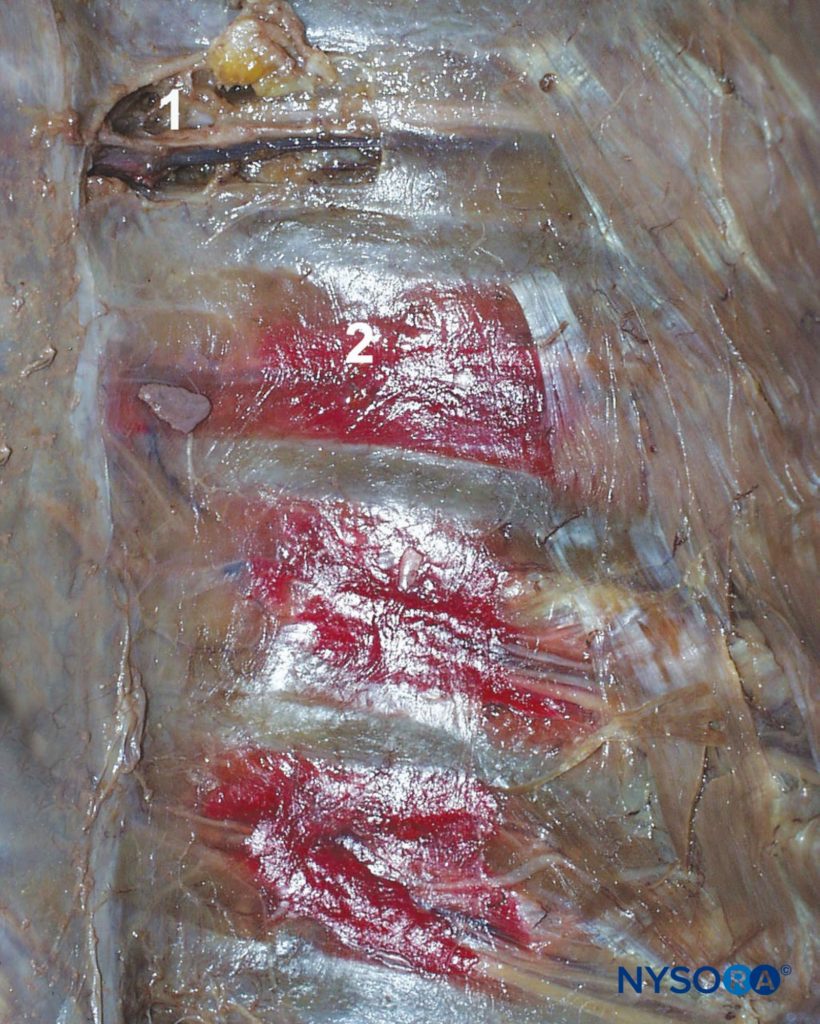
Portant à la fois des fibres sensorielles et motrices, l’ICN perce la membrane intercostale postérieure d’environ 3 cm (chez l’adulte) distale du foramen intervertébral pour pénétrer dans le bosquet sous-costal où, pour la plupart, il continue de courir parallèlement à la côte, bien que des branches puissent souvent se trouver n’importe où entre les côtes adjacentes. Son cours dans le thorax est pris en sandwich entre la plèvre pariétale et les muscles intercostaux les plus internes (intercostalis intimus) et les muscles intercostaux externes et internes (Figures 3 et 4). Juste en avant de la ligne midaxillaire, il dégage la branche cutanée latérale. Lorsque l’ICN s’approche de la ligne médiane, il tourne vers l’avant et perce les muscles et la peau sus-jacents pour se terminer par la branche cutanée antérieure.
Cependant, il existe de nombreuses variations anatomiques. Le premier nerf thoracique (T1) n’a pas de branche cutanée antérieure, n’a généralement pas de branche cutanée latérale, et la plupart de ses fibres quittent l’espace intercostal en traversant le col de la première côte pour rejoindre celles de C8, tandis qu’un faisceau plus petit continue sur un véritable parcours intercostal pour alimenter les muscles de l’espace intercostal. Certaines fibres de T2 et T3 donnent naissance au nerf intercostobrachie, qui innerve l’aisselle et la peau de l’aspect médial du bras jusqu’au coude. De plus, le ramus ventral de T12 est similaire aux autres NCI mais est appelé nerf sous-costal car il n’est pas positionné entre deux côtes.

Branche cutanée latérale
Les branches cutanées latérales de T2 à T11 percent obliquement les muscles intercostaux interne et externe avant de se diviser en branches antérieure et postérieure (voir Figure 4). Ces branches alimentent les muscles et la peau du torse latéral. Les branches antérieures alimentées en T7–T11 innervent la peau aussi loin vers l’avant que le bord latéral du droit abdominal. Les branches postérieures de T7–T11 alimentent la peau recouvrant le latissimus dorsi. La branche cutanée latérale de T12 ne se divise pas. La majeure partie du ramus ventral de T12 rejoint celui de L1 pour former les nerfs iliohypogastrique, ilioinguinal et génito-fémoral; le reste perce le muscle abdominal transverse (TAM) pour se déplacer entre TAM et le muscle oblique interne.
Branche cutanée antérieure
Les branches cutanées antérieures de T2 à T6 percent les muscles intercostaux externes et pectoraux majeurs pour pénétrer dans le fascia superficiel près de la bordure latérale du sternum pour alimenter la peau de la partie antérieure du thorax près de la ligne médiane et légèrement au-delà (voir Figure 4). Des branches plus petites (T1 à T6) existent pour alimenter les muscles intercostaux et la plèvre pariétale, et ces branches peuvent se croiser vers des espaces intercostaux adjacents. Les branches cutanées antérieures de T7 à T12 percent la gaine rectale postérieure pour fournir des nerfs moteurs au muscle rectal et des fibres sensorielles à la peau de la paroi abdominale antérieure. Certaines branches finales de T7 à T12 se poursuivent antérieurement et, avec L1, innervent le péritoine pariétal de la paroi abdominale. Leur parcours antérieur se poursuit et devient superficiel près de la linea alba pour fournir une innervation cutanée à la ligne médiane de l’abdomen et quelques centimètres au-delà. Pour plus d’informations, voir Anatomie de l’anesthésie régionale fonctionnelle.
MÉCANISME DE BLOCAGE ET DE DISTRIBUTION DE L’ANESTHÉSIE
L’ICNB bloque les fibres sensorielles et motrices ipsilatérales des ICN. La solution anesthésique locale injectée dans le sillon sous-costal se propage à la fois distalement et proximalement; une partie de l’injectat peut également pénétrer dans l’espace paravertébral. (voir Figure 3).
TECHNIQUE
Une ligne intraveineuse doit être établie et des médicaments de réanimation doivent être facilement disponibles. La sédation et l’analgésie sont toujours utilisées judicieusement. L’ICNB peut être réalisée chez un patient anesthésié, bien qu’une anesthésie rachidienne ait été rapportée chez des patients lorsque l’ICNB a été réalisée sous anesthésie générale, et il est à craindre que le risque de pneumothorax puisse être augmenté chez un patient sous ventilation à pression positive. Après le blocage, le patient doit être surveillé pour des complications potentielles, en particulier un pneumothorax retardé, une toxicité anesthésique locale, un hématome et la survenue d’une anesthésie rachidienne (rare).
L’ICN peut être bloqué n’importe où à proximité de la ligne midaxillaire, là où la branche cutanée latérale décolle. Chez l’enfant, le bloc est généralement réalisé au niveau de la ligne axillaire postérieure ou, alternativement, juste latéralement aux muscles paraspinaux, à l’angle de la côte. Chez l’adulte, le site le plus fréquent de l’ICNB se situe à l’angle de la côte (6 à 8 cm des apophyses épineuses; Figure 5). À l’angle de la côte, la côte est relativement superficielle et facile à palper, et la rainure sous-costale est la plus large. Le nerf est inférieur à l’artère intercostale postérieure, qui est inférieure à la veine intercostale (Figure 6) (mnémonique: VAN). Les VAN sont entourés de tissu adipeux et sont pris en sandwich entre les muscles inter-costaux internes et les muscles intercostaux intérieurs (intercostalis intimus). Le nerf se présente souvent sous la forme de trois ou quatre faisceaux séparés, sans gaine endoneurale enveloppante, ce qui le rend facilement accessible au blocage. Le blocage des nerfs intercostaux médiaux à l’angle de la côte n’est pas recommandé car les nerfs se trouvent profondément à la membrane intercostale postérieure avec très peu de tissu entre elle et la plèvre pariétale, et le muscle sacro-épineux sus-jacent rend la palpation des côtes difficile. D’autre part, le blocage distal de la ligne axillaire antérieure est plus difficile car le nerf a quitté le sillon sous-costal et est rentré dans l’espace intercostal et se trouve dans la substance du muscle intercostal interne.
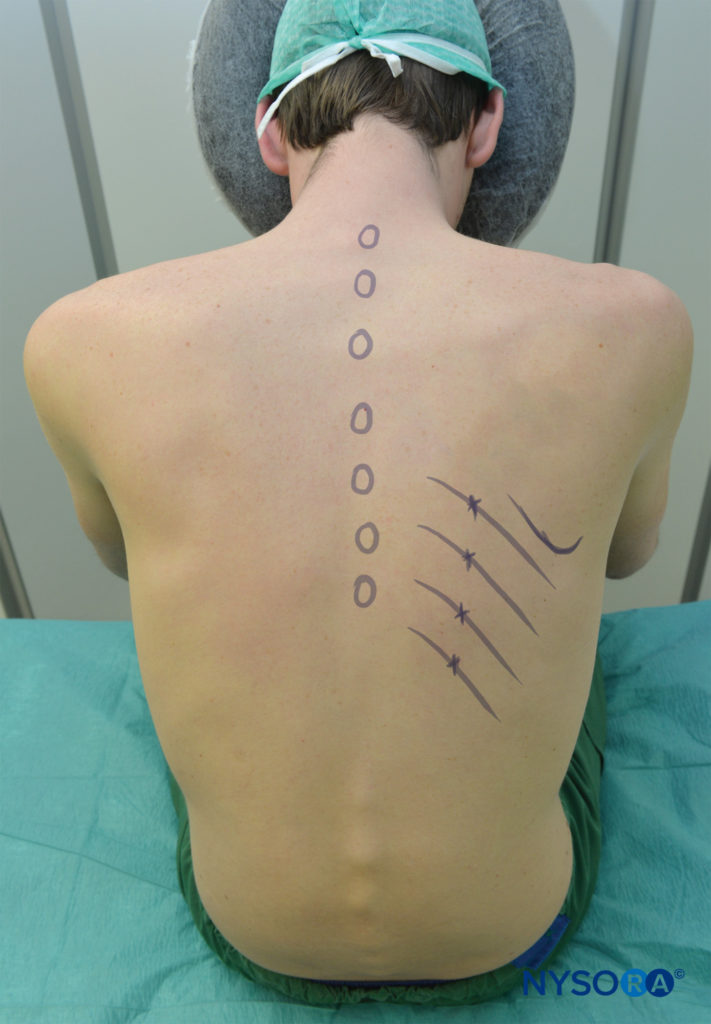
L’ICNB peut être réalisée avec le patient en position couchée, assise ou latérale (côté bloc vers le haut). En position couchée, un oreiller doit être placé sous le haut de l’abdomen du patient et les bras peuvent être suspendus sur les côtés. Le patient assis doit se pencher légèrement en avant en tenant un oreiller et être soutenu. Les bras doivent être en avant. La position du bras dans l’une ou l’autre position est de tirer les omoplates latéralement et de faciliter l’accès aux angles de côtes postérieurs au-dessus de T7 (voir Figure 5). Dans des conditions aseptiques, les sites de blocs sont identifiés.
Pointes de NYSORA
- Les côtes peuvent être comptées à partir de la douzième côte ou de la septième côte (pointe inférieure de l’omoplate).
- Les bords inférieurs des côtes à bloquer sont marqués juste latéralement à la bordure latérale du groupe musculaire sacrospinal (paraspineux) (généralement à 6-8 cm de la ligne médiane au niveau des côtes inférieures et à 4-7 cm de la ligne médiane au niveau des côtes supérieures), correspondant aux angles des côtes.
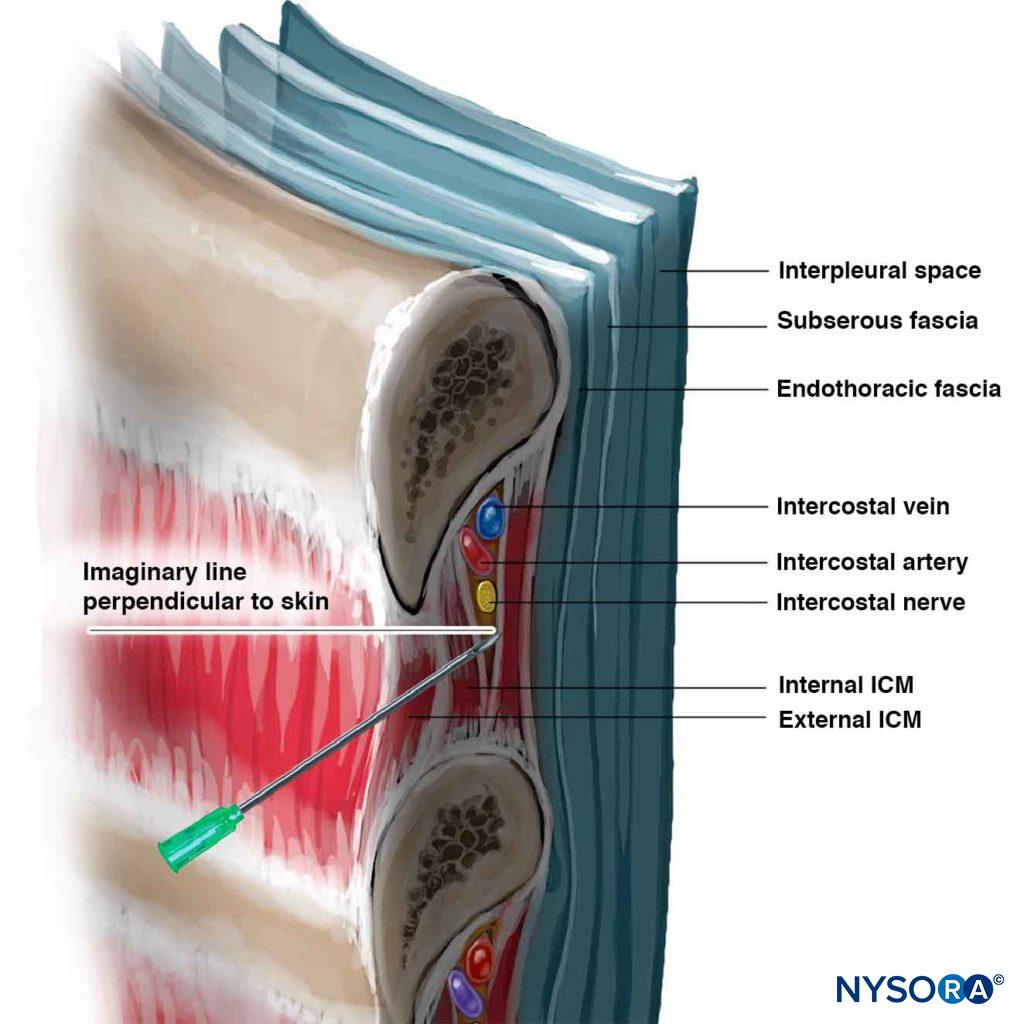
Les bords inférieurs des côtes à bloquer sont palpés et marqués (voir Figure 5). Les sites d’entrée de l’aiguille sont infiltrés avec de la lidocaïne à 1% -2%. Un site d’entrée est bien placé lorsqu’une aiguille introduite à travers celui-ci à 20 degrés céphalade (plan sagittal; voir Figure 6) gratte sous la bordure inférieure de la nervure et atteint le sillon sous-costal. La peau est d’abord tirée céphalade avec la main palpante d’environ 1 cm, et une aiguille de calibre 22 à 24 de 4 à 5 cm (pour l’injection à un seul coup) est introduite à travers le site d’entrée choisi à un angle de céphalade de 20 degrés avec le céphalade biseauté faisant face. L’aiguille est avancée jusqu’à ce qu’elle entre en contact avec la côte à une profondeur inférieure à 1 cm chez la plupart des patients. Une petite quantité d’anesthésique local peut être injectée pour anesthésier le périoste. La main palpant tenant fermement l’aiguille et reposant solidement sur le dos du patient, la main injectante « marche » doucement l’aiguille caudalement pendant que la peau est autorisée à revenir sur la côte (figure 7).

L’aiguille est maintenant avancée de quelques mm, tout en maintenant l’angle d’inclinaison de 20 degrés céphalade (même un léger angle de pointage par l’aiguille réduit considérablement les chances de succès). Un subtil « donner » ou « pop » du fascia du muscle intercostal interne peut être ressenti, surtout si une aiguille à biseau court est utilisée. Comme la distance moyenne entre la face postérieure de la côte et la plèvre est de 8 mm en moyenne, l’avancement de l’aiguille bien au-delà de quelques mm augmente le risque de pneumothorax. La paresthésie, bien qu’elle ne soit pas activement recherchée, constitue parfois une confirmation supplémentaire du placement correct de l’aiguille. Un guidage radiologique est conseillé pour les blocs neurolytiques. À ce stade, lors d’une aspiration négative de sang, 3 à 5 mL d’anesthésique local sont injectés. Pour un seul ICNB, il est souhaitable de bloquer au moins un céphalade ICN et un caudad car un certain degré d’innervation chevauchante des ICN adjacents est courant. Pour s’assurer que la pointe de l’aiguille reste à l’emplacement optimal, sans être affectée par les mouvements de la main et de la poitrine, certains cliniciens préfèrent connecter un tube d’extension entre l’aiguille et la seringue et demander à un assistant d’effectuer l’aspiration et l’injection.
Le blocage de T1 à T7 est techniquement plus difficile en raison des omoplates et des muscles rhomboïdes. Pour cette raison, nous préférons effectuer un bloc paravertébral thoracique ou un bloc épidural lorsqu’un blocage thoracique élevé est requis.
ÉQUIPEMENT
- Aiguille: Coup unique: Aiguille de 4 à 5 cm de calibre 20 à 22 (adultes)
- Placement du cathéter: Aiguille Tuohy de calibre 18 à 20 (adultes)
- Seringue et aiguille pour infiltration locale
- Seringue avec tube d’extension
- Équipement de stérilisation et de réanimation et médicaments, rideaux, stylo de marquage, oreiller, fluoroscope portable (pour blocs neurolytiques)
En savoir plus sur l’équipement pour les blocs nerveux périphériques.
CHOIX DE L’ANESTHÉSIQUE LOCAL
Le choix de l’anesthésique local pour l’ICNB à injection unique comprend la bupivacaïne 0,25% -0.5%, lidocaïne 1% -2% avec de l’épinéphrine 1/200 000-1 / 400 000 et de la ropivacaïne 0,5%. Trois à 5 mL d’anesthésique local sont injectés à chaque niveau lors d’une ICNB à injection multiple. La durée d’action est généralement de 12 ± 6 h. L’ajout d’épinéphrine à la bupivacaïne ou à la ropivacaïne ne prolonge pas de manière significative la durée du bloc, mais peut ralentir l’absorption systémique et augmenter la dose maximale admissible avec un seul tir de 30%. La dose maximale de bupivacaïne est de 2 (pour une solution simple) à 3 (avec de l’épinéphrine) mg / kg / injection (total en une seule fois) 7 et 7-10 mg / kg / jour. La dose maximale de lidocaïne peut aller jusqu’à 5-7 (avec l’épinéphrine) mg / kg / injection7 et 20 mg / kg / jour. Les volontaires pourraient tolérer 30% plus de ropivacaïne que de bupivacaïne avant que les symptômes neurologiques ne se développent. La dose maximale d’injection unique pour la ropivacaïne est de 2,5 mg / kg et de 4 mg / kg avec l’épinéphrine, tandis que la dose quotidienne maximale est de 9 à 12 mg / kg / 24 h. L’injection unique maximale d’épinéphrine en tant qu’additif est de 4 mcg / kg. Les sites vasculaires favorisent une absorption anesthésique locale plus rapide, et les taux sanguins d’anesthésiques locaux après ICNB sont plus élevés que pour la plupart des autres procédures anesthésiques régionales. En tant que tel, il est conseillé de laisser une marge de sécurité entre les doses administrées et les doses maximales recommandées, en particulier chez les jeunes enfants; les personnes âgées; les patients affaiblis; et ceux présentant une insuffisance cardiaque, hépatique ou rénale sous-jacente. Pour une perfusion continue, les patients peuvent généralement mieux tolérer une accumulation progressive du niveau d’anesthésique local plasmatique que des augmentations aiguës. Un schéma thérapeutique recommandé est une dose de charge de 0,3 mL / kg suivie d’une perfusion de 0,1 mL / kg / h de bupivacaïne à 0,25% ou de lidocaïne à 1%.
Pointes de NYSORA
- Le meilleur site d’insertion de l’aiguille pour l’ICNB est l’angle de la côte, d’environ 7 cm de côté par rapport à la ligne médiane chez l’adulte.
- L’angle idéal d’entrée dans la rainure sous-costale est d’environ 20 degrés céphalade.
- L’analgésie épidurale peut être une alternative mieux adaptée aux ICNB bilatéraux en raison du risque de pneumothorax bilatéral et du potentiel de toxicité anesthésique locale en raison de la forte dose d’anesthésique local requise.
- ICNB au-dessus de T7 peut être difficile à cause des omoplates; une technique alternative telle que le bloc paravertébral ou épidural doit être envisagée.
COMPLICATIONS
La principale préoccupation est un pneumothorax, qui peut survenir dans environ 1% des cas. Le pneumothorax de tension et le besoin ultérieur de thoracostomie tubulaire sont cependant rares. Si un pneumothorax asymptomatique est détecté, la meilleure prise en charge est l’observation, le réconfort et, si nécessaire, un supplément d’oxygène. Le péritoine et les viscères abdominaux sont à risque de pénétration lorsque les NCI inférieurs sont bloqués. L’absorption de l’anesthésique local de l’espace intercostal est rapide; la concentration plasmatique artérielle atteint un pic en 5 à 10 minutes et la concentration plasmatique veineuse atteint un pic plusieurs minutes plus tard.
RÉSUMÉ
L’ICNB est une technique d’anesthésie régionale utile; qui est très efficace dans le contrôle de la douleur impliquant le thorax et le haut de l’abdomen. Bien qu’il existe un risque de pneumothorax et de toxicité anesthésique locale, ceux-ci peuvent être réduits avec une technique appropriée et en tenant compte de la dose maximale autorisée. L’utilisation appropriée de l’ICNB consiste à équilibrer ses avantages et ses inconvénients par rapport à ceux de techniques alternatives telles que le bloc épidural et paravertébral. Avec une expertise et des indications appropriées, le bloc nerveux intercostal peut fournir une option anesthésique particulièrement appropriée chez les patients chez lesquels les choix d’anesthésie générale ou régionale peuvent être limités.
- Strømskag KE, Kleiven S: Blocages continus des nerfs intercostaux et interpleuraux. Tech Reg Douleur anesthésique Gérer 1998; 2:79-89.
- Karmakar MK, Ho AMH: Prise en charge de la douleur aiguë chez les patients présentant de multiples côtes fracturées. J Trauma 2003; 54:612-615.
- Karmakar MK, Critchley LAH, Ho AMH, et al: Perfusion paravertébrale thoracique continue de bupivacaïne pour la gestion de la douleur chez les patients présentant de multiples côtes fracturées. Poitrine 2003; 123:424-431.
- Kopacz DJ, Thompson GE: Blocs intercostaux pour la chirurgie thoracique et abdominale. Tech Reg Anesthh Pain Gérer 1998; 2:25-29.
- Nunn JF, Slavin G: Bloc nerveux intercostal postérieur pour soulager la douleur après une cholécystectomie. Base anatomique et efficacité. Br J Anaesth 1980; 52:253-60.
- Barron DJ, Tolan MJ, Léa RE: Un essai contrôlé randomisé d’analgésie extra-pleurale continue post-thoracotomie: efficacité et choix de l’anesthésie locale. Eur J Anesthesiol 1999; 16:236-245.
- Lagan G, McLure HA: Examen des agents anesthésiques locaux. Curr Anaesthe Crit Care 2004; 15:247-254.
- Scott DB, Lee A, Fagan D, et al: Toxicité aiguë de la ropivacaïne comparée à celle de la bupivacaïne. Anesthth Analg 1989; 69:563-569.
- Vandepitte C, Gautier P, Bellen P, Murata H, Salviz EA, Hadzic A. Utilisation du bloc nerveux intercostal guidé par ultrasons comme technique anesthésique unique chez un patient à haut risque atteint de dystrophie musculaire de Duchenne. Acta Anesthesiol Belg. 2013;64(2):91-94.