Chromate de potassium
Chromate de potassium Propriétés chimiques, utilisations, production
Composé inorganique
Le chromate de potassium, communément appelé tarapacaite, est un composé inorganique, qui est un cristal orthorhombique ou hexagonal jaune à température ambiante. La densité relative est de 2,732 et le point de fusion est de 968 ° C. Il est toxique et peut se dissoudre dans l’eau pour former une solution d’hydrolyse d’ions chromates alcalins. Et il est insoluble dans l’alcool et l’éther. Après ajout d’acide, la solution jaune de chromate de potassium deviendra orange, qui est la couleur du dichromate. Il y a un équilibre entre la conversion du chromate et du dichromate dans la solution: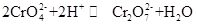
Lorsque l’acide est ajouté à la solution de chromate de potassium, l’équilibre se déplace vers la direction de génération de dichromate de potassium, et lorsque l’alcali est ajouté à la solution de dichromate de potassium, l’équilibre se déplace vers la direction de génération de chromate de potassium. Le chromate de potassium a des propriétés oxydantes et peut réagir avec l’agent réducteur en milieu alcalin pour former du Cr (OH) 4- (à savoir du CrO2-). L’ajout de différentes solutions contenant respectivement de l’ion baryum, de l’ion plomb et de l’ion argent à la solution de chromate de potassium formera le chromate insoluble correspondant: chromate de baryum BaCrO4 (jaune), chromate de plomb pbCrO4 (jaune), chromate d’argent Ag2CrO4 (rouge brique). Et la présence d’ions chromates peut être démontrée par la couleur caractéristique de ces chromates insolubles. Le chromate de potassium peut être utilisé comme réactif analytique, oxydant, mordant, inhibiteur de la rouille des métaux et utilisé pour l’analyse des traces de baryum et d’argent. Il peut également être utilisé comme matières premières de l’industrie du bronzage et de la médecine et d’autres composés du chrome. La poudre de chromite Fe (CrO2) 2 peut être utilisée comme matière première et calcinée avec de l’hydroxyde de potassium, du calcaire (dolomie) dans l’air, puis extraite avec une solution de sulfate de potassium pour obtenir du chromate de potassium.
Les informations ci-dessus sont éditées par Xiao Nan de Chemicalbook.
Méthode indicatrice du chromate de potassium
La méthode indicatrice du chromate de potassium, également connue sous le nom de Moore (Mohr), est une méthode de titrage par précipitation (méthode de l’argent) qui utilise le chromate de potassium (K2CrO4) comme indicateur et le nitrate d’argent (AgNO3) comme solution étalon. Cette méthode est principalement utilisée pour la détermination de l’ion chlore (Cl-) ou de l’ion bromure (Br-). Ajouter une petite quantité de K2CrO4 comme indicateur avant d’indiquer la détermination, puis titrer avec la solution standard AgNO3. Après le début du titrage, le précipité de blanc (chlorure d’argent) ou de jaune pâle (bromure d’argent) précipite en premier. Lorsque Cl- ou Br- précipite quantitativement, un peu d’excès de solution de nitrate d’argent entraînera une augmentation soudaine de la concentration d’Ag+ pour générer immédiatement une précipitation de chromate d’argent rouge brique (Ag2CrO4), indiquant le point final de titrage. La quantité d’indicateur et l’acidité de la solution sont deux problèmes majeurs de cette méthode de titrage. Si la concentration en K2CrO4 est trop élevée, la couleur de la solution de titrage sera trop profonde pour empêcher l’observation de la couleur de précipitation d’Ag2CrO4 à la fin; si la concentration en K2CrO4 est trop faible, une quantité excessivement considérable de solution de nitrate d’argent sera nécessaire après la précipitation quantitative de l’halogénure d’argent pour générer une précipitation de chromate d’argent pour indiquer le point final de titrage, ce qui entraînera une augmentation de l’erreur de titrage. Lorsque la solution AgNO3 à 0,1 mol/l est utilisée pour titrer le 0.halogénure de 1mol / l, si la concentration de K2CrO4 est de 5 × 10-3mol / l, l’erreur du point final n’est que de + 0,06%, ce qui peut être considéré que la précision du résultat de l’analyse n’est pas affectée. La méthode indicatrice K2CrO4 ne peut pas être réalisée en solution acide ou alcaline, car K2CrO4 sera converti en dichromate de potassium (K2Cr2O7) à une faible valeur de pH, et Ag + précipitera sous forme d’oxyde d’argent (Ag2O) lorsque le pH est trop élevé. Généralement, la plage d’acidité appropriée est pH = 6,5 ~ 10,5, mais lorsqu’il y a des sels d’ammonium en solution, l’acidité de la solution pH = 6,5 ~ 7,2 est appropriée.
La méthode indicatrice du chromate de potassium ne peut être utilisée que pour le titrage direct des ions Cl- ou Br-, et le résultat du titrage est leur total lors de la coexistence. Cette méthode ne convient pas pour la détermination de l’ion iodure (I-) ou de l’ion thiocyanate (SCN-), car ils sont trop facilement absorbés par sédimentation et le point final n’est pas clair. Cette méthode ne convient pas non plus pour titrer Ag + avec du Cl-, mais Ag + peut être déterminé en utilisant le titrage arrière, à savoir ajouter une quantité excessive de solution étalon NaCl dans la solution d’essai, puis utiliser une solution étalon AgNO3 pour titrer l’excès d’ions Cl-. Dans la solution, tous les cations pouvant former des précipités avec CrO2-4 ou les anions pouvant précipiter avec Ag+ interféreront avec la détermination. La méthode indicatrice du chromate de potassium est principalement utilisée pour la détermination des ions Cl-en solution très diluée, comme la détermination du Cl- dans l’eau potable et les impuretés des produits industriels.
dichromate de potassium
Le dichromate de potassium, également connu sous le nom de potassium d’alun rouge, est un cristal triclinique rouge orangé ou un cristal en forme d’aiguille. La densité est de 2,676 g / cm3. La température de fusion est de 398 °C. Il est soluble dans l’eau et insoluble dans l’éthanol. Il a une forte propriété oxydante et se décompose à 1300 ° C.
En production, le dichromate de potassium est toujours utilisé pour introduire du chrome afin de colorer l’émail lors de la fusion. C’est l’agent colorant du glaçage jaune au lait de titane coloré et du glaçage jaune au titane, et le dosage utilisé est généralement de 0,06% à 0,12%. Le dichromate de potassium et l’oxyde de cuivre peuvent également être mélangés pour obtenir un glaçage vert, vert bambou, vert fruit et autre. Cependant, ces glaçures colorées sont généralement moins brillantes du fait de l’influence du chromate.
La glaçure de couleur obtenue à partir d’oxyde de chrome ou de dichromate de potassium (sodium) est souvent jaune-vert en raison du changement de valence des ions chrome dans le processus de fusion. Le dichromate de potassium est également couramment utilisé pour fabriquer divers pigments verts et des pigments roses.
Le dichromate de potassium doit atteindre les objectifs requis: teneur en dichromate de potassium ≥ 99%, teneur en chlorure (Cl) ≤ 0,08%, insoluble dans l’eau ≤ 0,05%.
Les informations ci-dessus sont compilées par Yaoyao de Chemicalbook.
Solubilité dans l’eau (g / 100ml)
Grammes dissous pour 100 ml d’eau à différentes températures (° C):
60 g / 10 °C; 63,7 g / 20 ° C; 66,7 g / 30 °C; 67,8 g / 40 ° C
70,1 g / 60 ° C; 74,5 g / 90 °C
Toxicité
Voir chromate de sodium
Propriétés chimiques
Cristal orthorhombique jaune citron; Soluble dans l’eau; insoluble dans l’alcool
Application
Utilisé comme réactif analytique, oxydant, mordant et inhibiteur de rouille métallique; utilisé pour la fabrication de chromate, utilisé comme oxydant et mordant d’impression et de teinture. Utilisé pour l’encre, la peinture, l’émail, la corrosion des métaux, etc., principalement utilisé dans la fabrication de réactifs chimiques et de pigments.
Préparation
Méthode de neutralisation: Dissoudre le dichromate de potassium dans la liqueur mère et l’eau, puis ajouter le mélange au réacteur. Ajoutez ensuite de l’hydroxyde de potassium sous agitation pour effectuer la réaction de neutralisation. Le chromate de potassium produit est faiblement alcalin, puis évaporé pour concentration, refroidi pour cristallisation, séparé et séché pour obtenir les produits finis de chromate de potassium.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
La liqueur mère séparée sera renvoyée à l’étape de dissolution pour dissoudre le dichromate de potassium.
Propriétés chimiques
cristaux jaune citron
Propriétés chimiques
Le chromate de potassium (VI) est un solide cristallin jaune.
Utilisations
Le chromate de potassium (K2CrO4) est soluble dans l’eau et est utilisé pour fabriquer des encres jaune vif et des pigments de peinture. Il est également utilisé comme réactif dans les laboratoires chimiques et comme mordant pour « fixer » les colorants dans les textiles colorés.
Utilisations
Il est utilisé comme agent oxydant.
Utilisations
A une application limitée dans les émaux, la finition du cuir, l’antirouille des métaux, étant remplacé par le sel de sodium; comme réactif en chimie analytique.
Définition
ChEBI: Sel de potassium composé d’ions potassium et chromate dans un rapport de 2:1.
Définition
Un sel contenant le ionCrO42-.
Définition
chromate de potassium: Solide cristallin jaune vif, K2CrO4, soluble dans l’eau et insoluble dans l’alcool; rhombique; d.r. 2,73; p.m. 968,3 ° C; se décompose sans ébullition. Il est produit industriellement en rôtissant du minerai de chrome en poudre avec de l’hydroxyde de potassium et du calcaire et en lixiviant la cendre résultante avec une solution de sulfate de potassium chaud. Le chromate de potassium est utilisé dans la finition du cuir, comme mordant textile, ainsi que dans les arômes et les pigments. Dans le laboratoireil est utilisé comme analytiqueagent et comme indicateur. Comme d’autres composés du chrome (III), il est toxique lorsqu’il est ingéré ou inhalé.
Description générale
Le chromate de potassium est un solide cristallin jaune. Le chromate de potassium est soluble dans l’eau. Le principal danger est la menace pour l’environnement. Des mesures immédiates devraient être prises pour limiter sa propagation dans l’environnement. Le chromate de potassium est utilisé en analyse chimique, dans la fabrication de pigments pour peintures et encres, comme fongicide et pour fabriquer d’autres composés du chrome.
Air & Réactions à l’eau
Soluble dans l’eau.
Profil de réactivité
Les agents oxydants, tels que le chromate de potassium, peuvent réagir avec les agents réducteurs pour générer de la chaleur et des produits qui peuvent être gazeux (provoquant une pressurisation des récipients fermés). Les produits peuvent eux-mêmes être capables d’autres réactions (telles que la combustion dans l’air). La réduction chimique des matériaux de ce groupe peut être rapide voire explosive, mais nécessite souvent une initiation (chaleur, étincelle, catalyseur, ajout d’un solvant). Les mélanges explosifs d’agents oxydants inorganiques avec des agents réducteurs persistent souvent inchangés pendant de longues périodes si l’initiation est empêchée. De tels systèmes sont généralement des mélanges de solides, mais peuvent impliquer n’importe quelle combinaison d’états physiques. Certains agents oxydants inorganiques sont des sels de métaux solubles dans l’eau; la dissolution dilue mais n’annule pas le pouvoir oxydant de ces matériaux. Les composés organiques, en général, ont un certain pouvoir réducteur et peuvent en principe réagir avec les composés de cette classe. La réactivité réelle varie considérablement avec l’identité du composé organique. Les agents oxydants inorganiques peuvent réagir violemment avec les métaux actifs, les cyanures, les esters et les thiocyanates.
Danger
Toxique par ingestion et inhalation.
Danger pour la santé
L’inhalation provoque une irritation locale des muqueuses; une irritation continue du nez peut entraîner une perforation de la cloison nasale. L’ingestion peut provoquer une gastro-entérite violente, un collapsus circulatoire, des vertiges, un coma et une néphrite toxique; l’ingestion de quantités excessives peut être fatale. Le contact avec les yeux provoque une irritation sévère et une conjonctivite. Une exposition répétée ou prolongée à la poussière, à la brume ou à des solutions peut provoquer une dermatite; le contact avec des fractures de la peau peut provoquer des `plaies chromées » apparaissant comme des ulcères à cicatrisation lente et à bords durs qui rendent la zone vulnérable à l’infection.
Risque d’incendie
Comportement en cas d’incendie: Peut augmenter l’intensité du feu en cas de contact avec des matériaux combustibles. Refroidissez les contenants et les matériaux renversés avec beaucoup d’eau.
Profil de sécurité
Carcinogène confirmé avec des données tumorigènes expérimentales. Poison par ingestion, voie intraveineuse, sous-cutanée et intramusculaire. Un altératogène expérimental. Autres effets reproductifs expérimentaux. Données sur les mutations humaines rapportées. Oxydant puissant. Lorsqu’il est chauffé à la composition, il émet des fumées toxiques de K2O. Utilisé comme mordant pour la laine, dans l’oxydation et le traitement des colorants sur les matériaux. Voir AUSSICOMPOSÉS DE CHROME.
Exposition potentielle
Le chromate de potassium est utilisé en impression: traitement photomécanique; production de pigments chromés; et méthodes de conservation de la laine; pour fabriquer des colorants, des pigments, des encres et des émaux; comme agent oxydant; réactif analytique; en galvanoplastie; explosifs.
Expédition
UN1479 Solide oxydant, n.s.a., Classe de danger: 5.1; Étiquettes: 5.1 – Oxydant, Nom technique Requis. UN3288 Solides toxiques inorganiques, n.s.a., Classe de danger: 6.1; Étiquettes: 6.1 – Matières toxiques, Nom technique requis
Méthodes de purification
Cristallisent l’eau de conductivité (0,6 g/mL à 20o) et la sèchent entre 135o et 170o.
Incompatibilités
Un oxydant puissant. Réactions violentes avec des combustibles, des matières organiques, des métaux en poudre; ou des substances facilement oxydables. Le contact avec l’hydroxylamine, l’hydrazine provoque une explosion.