MO pour HF
Orbitales moléculaires pour les molécules diatomiques hétérogènes
Une approche simple de la théorie des orbitales moléculaires (MO) pour les molécules diatomiques hétérogènes consiste à montrer le diagramme du niveau d’énergie. Les niveaux d’énergie MO peuvent être calculés en suivant ces étapes:
Rappelons que l’énergie \(E_n\) pour le nombre quantique n est pour un élément avec Z atomique est approximativement
\
Nous utilisons \(Z_{eff}\) au lieu de Z pour signifier que nous devons modifier le numéro atomique pour obtenir une charge atomique effective pour le noyau. Puisque nous avons affaire à des valeurs approximatives, on peut utiliser Z directement. Le niveau d’énergie orbitale 1s est de -13,6 eV pour les atomes d’hydrogène, mesuré comme l’énergie d’ionisation de H.
Ainsi, pour le nombre quantique n = 1, le niveau d’énergie pour 1s de He est d’environ – 54 eV. De même, le niveau d’énergie 1s pour F est de -1101 eV. Les niveaux d’énergie 2s et 2p pour He sont d’environ – 13,6 eV, ce qui est similaire à celui de l’orbitale 1s de H.
Ainsi, le niveau d’énergie 2s pour Li est d’environ -6 eV. Cependant, pour les atomes à plusieurs électrons, la sous-coque p et la sous-coque s ont des énergies différentes en raison de la pénétration. À ce niveau, nous ne pouvons pas être précis à ce sujet, mais pensons simplement que les orbitales 2p sont à une énergie plus élevée que l’orbitale 2s. Habituellement, les orbitales atomiques avec des niveaux d’énergie similaires les unes aux autres se chevauchent pour former des orbitales moléculaires. Ainsi, nous faisons correspondre les niveaux d’énergie des orbitales atomiques, puis en faisons des MOs de liaison et d’anti-liaison.
Cependant, dans le cas où le niveau d’énergie orbitale atomique est très différent, nous utilisons des orbitales atomiques de la sous-coque incomplète pour former MOs.
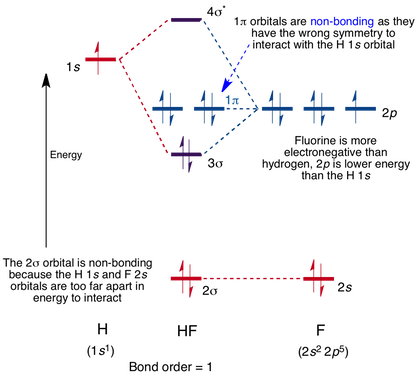
Diagramme de l’orbitale moléculaire pour la molécule HF
L’interaction se produit entre l’orbitale 1s sur l’hydrogène et l’orbitale 2p dans le fluor, provoquant la formation d’une liaison sigma et d’une orbitale moléculaire anti-liaison sigma, comme indiqué ci-dessous.