Non, Les Scientifiques Ne Pourront Jamais Retirer L’Espace Vide Des Atomes
Si vous preniez un objet dans l’Univers qui est fait de matière normale — tout ce qu’un être humain pourrait toucher, voir ou détecter d’une autre manière une interaction avec l’utilisation de notre corps — vous constateriez que vous pourriez le diviser en composants de plus en plus petits. Un corps humain entier peut être divisé en organes, qui à leur tour sont constitués de cellules. Chaque cellule est constituée d’organites, qui sont des structures plus petites avec des fonctions spécialisées, et les organites dépendent des interactions qui se produisent au niveau moléculaire.
La suite complète des molécules est constituée d’atomes: le plus petit composant de la matière normale qui conserve le caractère individuel et les propriétés de l’élément en question. Les éléments sont définis par le nombre de protons dans le noyau de chaque atome, où un atome est constitué d’électrons en orbite autour de ce noyau. Mais malgré le fait que les atomes sont pour la plupart des espaces vides à l’intérieur, il n’y a aucun moyen de supprimer cet espace. Voici l’histoire de pourquoi.

Un atome, au niveau le plus élémentaire, est constitué d’un noyau atomique à charge positive dont le volume est extrêmement minuscule. Pour chaque proton dans le noyau atomique, il y a un quantum de charge égal et opposé qui orbite autour de lui, créant un système neutre global: l’électron.
Pourtant, alors que le noyau atomique est confiné à un volume extrêmement petit — le diamètre d’un proton est juste autour de 1 femtomètre, soit 10^-15 m — les électrons en orbite, qui sont eux-mêmes des particules ponctuelles, occupent un volume d’environ 1 ångstrom (10^-10 m) dans les trois dimensions.
La première expérience qui a démontré cette énorme différence remonte à plus d’un siècle, lorsque le physicien Ernest Rutherford a bombardé une fine feuille d’or de particules radioactives.
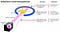
Ce que Rutherford a fait était simple et direct. L’expérience a commencé avec un appareil en forme d’anneau conçu pour détecter les particules qui le rencontrent depuis n’importe quelle direction. Au centre de l’anneau, une feuille d’or finement martelée était placée d’une épaisseur si petite qu’elle ne pouvait pas être mesurée avec des outils du début du 20e siècle: probablement quelques centaines ou milliers d’atomes de diamètre.
À l’extérieur de l’anneau et de la feuille, une source radioactive a été placée, de sorte qu’elle bombarderait la feuille d’or d’une direction particulière. On s’attendait à ce que les particules radioactives émises voient la feuille d’or de la même manière qu’un éléphant chargé verrait un morceau de papier de soie: elles passeraient simplement à travers comme si la feuille n’était pas là du tout.
Mais cela ne s’est avéré vrai que pour la plupart des particules radioactives. Quelques-uns d’entre eux — peu nombreux mais d’une importance vitale — se comportaient comme s’ils rebondissaient de quelque chose de dur et d’inamovible.

Certains d’entre eux se sont dispersés d’un côté ou de l’autre, tandis que d’autres semblaient ricocher vers leur direction d’origine. Cette première expérience a fourni la toute première preuve que l’intérieur d’un atome n’était pas une structure solide comme précédemment envisagé, mais plutôt constituée d’un noyau extrêmement dense et de petite taille et d’une structure externe beaucoup plus diffuse. Comme Rutherford lui-même l’a fait remarquer, en regardant en arrière des décennies plus tard,
» Ce fut tout à fait l’événement le plus incroyable qui me soit jamais arrivé dans ma vie. C’était presque aussi incroyable que si vous tiriez un obus de 15 pouces sur un morceau de papier de soie et qu’il revenait et vous frappait. »
Ce type d’expérience, où vous lancez une particule à faible, moyenne ou haute énergie sur une particule composite, est connu sous le nom de diffusion inélastique profonde, et cela reste notre meilleure méthode pour sonder la structure interne de tout système de particules.

Pour l’atome, d’un atome simple comme l’hydrogène à un atome complexe comme l’or, le plomb ou l’uranium, les électrons peuvent être trouvés bien au-delà de l’étendue du noyau atomique. Alors qu’un noyau atomique est confiné à un volume d’environ 1 femtomètre cubique (10 ^-15 mètres de chaque côté), un électron peut être trouvé réparti de manière probabiliste sur un volume d’environ un quadrillion (101^) fois plus grand. Cette propriété est indépendante de l’élément que nous considérons, du nombre d’électrons présents (tant qu’il s’agit d’au moins un), ou de la méthode que nous utilisons pour mesurer l’électron ou le noyau.
Le fait que les atomes sont pour la plupart des espaces vides est connu, aujourd’hui, même de la plupart des écoliers, qui apprennent ce fait à peu près en même temps qu’ils apprennent la structure des atomes. En apprenant cela, beaucoup d’entre eux se demandent — comme je suis sûr que beaucoup d’entre vous se demandent — pourquoi vous ne pouvez pas simplement supprimer cet espace vide et compacter les atomes à des échelles beaucoup plus petites, comme la taille d’un noyau atomique?

Dans le monde classique, où la nature joue selon des règles que nous connaissons et qui correspondent à ce que prédit notre intuition, il est très facile de contrôler la position des particules. Mais au niveau quantique, il y a une limitation fondamentale fixée par les règles de la nature: le principe d’incertitude de Heisenberg.
Même si vous savez tout ce qu’il y a à savoir sur un électron en orbite autour d’un noyau atomique, y compris:
- quel niveau d’énergie il occupe,
- quel est son état quantique,
- et combien d’autres électrons il y a dans les niveaux d’énergie environnants,
il restera encore un certain nombre de propriétés qui sont intrinsèquement incertaines. En particulier, l’une des propriétés intrinsèquement incertaines est la position de l’électron; nous ne pouvons que tracer la distribution de probabilité de l’endroit où l’électron est susceptible de se trouver.
La raison en est l’incertitude quantique inhérente entre la position et l’élan. L’impulsion d’un électron, que nous pouvons considérer comme l’unité de mouvement de toute particule, peut être connue avec une certaine précision en effectuant une mesure spécifique.
Cependant, plus votre mesure révélatrice d’élan est précise, plus l’acte de la mesurer conférera une incertitude inhérente à la position de l’électron. Inversement, plus vous tentez de mesurer avec précision la position de l’électron, plus l’incertitude que vous induisez dans l’élan de l’électron sera grande. Vous ne pouvez connaître ces deux grandeurs — position et élan — qu’avec une précision limitée en même temps, car en mesurer une plus précisément créera une incertitude intrinsèquement plus grande dans celle que vous ne mesurez pas.

L’électron occupe naturellement le grand volume auquel nous nous attendons autour du noyau atomique pour deux raisons.
- La taille du nuage de probabilité qu’occupe l’électron dépend du rapport charge/masse de l’électron. Avec la même charge de magnitude que le proton mais seulement 1 / 1836e de la masse, même la force électromagnétique ultra-forte ne peut confiner l’électron à un volume plus petit que ce que nous voyons.
- La force extérieure comprimant un électron sur un noyau atomique, limitant les composants externes du nuage de probabilité, est extrêmement faible, même pour les atomes liés entre eux dans un réseau ultra-fort. Les forces entre les électrons dans deux atomes différents, même dans les atomes qui sont liés ensemble, sont très faibles par rapport à la force entre le noyau atomique et un électron.
Chacune de ces raisons nous donne l’espoir d’une solution de contournement qui fonctionne dans la pratique, mais avec une applicabilité limitée.

Vous pouvez remplacer l’électron par une particule plus massive avec la même charge électrique. Il y a deux particules ressemblant à des électrons qui existent dans le modèle standard avec la même charge que l’électron: le muon et le tau. Le muon est environ 200 fois plus massif qu’un électron, et donc un atome d’hydrogène muonique (avec un proton pour un noyau mais un muon au lieu d’un électron en orbite autour de lui) est environ 200 fois plus petit que l’hydrogène standard.
Si vous liez l’hydrogène muonique à un certain nombre d’autres atomes, ils serviront de catalyseur pour la fusion nucléaire, lui permettant de procéder à des températures et des énergies beaucoup plus basses que la fusion standard. Cependant, les muons ne vivent que pendant environ 2 microsecondes avant de se désintégrer, et le tau plus massif vit moins d’une picoseconde. Ces atomes exotiques sont trop transitoires pour rester utiles longtemps.

Alternativement, vous pouvez augmenter énormément la pression sur les atomes en accumulant des quantités incroyables de masse en un seul endroit dans l’espace. Un atome individuel isolé pourrait n’être qu’un ångstrom de taille, mais si vous empilez la valeur d’une étoile autour de lui, cet atome ressentira une pression extérieure qui « serre » l’électron pour occuper un volume beaucoup plus confiné.
Plus la pression est grande, plus les électrons sont confinés et plus les atomes sont petits en termes d’étendue physique. Il y a une limite à la pression extérieure que les atomes peuvent supporter avant que la même catastrophe que précédemment ne se produise: les noyaux atomiques se rapprochent tellement que leurs fonctions d’onde se chevauchent et la fusion nucléaire peut se produire. Dans une naine blanche, ce seuil se produit à environ 1,4 masse solaire; dépassez-le, et vous finirez par initier une réaction de fusion emballement, qui aboutit dans ce cas à une supernova de type Ia.

Ce pourrait être un rêve de science-fiction délicieux d’enlever l’espace vide des atomes, en diminuant le volume que la matière occupe par des facteurs de millions, de milliards ou même plus. Cependant, ce n’est pas que les électrons en orbite autour du noyau occupent intrinsèquement un volume d’espace extrêmement important, mais plutôt que les propriétés quantiques inhérentes aux particules — masses, charges, force d’interaction et incertitude quantique — se combinent pour créer les atomes qui existent dans notre Univers.
Même si nous avions une contrepartie stable et plus lourde de l’électron, ou la capacité de comprimer la matière à des états arbitrairement denses, nous rencontrerions un seuil quantique où les noyaux atomiques au centre des atomes fusionneraient spontanément, empêchant des configurations stables de plusieurs atomes d’exister du tout. Le fait que nos atomes sont pour la plupart des espaces vides permet l’existence de molécules, de chimie et de vie.
Supprimer l’espace vide des atomes peut être une expérience de pensée amusante, mais les atomes sont de la taille qu’ils sont en raison des règles de l’Univers. Notre existence dépend de la présence de cet espace vide, mais avec les constantes de la nature ayant les valeurs qu’elles ont, ne vous inquiétez pas. Il ne peut en être autrement.