Poux de poisson au Royaume-Uni
Trois espèces sont connues dans les eaux douces du Royaume-Uni: Argulus foliaceus, Argulus coregoni et Argulus japonicus. Deux de ces espèces, A. foliaceus et A. coregoni, sont considérées comme originaires du Royaume-Uni (Fig. 1). Ces espèces sont facilement discriminées puisque l’A. coregoni adulte mesure plus de deux fois la taille de l’A. foliacé adulte et possède des lobes abdominaux pointus plutôt qu’arrondis. On pense que A. japonicus n’est pas indigène et qu’il a été introduit d’Asie par le commerce ornemental. Cette espèce ressemble beaucoup à A. foliacé et ne peut être discriminé qu’au niveau microscopique.
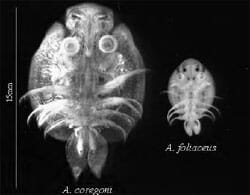
Figure 1. Vue ventrale de A. coregoni et A. foliaceus adultes.
A. foliaceus est largement répertorié dans le monde entier, habitant généralement des lacs riches en nutriments, bien qu’il puisse tolérer des salinités allant jusqu’à 8-12ppt à des températures allant jusqu’à 25 ° C. A. coregoni infecte généralement les poissons dans les rivières, les ruisseaux et les lacs oligotrophes frais à grand débit. A. japonicus est présent en Europe, en Afrique, en Amérique du Nord et en Asie. À l’heure actuelle, les dossiers de A sont limités. japonicus au Royaume-Uni, et en raison de la difficulté à différencier les deux espèces, il est possible que dans certains cas, il ait été mal identifié comme A. foliaceus.
Nombre des premières mentions d’Argulus spp. en Europe, ils sont considérés comme un problème dans l’élevage de la carpe, une grande partie de la littérature allemande faisant référence au « Pou de la carpe ». Ces dernières années cependant, Argulus spp. ont été signalés pour causer des problèmes dans la pêche à la truite d’eau morte au Royaume-Uni. Une enquête sur ces pêcheries a révélé que 29% d’entre elles souffraient d’infections problématiques par le parasite en l’an 2000. A. foliacé était responsable de toutes les infections observées sauf une, l’autre étant causée par A. coregoni.
Les poissons infectés peuvent subir des réductions importantes du facteur de condition, réduisant l’attrait esthétique des poissons pour les pêcheurs à la ligne dans une pêche sportive. Les infections abondantes peuvent également entraîner des changements de comportement notables, qui se développent à mesure que la gravité de l’épidémie augmente. Dans les premiers stades d’une infection, les poissons des lacs sautent, flashent et nagent de manière erratique, peut-être pour tenter de se débarrasser des poux. Par la suite, l’alimentation est réduite et les poissons perdent leur condition et deviennent difficiles à attraper en pêchant à la ligne. À mesure que les niveaux d’infection augmentent, on a observé que les poissons nagent dans des hauts-fonds serrés et, dans les cas graves, une mortalité importante peut survenir.
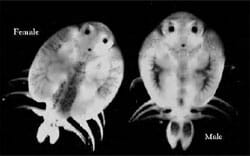
Figure 2. Vue dorsale de la femelle et du mâle adultes A. foliaceus.
Argulus spp. se reproduire sexuellement et les parasites mâles et femelles peuvent s’accoupler sur ou hors de l’hôte. La femelle adulte a un seul ovaire médian, qui s’étend sur toute la longueur du corps. Bien que plusieurs accouplements puissent être observés, on pense qu’un seul est suffisant pour féconder tous les œufs qu’une femelle produira un jour. Les mâles et les femelles adultes se distinguent facilement car les mâles ont de grandes taches sombres sur chacun des lobes abdominaux, et les femelles ont une pigmentation tachetée remontant le centre de la surface dorsale de la carapace, recouvrant l’ovaire (Fig. 2).
Argulus spp. au Royaume-Uni, ils pondent leurs œufs hors de l’hôte sur une surface dure appropriée, en rangées attachées par un matériau gélatineux qui durcit au contact de l’eau. Oeufs de A. foliaceus et A. les japonicus sont pondus en lots comprenant 2 à 4 rangées de jusqu’à 400 œufs, tandis qu’A. coregoni pond ses œufs dans des nattes contenant jusqu’à 900 œufs. Le parasite peut pondre jusqu’à 10 lots d’œufs, mais la plupart ne pondent qu’une seule fois. Les œufs individuels sont ovoïdes et mesurent environ 0,2 mm x 0,3 mm. Lors de la ponte, les œufs sont de couleur blanche à jaune pâle, mais en 24 heures, leur couleur change pour un jaune plus profond / brun clair. Les œufs adhèrent fermement à leur surface de fixation et, contrairement aux œufs d’escargot, ne sont pas enrobés de gelée. Le parasite éclot en tant que stade connu sous le nom de métanauplie, qui se situe entre 0,6 et 0.8 mm de longueur (fig. 3).

Figure 3. A. foliaceus metanauplius éclot d’une ficelle d’œufs.
Les temps d’éclosion dépendent de la température et deviennent plus courts à mesure que la température augmente. En dessous de 8 à 10 ° C, les œufs des trois espèces britanniques ne semblent pas se développer, ce qui est peut-être un mécanisme pour augmenter la survie du metanauplius en veillant à ce que l’éclosion ne se produise que dans les conditions plus favorables du printemps et de l’été. Les œufs qui passent l’hiver ont un succès d’éclosion très réduit, mais peuvent survivre à basse température jusqu’à 2 ans.
Au Royaume-Uni, le nombre d’argulidés sur les poissons a tendance à être faible en hiver, les expériences de laboratoire suggérant que la plupart des poux meurent dans des conditions froides et après des périodes de reproduction. Une augmentation de la température au printemps provoque l’éclosion des œufs. Ces premières générations donnent naissance aux générations suivantes qui font que le nombre de population atteint son maximum vers la fin de l’été / début de l’automne. À mesure que la température baisse avec l’arrivée du recrutement hivernal s’arrête et que la population diminue à nouveau. Tous les poux adultes qui survivent à l’hiver deviennent relativement inactifs jusqu’à ce que la température de l’eau augmente au-dessus de 10 ° C, lorsqu’ils quittent leur hôte pour pondre.
Des études ont montré que dans la pêche à la truite, la faible clarté de l’eau, la lenteur du renouvellement des stocks (la vitesse à laquelle les stocks de truites sur pied des lacs sont enlevés et remplacés) et les températures élevées montrent une corrélation significative avec un nombre élevé d’A. foliaceus sur la truite. La faible clarté de l’eau était également associée à une diminution du renouvellement des stocks, peut-être parce que la clarté réduite modifie la distance sur laquelle les truites sont susceptibles de réagir aux proies, réduisant ainsi la probabilité d’être capturées. Ces résultats suggèrent que le nombre élevé d’A. foliaceus à lui seul peut ne pas affecter les taux de capture à moins de travailler en combinaison avec d’autres facteurs environnementaux. Les mécanismes derrière les effets de la clarté de l’eau et du renouvellement des stocks sur la dynamique des parasites sont actuellement inconnus, bien que plusieurs hypothèses aient été développées. Il est probable que les retournements rapides des stocks réduisent le nombre de parasites en éliminant les poissons infectés avant que le parasite ne puisse quitter son hôte pour pondre les œufs nécessaires à la production des générations suivantes. Une faible clarté de l’eau peut influencer la dynamique des parasites de plusieurs manières. D’une part par son effet de ralentissement du renouvellement des stocks, d’autre part par une réduction de la prédation sur le parasite par la truite (qui les mange facilement en laboratoire), et enfin une clarté de l’eau réduite peut modifier le comportement de l’hôte d’une manière qui augmenterait le succès de l’infection. D’autres recherches sont en cours entre le Cefas et l’Institute of Aquaculture (Université de Stirling) afin de déterminer les mécanismes qui animent ces relations et d’élaborer des stratégies de gestion ciblées.
Hiver / Printemps 2007