Syndrome de Klüver-Bucy À la suite d’une Lésion Cérébrale Traumatique: Synthèse et examen Systématiques du Traitement Pharmacologique à Partir de Cas chez les Adolescents et les Adultes
Le syndrome de Klüver-Bucy (KBS) est un trouble neuropsychiatrique rare pouvant survenir à la suite d’une lésion cérébrale traumatique (TCC). Le syndrome a été décrit pour la première fois en 1937 comme un syndrome neurocomportemental expérimental chez des singes présentant des lésions cérébrales bitemporelles1; des KBS transitoires et permanentes chez l’humain3 ont été observées par la suite. Le syndrome est caractérisé par des comportements complexes, y compris la placidité, l’agnosie visuelle, l’activité sexuelle altérée, l’hyperoralité, les troubles de la mémoire, l’hypermétamorphose et les changements de comportement émotionnel et nutritionnel.4-6 Le statut psychologique des personnes atteintes de SGC dépend non seulement de l’étendue et de l’emplacement de la lésion, mais également du niveau de développement émotionnel et intellectuel avant la blessure et de l’étendue de la stimulation sociale après une lésion cérébrale. Le diagnostic de KBS ne nécessite pas que tous les symptômes se manifestent simultanément, et le KBS entièrement symptomatique est rare.3,6,7
KBS est généralement associé à des lésions de l’amygdale ou des voies amygdaloïdes. Elle a été rapportée chez des patients présentant diverses pathologies, notamment une encéphalite à herpès simplex, 8 la maladie de Huntington, 9 la maladie d’Alzheimer, 10 l’adrénoleucodystrophie, 11 le coup de chaleur, 12 la méningite, 13 la sclérose en plaques, 14 la maladie de Pick, 15 l’épilepsie temporale, 16 et le syndrome de Reye.17 Ces troubles neurologiques sont associés à la destruction ou au dysfonctionnement des structures du lobe temporal mésial bilatéral.7 Il n’existe actuellement aucune recommandation définitive de traitement par KBS. Les symptômes du KBS sont gérés symptôme par symptôme, par opposition à la pharmacothérapie prescrite pour le KBS dans son ensemble.
Étant donné la présentation rare de KBS dans la pratique clinique et dans la littérature académique, notre compréhension du KBS après le TBI s’est principalement appuyée sur des rapports de cas, en raison du manque de données de meilleure qualité disponibles. Les lignes directrices de la Société Française de Médecine Physique et de Réadaptation (SOFMER) pour la prise en charge des troubles du comportement suite à un TBI ont rapporté des preuves de niveau 4 de grade C pour un traitement par la carbamazépine sur la base de l’expérience de quatre patients atteints de lésions post-traumatiques localisées bitemporellement qui ont développé un KBS.18 Pour les quatre patients de la série de cas, l’article a rapporté que plusieurs symptômes répondaient de manière spectaculaire à la carbamazépine.19,20 Les symptômes n’ont pas été précisés. Cependant, sur les quatre patients, deux avaient des blessures à la tête d’origine indéterminée.19,20 Les lignes directrices ont conclu que la carbamazépine est un agent utile dans le traitement de ce syndrome inhabituel.
L’objectif de cette étude était de s’appuyer sur les résultats rapportés dans les lignes directrices de la SOFMER avec un examen plus complet des rapports de cas. Par conséquent, l’objectif initial de cette revue systématique était d’utiliser des rapports de cas pour décrire le SGC chez les adolescents et les adultes ayant subi un TCC. Le deuxième objectif était de comparer et de comparer les rapports de cas individuels pour les patients atteints de KBS post-TBI pour lesquels la prescription de pharmacothérapies a été rapportée. Compte tenu de l’impact potentiel des problèmes de développement chez les enfants, cette revue se concentre sur les adolescents et les adultes. Bien qu’un petit nombre d’examens aient pris en compte les BK suivant l’ITC,7,21 à notre connaissance, les BK suivant l’ITC n’ont pas fait l’objet d’un examen systématique.
Cette revue fait partie d’un projet plus vaste visant à synthétiser les preuves de la prise en charge pharmacologique des symptômes neurocomportementaux post-IT en prélude à l’élaboration d’une ligne directrice clinique. Cette revue systématique, en plus du consensus des experts universitaires et cliniques, contribue à l’élaboration de recommandations fondées sur des preuves pour la prise en charge pharmacologique des comportements neurologiques complexes, y compris le KBS chez les patients post-IT.
Méthodes
Avant de commencer l’examen, nous avons effectué des recherches dans la base de données PROSPERO et dans la base de données Joanna Briggs pour nous assurer que les travaux proposés ne faisaient pas double emploi avec les travaux en cours. Cet examen systématique est rapporté selon les Éléments de rapport préférés pour l’Examen systématique et les lignes directrices de méta-analyse.
Critères d’inclusion et d’exclusion
Le présent examen se limitait aux rapports de cas et séries de cas de participants humains disponibles sous forme d’articles en texte intégral. Les rapports de cas et les séries d’adolescents et d’adultes (âge: ≥13 ans), hommes et femmes, qui avaient subi un TCC présentant des symptômes de KBS partiels ou complets ont été considérés pour l’inclusion. Le TBI a été défini comme une altération de la fonction cérébrale ou d’autres preuves de pathologie cérébrale causées par une force externe. Des études ont été incluses indépendamment de la gravité de la blessure ou du mécanisme de la blessure. Les participants ayant une blessure à la tête pénétrante et non pénétrante étaient admissibles à l’inclusion.
Les symptômes suivants sont considérés comme caractéristiques du SGB: 6 placidité (perte de colère ou de peur normale); hyperoralité (tendance à explorer des objets dans la bouche); agnosie visuelle (incapacité à reconnaître les objets sans perte de discrimination visuelle flagrante); hypermétamorphose (tendance à s’occuper et à manipuler des objets dans le champ visuel); comportement alimentaire aveugle, y compris l’hyperphagie (appétit excessif et insatiable); et hypersexualité. Le diagnostic de la forme complète du syndrome est basé sur l’apparition de tous les symptômes susmentionnés.6 Le diagnostic de la forme partielle du syndrome nécessite la présence de trois symptômes ou plus.4,6 Les études dans lesquelles le diagnostic de KBS était basé sur moins de trois symptômes ont été exclues de l’examen.
Pour être inclus, les rapports de cas devaient montrer des preuves médicales d’un TCC, c’est-à-dire un TCC sans équivoque documenté dans les dossiers médicaux ou d’autres rapports médicaux ou de santé cités par l’équipe de recherche associée à l’article publié. Des exemples de preuves sans équivoque comprennent les résultats de l’imagerie cérébrale (par exemple, tomodensitométrie, imagerie par résonance magnétique), le score de l’échelle de coma de Glasgow (SCG), l’amnésie post-traumatique et la perte de conscience.
Les études dans une langue autre que l’anglais étaient incluses si un service de traduction était disponible pour les chercheurs. Les études suivantes ont été exclues: rapports de cas ou séries d’enfants jusqu’à l’âge de 13 ans; rapports de cas ou séries dans lesquels le mécanisme du préjudice n’était pas clairement indiqué et il n’était donc pas possible de conclure que le TCC était le sujet central; et des études de cas basées sur l’auto-déclaration du TCC de la personne ou d’un informateur, en l’absence d’autres preuves médicales concernant la blessure à la tête, comme indiqué ci-dessus.
Une description du syndrome post-TBI mettant l’accent sur les caractéristiques démographiques et les lésions, l’imagerie cérébrale, les symptômes et la pharmacothérapie est fournie. Les résultats qui ont fait l’objet de cet examen étaient l’efficacité du traitement, mesurée par la résolution ou l’amélioration des symptômes du SGC, le rétablissement global et les méfaits, y compris les événements indésirables résultant d’une pharmacothérapie prescrite.
Stratégie de recherche
La stratégie de recherche a été élaborée sur la base des éléments population-intervention-comparateur-résultats pertinents pour cet examen (la population dans ce cas était secondaire à l’ITC). Il comprenait une gamme de termes et de mots-clés liés par des opérateurs booléens. Les perquisitions ont été effectuées le 20 décembre 2016 et répétées le 5 novembre 2017. Les termes ont été modifiés selon les besoins pour chaque base de données. Les bases de données suivantes ont été recherchées sans limitation de date, d’âge ou de langue : MEDLINE : Interface OVID SP ; EMBASE: Base de données Excerpta Medica, PsycINFO: interface OVID SP; et SCOPUS. Les termes de recherche MEDLINE et le nombre de résultats pour chaque base de données sont inclus dans le supplément en ligne.
Pour que la recherche soit aussi complète que possible, nous avons complété la recherche formelle des bases de données bibliographiques par des recherches sur Google Scholar et ResearchGate. Nous avons également effectué des recherches électroniques dans les revues en ligne suivantes: Brain Injury, Neuropsychology, Journal of Neurotrauma, Neurocase et Rapports de cas BMJ. Nous avons examiné les listes de références et les bibliographies des articles récupérés pour identifier les recherches non localisées grâce à d’autres stratégies de recherche. Enfin, nous avons demandé à nos collègues s’ils étaient au courant de rapports de cas dans ce domaine.
Sélection de l’étude
Les résultats des quatre recherches dans la base de données ont été téléchargés dans Endnote×7 et dédupliqués. Les titres et les résumés ont été sélectionnés par deux examinateurs indépendants (FC, AK) en fonction des critères d’inclusion et d’exclusion de l’examen. Les études qui répondaient potentiellement aux critères d’inclusion au stade du titre et du résumé ont été récupérées intégralement et évaluées indépendamment par rapport aux critères d’inclusion par deux membres de l’équipe d’examen (FC, AK). Un article pourrait être inclus dans l’examen s’il contenait au moins un cas pertinent. Les articles qui incluaient à la fois des cas pertinents et des cas qui ne répondaient pas aux critères d’inclusion (par exemple, en raison de l’âge du patient ou du fait que le SGC n’était pas secondaire au TCC) étaient toujours admissibles. La discussion entre les évaluateurs a permis de s’entendre sur l’admissibilité de deux études. Les études en texte intégral qui ne répondaient pas aux critères d’inclusion ont été exclues et les raisons de l’exclusion sont présentées à la figure 1.
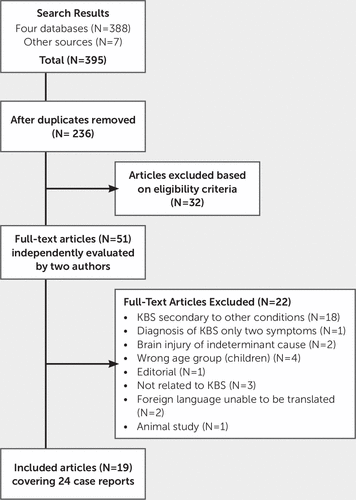
FIGURE 1. Études incluses et exclues dans l’analyse
a KBS = syndrome de Klüver-Bucy.
Évaluation de la qualité méthodologique
La qualité a été évaluée par trois examinateurs (FC, AK, EA) à l’aide de la liste de contrôle en huit questions de l’évaluation critique du Joanna Briggs Institute pour les rapports de cas. (Cette liste de contrôle est incluse dans le supplément en ligne.) En bref, les questions évaluent la qualité de la déclaration des caractéristiques démographiques du patient, de l’état clinique actuel, des tests diagnostiques ou des méthodes d’évaluation, des interventions ou du traitement, de l’état clinique post-intervention, des méfaits et des conséquences inattendues, et des leçons à retenir.
Extraction de données
Lorsque disponibles, les données suivantes ont été extraites des rapports de cas inclus avec un outil d’extraction de données personnalisé testé sur deux rapports de cas de KBS secondaire au virus de l’herpès simplex (FC, AK). Des modifications mineures ont été apportées à l’outil d’extraction des données à la suite du projet pilote. Pour faciliter l’interprétation des données, nous avons cherché à nous assurer que l’un des examinateurs impliqués dans l’extraction des données avait un diplôme de médecine (AK). Les éléments de données spécifiques extraits, le cas échéant, sont les suivants.
Nous avons extrait des données sur le pays du cas; l’âge, le sexe et le mécanisme de blessure du cas; et le rapport de perte de conscience (sur la base du score GCS et de la présence ou de l’absence de coma). Nous avons également recueilli des informations sur la population étudiée: TBIs (blessures autres qu’à la tête, période post-blessure), symptômes du syndrome de KBS, si le KBS était complet ou partiel, temps au début du KBS et durée du KBS. Nous avons extrait des données sur l’imagerie utilisée (tomodensitométrie, IRM) et sur l’intervention de pharmacothérapie si une intervention était utilisée, y compris le type de composé pharmacologique, la dose, la fréquence et la durée, et les cointerventions et leurs détails. Nous avons suivi les résultats et le moment où ils ont été mesurés, ainsi que la réponse au traitement et les événements indésirables du traitement.
Résultats
Sélection de l’étude
La stratégie de recherche a abouti à un rendement initial de 388 références provenant de quatre bases de données bibliographiques. Sept références potentiellement pertinentes ont été identifiées par Google Scholar. Après suppression des doublons, il restait 236 références. De ce nombre, 185 références ont été exclues sur la base du titre ou de l’abrégé.
Le texte intégral de 51 articles a été récupéré pour une évaluation détaillée; après examen indépendant par deux auteurs (FC, AK), 32 articles ne répondaient pas aux critères d’inclusion. Les principales raisons de l’exclusion comprenaient une conception d’étude incorrecte (pas un rapport de cas) ou une population hors de portée (études sur des enfants ou des animaux, KBS secondaire à des conditions autres que le TCC). Une étude publiée en italien a été traduite par un étudiant diplômé. Un rapport de cas potentiel publié en polonais a été exclu après traduction par un membre du personnel. Une version anglaise d’un autre article publié en polonais était disponible; par conséquent, la version polonaise a été exclue. Après un examen indépendant, 19 articles faisant référence à 24 rapports de cas ont satisfait aux critères d’inclusion pour l’examen. La stratégie de recherche est présentée à la figure 1.
Synthèse des données
Les résultats des 24 cas sont présentés sous la forme d’une synthèse descriptive narrative structurée autour des caractéristiques du rapport de cas individuel, de la gravité de la blessure, de l’imagerie cérébrale, des symptômes de KBS, de l’utilisation de la pharmacothérapie et des résultats du traitement.
Caractéristiques démographiques
Les rapports de cas inclus ont été publiés entre 1968 et 2017. La moitié des cas signalés (N=12) provenaient des États-Unis, le reste de l’Inde (N=2), 22, 23 de la Turquie (N=1), 24 du Japon (N=1), 25 de l’Italie (N=1), 26 de la Pologne (N=4) 19,20,27 et des Pays-Bas (N=3).28 des rapports de cas inclus, dont 70,1 % concernaient des hommes et des garçons (N = 17). L’âge moyen au moment de la blessure pour les 21 rapports de cas spécifiant l’âge était de 25,1 ans, avec une fourchette de 13 à 67 ans. Trois autres rapports précisaient soit au début de la vingtaine, soit à la fin de la vingtaine.7,29 Le mécanisme de blessure le plus courant était l’accident de la route (N = 17, 70,1 %). Il y a eu trois rapports de cas de KBS après une blessure par balle, 7, 35, 36 et deux chacun après un automne 19, 20, 32 ou un accident lié au sport.7,33 Les caractéristiques démographiques, d’imagerie cérébrale et de blessures des sujets de cas dans les études incluses sont présentées dans le tableau 1.
| Étude | Cas | Âge au moment de la blessure (Années) | Sexe | Pays | Mécanisme de la blessure | Perte de conscience | Score de l’échelle de coma de Glasgow (GCS) | IRM cérébrale et informatisée Résultats de Tomographie |
|---|---|---|---|---|---|---|---|---|
| Aygun et coll.24 | 29 | Homme | Turquie | Accident de la route | Non | 14 | Contusions des lobes temporaux bilatéraux | |
| Bhat et al.22 | 30 | Homme | Inde | Accident de la route | Non signalé | Non signalé | Légère atrophie du gyrus temporal antérieur droit | |
| Caro et Jimenez7 | Fin des années 20 | Homme | États-Unis | Sport | Non | Augmentation de la taille des lobes frontaux; lésions de la substance blanche pariétale droite; lésions infratentoriales dans les hémisphères cérébelleux | ||
| Deginal et Changement23 | 16 | Homme | Inde | Accident de la route | Oui | 10 | Contusions temporales bilatérales avec œdème | |
| Fiume et Fiume Garelli26 | 23 | Homme | Italie | Accident de la route | Comab | Imagerie non réalisée; craniotomie sous-temporelle | ||
| Góscínski et coll.19,20 | 1 | 23 | Homme | Pologne | Accident de la route | Oui | 4 | Hématome sous-dural gauche |
| Œdème cérébral du côté droit | ||||||||
| Góscínski et coll.19,20 | 2 | 67 | Mâle | Pologne | Automne | Oui | 7 | Hématome bitemporal intracérébral |
| Hardy et Aldridge2 | 16 | Homme | États-Unis | Arme à feu | Non | Lésion du lobe temporal droit | ||
| Hooshmand et coll.34 | 16 | Femme | États-Unis | Accident de la route | Oui, coma | Lésion du lobe temporal droit | ||
| Isern31 | 37 | Femme | États-Unis | Arme à feu | Non | Dommages au lobe bitemporal | ||
| Kwiatwoski et coll.27 | 1 | 16 | Homme | Pologne | Accident de la route | Oui | 3 | Contusions bilatérales: lobes temporal et pariétal |
| Hémorragie dans les noyaux sous-corticaux; hématome paracérébral | ||||||||
| Kwiatwoski et coll.27 | 2 | 16 | Femme | Pologne | Accident de la route | Oui, Score GCS=3 | Hématome sous-dural temporal gauche | |
| Contusion hémorragique de l’hémisphère droit et œdème cérébral | ||||||||
| Lilly et coll.6 | 57 | Homme | États-Unis | Accident de la route | Oui | Dommages bilatéraux aux lobes temporaux inférieurs | ||
| Morcos et Guirgis32 | 39 | Mâle | États-Unis | Automne | Oui | Dommages temporaux inférieurs gauche | ||
| Moviat et coll.28 | 1 | 13 | Femme | Pays-Bas | Accident de la route | <7 | Hématome sous-dural pariétal du côté gauche; œdème généralisé | |
| Perte des citernes basales; contusions temporales gauches et frontotemporales droites | ||||||||
| Moviat et coll.28 | 2 | 13 | Femme | Pays-Bas | Accident de la route | 7 | Hématome sous-dural pariétal du côté gauche; œdème généralisé | |
| Perte des citernes basales; contusion bilatérale frontotemporale | ||||||||
| Moviat et coll.28 | 5 | 14 | Homme | Pays-Bas | Accident de la route | Score GCS=7 | Hématome frontotemporal droit; atrophie frontale droite | |
| Hypodensité dans le thalamus gauche | ||||||||
| Salim et coll.48 | 24 | Femme | États-Unis | Accident de la route | Non | 14 | Lésion axonale focale du lobe temporal gauche | |
| Slaughter et coll.29 | 1 | Fin des années 20 | Homme | États-Unis | Accident de la route | Oui | 3Tc | Hématome intraparenchymateux gauche; hémorragie sous-arachnoïdienne |
| Contusions du lobe temporal gauche; élargissement bilatéral – cornes temporales | ||||||||
| Slaughter et coll.29 | 2 | Début des années 20 | Homme | États-Unis | Accident de la route | Oui | 6 | Contusions bilatérales de petits lobes frontaux |
| Smigielski et Boeve36 | 25 | Femme | États-Unis | Accident de la route | Non signalé | Non signalé | Contusions bilatérales du lobe temporal; blessure frontale du côté gauche | |
| Voyeur35 | 20 | Homme | États-Unis | Accident de la route | Non signalé | Non signalé | Encéphalomalacie frontale et temporale bilatérale | |
| Yoneoka et coll.25 | 17 | M | Japon | Sport | Oui, coma | Hématome sous-dural aigu du côté droit avec hernie transtentoriale | ||
| York et McCarter30 | 25 | Homme | États-Unis | Arme à feu | 5tc | Contusions du lobe bifrontal et temporal |
Admission à l’hôpital aAt sauf indication contraire.
Perte de conscience bNo ou score GCS signalé.
Les réponses cverbales n’ont pas été évaluées car un tube en T a été inséré.
TABLEAU 1. Caractéristiques démographiques et traumatiques du Syndrome de Klüver-Bucy Après TCC Chez les Sujets de cas (N = 24)
Gravité de la blessure
La moitié des sujets de cas avaient subi une blessure grave à la tête, telle que définie par un score GCS < 8, un coma et une perte de conscience enregistrée. La durée de la perte de conscience n’a été signalée que dans un seul rapport de cas. Le score GCS a été enregistré dans 13 rapports, avec un score rapporté < 8 dans neuf cas. Le coma a été documenté dans trois rapports de cas.25,26,34 Il y a eu quatre cas dans lesquels une perte de conscience a été constatée, mais le score GCS n’a pas été fourni. Dans trois cas, la gravité de la blessure n’était pas disponible car aucune information sur le score GCS, le coma ou la perte de conscience n’a été rapportée.22,35,36
Imagerie cérébrale
L’imagerie cérébrale (IRM ou TDM) était disponible pour la plupart des cas (N = 23). Les lésions ont été le plus souvent trouvées dans les lobes temporaux, avec des lésions du lobe temporal notées dans 18 (90%) cas. Sur les 15 sujets de cas (75%) présentant des lésions isolées aux lobes temporaux seulement, 11 présentaient des lésions bilatérales et deux présentaient des lésions unilatérales (gauche, N = 1; droite, N = 1). Les lobes frontaux ont été impliqués dans quatre cas. Dans trois de ces cas, les lobes temporaux étaient également impliqués.
Symptômes de KBS
L’hyperactivité sexuelle ou un comportement sexuel inapproprié était le symptôme de KBS le plus courant, noté dans 95,8% des cas rapportés (N = 23). Un changement des habitudes alimentaires en hyperphagie ou boulimie a été signalé dans 20 cas, l’hyperphagie étant la présentation la plus fréquente (13 cas). L’hyperoralité s’est produite dans 17 cas et l’hypermétamorphose était présente dans 13 cas. La placidité a été rapportée dans 15 cas. Pour certains de ces cas, la placidité s’est produite par intermittence avec agitation et agressivité. L’agnosie visuelle était le symptôme KBS le moins courant, avec seulement huit cas signalant une agnosie visuelle. Les KBS complets et partiels étaient basés sur le nombre de caractéristiques de KBS présentant; dans la majorité des cas inclus, les KBS étaient partiels (N = 19; 79,1 %), le reste étant complet (N = 5; 20,9 %).6,23-25,31
En ce qui concerne les résultats cliniques associés, des convulsions ont été signalées dans quatre cas et des problèmes de mémoire ont été signalés dans 16 cas. Des comportements difficiles associés au KBS, y compris l’impulsivité, la récalcitrance, l’agitation et l’agression (souvent extrêmes), ont été notés dans 16 cas.
Dans la majorité des cas, les symptômes du SGC sont apparus tôt après le TCC. Dans 12 cas, cela s’est produit moins de 7 jours après le TCC et dans cinq cas, entre 7 et 31 jours après le TCC. Aucun cas de KBS n’a été diagnostiqué pendant le coma ou lorsqu’une période de stupeur a été décrite.25 Symptômes de KBS sont apparus environ 6 mois après le TCC pour un cas, 34 1 an après le TCC pour deux cas, 22, 28 et 2 ans après le TCC pour un cas.28 Pour deux cas, il n’a pas été possible de déterminer l’heure d’apparition. Les caractéristiques du SGB, y compris le temps d’apparition et les résultats cliniques associés pour chacun des rapports de cas inclus sont présentés dans le tableau 2.
| Étude | Cas | Temps à KBS Onetb | Mémoire | Agnosie visuelle | Placidité | Changement de régime alimentaire | Hyperoral | Hyperactivité sexuelle | Hypermétamorphoses | Comportement | KBS complet ou partiel |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Aygounet al.24 | T1 | Non décrit | + | + | + | + | + | Non décrit | FA | Complet | |
| Bhat et al.22 | T3 | Non décrit | + | + | Non décrit | + | + | + | FA | Partielle | |
| Caro et Jimenez7 | T5 | Non décrit | Non décrit | + | + | + | + | Non décrit | A | Partiel | |
| Deginal et Changement23 | T2 | Non décrit | + | + | + | + | + | + | A | Complet | |
| Fiume et Fiume Garelli26 | D1 | + | Non décrit | + | + | + | + | + | D | Partiel | |
| Góscínski et coll.19,20 | 1 | D2 | + | Non décrit | Non décrit | + | + | + | Non décrit | A/FA | Partiel |
| Góscínski et coll.19,20 | 2 | T2 | Non décrit | Non décrit | Non décrit | + | + | + | + | A | Partiel |
| Hardy et Aldridge2 | D1 | + | + | + | + | Non décrit | + | + | FA | Partielle | |
| Hooshmand et coll.34 | D3 | + | Non décrit | Non décrit | + | + | + | Non décrit | A | Partiel | |
| Isern31 | D1 | + | + | + | + | + | + | + | A | Complet | |
| Kwiatwoski et coll.27 | 1 | T1 | Non décrit | + | + | + | + | + | Non décrit | A | Partiel |
| Kwiatwoski et coll.27 | 2 | D1 | + | Non décrit | Non décrit | + | + | + | + | A/D | Partiel |
| Lilly et coll.6 | D2 | + | + | + | + | + | + | + | FA/R | Complet | |
| Morcos et Guirgis32 | D1 | + | Non décrit | Non décrit | + | Non décrit | + | + | A | Partiel | |
| Moviat et coll.28 | 1 | D4 | + | Non décrit | + | + | Non décrit | + | + | RE | Partiel |
| Moviat et coll.28 | 2 | D3 | + | Non décrit | + | Non décrit | Non décrit | + | + | RE | Partiel |
| Moviat et coll.28 | 5 | D1 | + | Non décrit | + | + | + | + | Non décrit | RE | Partiel |
| Salim et coll.48 | D1 | + | Non décrit | + | + | Non décrit | + | Non décrit | A | Partiel | |
| Slaughter et coll.29 | 1 | D2 | + | Non décrit | Non décrit | + | + | + | Non décrit | A/R | Partiel |
| Slaughter et coll.29 | 2 | D1 | + | Non décrit | Non décrit | Non décrit | + | N | Non décrit | A/FA/R | Partiel |
| Smigelski et Boeve36 | T5 | Non décrit | Non décrit | Non décrit | Non décrit | + | + | Non décrit | A | Partiel | |
| Voyeur35 | D1 | + | Non décrit | + | + | Non décrit | + | + | A | Partiel | |
| Voyeur25 | T2 | Non décrit | + | + | + | + | + | + | N/D | Complet | |
| York et McCarter30 | D1 | + | Non décrit | Non décrit | + | Non décrit | + | Non décrit | N/R | Partiel |
Le symbole apositif (+) indique que le symptôme s’est produit. A = agitation ou agression, D = désorienté, FA = effet plat, R = agitation, RE = récalcitrance, T1 < 7 jours après un traumatisme crânien (TCC), T2 = 7-31 jours après un TCC, T3 = 31-365 jours après un TCC, T4 ≥1 an après un TCC, T5 = impossible à déterminer. Les symptômes du SGC sont présentés comme indiqué par Lilly et al.6
Admission à l’hôpital bAt sauf indication contraire.
TABLEAU 2. Symptômes et caractéristiques du syndrome de Klüver-Bucy (SGB)
Rétablissement dans le temps : Tous les sujets du cas (N = 24)
La réponse au traitement et l’amélioration des caractéristiques du SGC sont résumées dans le tableau 3. Parmi les rapports de cas inclus dans cet examen, 22 cas mentionnaient le rétablissement à partir de KBS (un rapport sur le rétablissement n’était pas disponible pour deux sujets de cas). Pour les 11 sujets de cas qui ont montré une amélioration positive de tous les symptômes de KBS, la durée du KBS variait entre 7 jours et 14 mois. Parmi les sujets de cas pour lesquels il y avait une amélioration partielle des symptômes (N = 6), certains symptômes de KBS ont complètement disparu, tandis que d’autres ont persisté à long terme. Pour cinq sujets de cas, il n’y a pas eu d’amélioration, avec des rapports de détérioration de la santé et de réduction de la capacité de fonctionnement.19,26,28 Dans un seul cas, une détérioration progressive des symptômes entraînant la mort a été rapportée.26 Il y avait une sous-déclaration du moment où les patients atteints de SGB ont été évalués au cours de leur séjour à l’hôpital, pendant leur réadaptation et après leur sortie de l’hôpital. Des évaluations des résultats à long terme de 12 mois ou plus après le TCC ont été enregistrées dans quelques cas (N = 5).19,20,25,28
| Étude | Cas | Amélioration des symptômes de KBS | Durée du KBS | Réponse et Résultat du traitement |
|---|---|---|---|---|
| Aygun et coll.24 | Positif | 5 jours | Amélioration complète | |
| Bhat et al.22 | Positif | 3 semaines | Asymptomatique | |
| Caro et Jimenez7 | Partiel | Amélioration progressive du comportement et de la cognition | ||
| Deginal et coll.23 | Partiel | 30% Amélioration du comportement et des symptômes de KBS lorsqu’elle est mesurée à 8 semaines après le TBI | ||
| Fiume et Fiume Garelli26 | Aucune amélioration | Décès | Détérioration progressive conduisant au décès | |
| Góscínski et coll.19,20 | 1 | Aucune amélioration | En cours | Capacité intellectuelle et fonctionnement réduits (7 ans) |
| Irritable, agressif verbalement, mauvaise mémoire, apathie et absence de libido (25 ans) | ||||
| Góscínski et coll.19,20 | 2 | Aucune amélioration | En cours | Troubles psychiatriques prolongés, inadaptation sociale, agression et automutilation |
| Hardy et Aldridge2 | Partiel | 15 jours | Amélioration de l’appétit, du langage et pas de commentaires sexuels 15 jours après le TBI | |
| Le trouble obsessionnel-compulsif et l’affect contondant ont persisté | ||||
| Hooshmand et coll.34 | Les crises positives | 1 an | se sont terminées en 24 heures; l’hyperoralité a disparu; amélioration de la concentration; amélioration substantielle de la mémoire | |
| Isern31 | Non déclaré | 4-5 mois | ||
| Kwiatwoski et coll.27 | 1 | Positif | Réussi à revenir efficacement au fonctionnement préaccident, y compris le travail | |
| Kwiatwoski et coll.27 | 2 | Partiel | Symptômes persistants d’hyperoralité 4 ans après le TCC | |
| Amélioration des habitudes alimentaires, de la matité émotionnelle, de l’émotivité, de la violence physique et de la gestion de la colère | ||||
| Lilly et coll.6 | Positif | 1 mois | ||
| Morcos et Guirgis32 | Non signalé | |||
| Moviat et coll.28 | 1 | Aucune amélioration | Pas de changement après 6 ans de rééducation | |
| Moviat et coll.28 | 2 | Aucune amélioration | Pas de changement après 3 ans de rééducation | |
| Moviat et coll.28 | 5 | Partiel | 2 ans | Signes pyramidaux bilatéraux améliorés |
| Pas de changement après 3 ans de rééducation | ||||
| Salim et coll.48 | Positif | Environ 7 jours | Résolu | |
| Abattoir29 | 1 | Positif | 3,5 mois | Résolution complète |
| Slaughter et coll.29 | 2 | Positif | 18 jours | Réduction des symptômes d’agitation / mastication des lèvres; les symptômes ne se sont pas reproduits |
| Smigelski et Boeve36 | Positif | 8 mois | Récupération neurocomportementale et neurocognitive impressionnante | |
| Voyeur35 | Positif | <3 mois | Amélioration positive (diminution progressive, arrêt des attaques violentes) | |
| Yoneoka et coll.25 | Positif | 14 mois | Symptômes transitoires de KBS; retourné au lycée puis au collège | |
| York et McCarter30 | Partiel | Amélioration de la mémoire résiduelle et de la cognition |
TABLEAU 3. Réponse au traitement Chez Les Sujets Atteints du Syndrome de Klüver-Bucy (KBS) (N = 12) Après TBI
Traitement pharmacologique
La prise en charge pharmacologique a été documentée dans 50 % des rapports de cas (N = 12). La prise en charge pharmacologique par la carbamazépine a été l’intervention la plus fréquemment rapportée (N = 10). L’utilisation d’antipsychotiques de première génération a été notée dans trois rapports de cas. Des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ont été prescrits dans trois cas. La prescription de deux médicaments ou plus a été notée dans quatre rapports de cas.7,27,29 Les détails de la prise en charge pharmacologique postaiguë sont résumés dans le tableau 4. Seuls deux rapports de cas indiquaient la durée du traitement à 4 ans, les autres rapports de cas ne mentionnant pas la durée du traitement médicamenteux.
| Étude | Cas | Pharmacothérapie |
|---|---|---|
| Bhat et al.22 | Carbamazépine; aucun autre détail fourni | |
| Cher Andim | Valproate changé en topiramate, quétiapine, propranolol, benztropine et halopéridol | |
| Deginal et Changty | Carbamazépine (200 mg par voie orale.) | |
| CGC19,20 | 1 | Carbamazépines |
| CGC19,20 | 2 | Carbamazépine (400 mg par voie intraveineuse.) |
| Hooshmand et coll.34 | Chlorpromazine (300 mg/jour) (discontinué) | |
| Carbamazépine (1 000 mg/jour) (commencé après la chlorpromazine) | ||
| Kwiatwoski et coll.27 | 1 | Halopéridol |
| Carbamazépine administrée par voie orale trois fois par jour (200 mg / par jour); taux sérique de 6 µg/ ml | ||
| Kwiatwoski et coll.27 | 2 | Carbamazépine administrée par voie orale trois fois par jour (200 mg / jour); taux sérique de 6 µg/ml |
| Morcos et Guirgis32 | Carbamazépine (400 mg par voie intraveineuse.) | |
| Slaughter et coll.29 | 1 | Carbamazépine (600 mg / jour); propranolol (aucun changement dans le comportement initial) |
| Trazodone | ||
| Sertraline (titrée à 150 mg); substituée par de la fluoxétine (40 mg le matin et 20 mg à midi) | ||
| Slaughter et coll.29 | 2 | Halopéridol; substitué par l’olanzapine |
| Lorazépam, acide valproïque, thiothixène et bromocriptine | ||
| Sertraline (150 mg / par jour) | ||
| Jean-Pierre 35 | Carbamazépine; taux sérique de 9 à 11 µg / ml pendant 3 semaines, puis de 8 à 9 ug / ml pendant 1 an |
TABLEAU 4. Pharmacothérapie Après TBI Chez des Sujets Atteints du Syndrome de Klüver-Bucy (N = 12) Après Un Traitement Initial en Milieu Aigu
Traitement Par Carbamazépine
La tranche d’âge des patients ayant reçu de la carbamazépine ou un autre médicament anticonvulsif était de 16 à 39 ans. Dans 10 des 12 cas dans lesquels un traitement pharmacologique a été décrit, la carbamazépine a été utilisée pour traiter les patients présentant des symptômes complets ou partiels de KBS. Dans ces cas, la dose de carbamazépine variait de 400 mg à 1 000 mg par jour.19,20,27,29,32,34,35 La surveillance des médicaments thérapeutiques pour adapter le traitement à la carbamazépine n’a été décrite que dans trois cas et visait à atteindre des taux sériques compris entre 6 et 11 µg / ml. Dans la plupart des cas, la carbamazépine a été utilisée en monothérapie, alors que dans deux cas, la carbamazépine a été associée au propranolol et à l’halopéridol, respectivement, ce qui a entraîné la résolution de la totalité ou de la majorité des symptômes.7,27,29 Malheureusement, peu de rapports de cas décrivaient des données sur les effets indésirables des médicaments utilisés dans la gestion des symptômes.
Réponse au traitement pharmacologique (12 cas)
La moitié des rapports de cas (N = 12) inclus dans cette revue décrivaient une prise en charge pharmacologique. Parmi ceux-ci, six cas ont été associés à une amélioration positive des symptômes, certains signalant une résolution complète des symptômes et un retour aux activités de pré-hospitalisation. Une amélioration partielle a été rapportée dans trois cas, certains symptômes du SGB s’améliorant avec le temps et d’autres persistants. Dans les deux cas définitifs de TCC rapportés par Góscínski et al.19,20 qui ont eu un long suivi de 3 et 25 ans, respectivement, des symptômes psychiatriques prolongés ont persisté avec une capacité de fonctionnement réduite. Dans 50% des cas ayant rapporté l’administration de carbamazépine, une amélioration positive des symptômes de KBS a été notée. Dans deux cas, une combinaison de médicaments n’incluait pas la carbamazépine, mais comprenait la sertraline, le thiothixène, la bromocriptine, le topiramate, l’halopéridol, le propranolol et la quétiapine.7,29 Les deux rapports de cas ont noté une amélioration progressive des symptômes liés spécifiquement à l’agitation.
Qualité méthodologique
La qualité méthodologique de chaque rapport de cas a été examinée selon le modèle d’évaluation critique des rapports de cas de l’Institut Joanna Briggs. Les questions qui constituent la base de l’évaluation critique sont incluses dans le supplément en ligne. Dans l’ensemble, il y avait des rapports clairs sur les caractéristiques démographiques du patient (question 1), son état clinique actuel (question 3) et les tests diagnostiques ou les méthodes d’évaluation (question 4). Seulement 13 rapports de cas (54.1%) ont décrit clairement les antécédents du patient dans un calendrier en fournissant des informations sur les antécédents médicaux et les antécédents familiaux pertinents (question 2), et seuls sept rapports de cas ont fourni des informations sur les préjudices et les conséquences inattendues (question 7). Les conclusions de l’évaluation critique pour les cas KBS inclus sont présentées dans le tableau 5.
| Étude | Cas | Q1 | Q2 | Q3 | Q4 | Q5 | Q6 | Q7 | Q8 | |
|---|---|---|---|---|---|---|---|---|---|---|
| Aygun et coll.24 | Y | Y | Y | Y | Y | S/O | N | Y | ||
| Bhat et al.t22 | Et | Et | Et | Et | Et | Et | N | Et | ||
| Cher et Jimenez7 | Et | Et | Et | Et | Et | Et | Et | Et | Et | |
| Deginal et Changement23 | Et | Et | Et | Et | Et | Et | N | Et | ||
| Fiume et Fiume Garelli26 | Et | N | Et | Et | N | N | N | N | ||
| Góscínski et coll.19,20 | 1 | Y | N | Y | Y | N | N | N | Y | |
| Góscínski et coll.19,20 | 2 | Y | N | Y | Y | N | N | N | Y | |
| Hardy et Aldridge2 | Y | N | Y | Y | N | Y | N | N | ||
| Hooshmand et coll.34 | Et | Et | Et | Et | Et | Et | Et | Et | Et | |
| Isern31 | Et | Et | Et | Et | Et | Peu clair | N | N | ||
| Kwiatwoski et coll.27 | 1 | Y | Y | Y | Y | Y | Y | N | Y | |
| Kwiatwoski et coll.27 | 2 | Y | Y | Y | Y | Y | Y | N | Y | |
| Lilly et coll.6 | Et | N | Et | Et | Et | Et | N | Et | ||
| Morcos et Guirgis32 | Et | Et | Et | Et | Et | Et | N | Et | ||
| Moviat et coll.28 | 1 | Y | N | Y | Y | N | N | Y | Y | |
| Moviat et coll.28 | 2 | Y | N | Y | Y | N | N | Y | Y | |
| Moviat et coll.28 | 5 | Y | N | Y | Y | N | N | Y | Y | |
| Salim et coll.48 | Y | N | Y | Y | S/O | N | N | Y | ||
| Slaughter et coll.29 | 1 | Y | Y | Y | Y | Y | Y | Y | Y | |
| Slaughter et coll.29 | 2 | Et | N | Et | Et | Et | Et | Et | Et | Et |
| Smigelski et Boeve36 | Et | N | Et | Et | N | Et | N | N | ||
| Voyeur35 | Et | Et | Et | Et | Et | Et | N | Et | ||
| Yoneoka et coll.25 | Y | Y | Y | Y | Y | Y | N | Y | ||
| York et McCarter30 | Y | Y | Y | Y | N | N | N | Y |
aN = ne répond pas aux critères, S.O. = sans objet, Q = question, Y = répond aux critères.
TABLEAU 5. Évaluation Critique des Rapports de cas post-TBI du Syndrome de Klüver-Bucy (KBS) Selon la Liste de contrôle d’évaluation de l’Institut Joanna Briggs pour les Séries de Casa
Discussion
À notre connaissance, il s’agit de la première revue systématique visant à identifier et à synthétiser les données probantes sur les BK secondaires aux TCC à partir des rapports de cas. À l’aide d’une stratégie de recherche définie appliquée à quatre bases de données de bibliothèques bibliographiques, nous avons identifié 24 rapports de cas qui répondaient aux critères d’inclusion et constituent le centre de cet examen. Malgré les limites méthodologiques associées aux rapports de cas, compte tenu de la rareté des KBS et du manque d’études avec des méthodologies de meilleure qualité, l’utilisation des rapports de cas offre des opportunités de mieux comprendre les KBS après l’ITC.
Dans la revue actuelle, l’hypersexualité, l’hyperoralité et le comportement agressif étaient les symptômes les plus courants du SGB. L’agnosie visuelle était le symptôme le moins courant. Gerstenbrand et coll.37 ont résumé leurs expériences avec des cas post-traumatiques de KBS, en rapportant des données cliniques sur 40 sujets diagnostiqués entre 1978 et 1981. Bien qu’aucune donnée de cas individuel n’ait été présentée, la fréquence des symptômes de KBS a été rapportée. Des symptômes de boulimie, de troubles de la mémoire, d’hyperoralité et d’agnosie visuelle se sont produits dans 30 cas. L’hypersexualité est survenue dans 18 cas et l’agressivité dans 11 cas. La persistance de l’hypersexualité à 1 an a été notée dans 12 cas, la boulimie dans huit cas et l’agressivité dans 10 cas. Bien que les sources des cas ne soient pas décrites, la majorité étaient des hommes (77,5%) et la tranche d’âge indique que la cohorte était plus jeune, car les enfants étaient inclus (âgés de 7 à 33 ans). Les différences peuvent refléter la nature hétérogène du TBI. On ne sait pas si les patients de l’étude de Gerstenbrand et al.37 avaient un TBI ou une autre lésion cérébrale acquise. Six sujets de cas sont décédés dans les 10 semaines suivant leur accident, et il est donc possible que les cas décrits dans le présent examen soient moins graves.
Bien que l’histoire naturelle du KBS post-TBI ne soit pas connue,23 il apparaît comme un état chronique et persistant pour certains patients et un état transitoire et résolvant pour d’autres.6 Des rapports de cas décrits dans le présent examen, la majorité des cas ont montré un rétablissement partiel ou complet. Pour la majorité des cas, l’évolution du KBS variait de 5 jours à 1 an. Pour les autres cas (N = 8), le syndrome était en cours 1 à 25 ans après son apparition, selon le moment où le patient a été évalué. Bien qu’il ne puisse être exclu que cela reflète un biais de publication de résultats positifs, l’étendue du rétablissement est conforme à l’étude de Formisano et al., 38 qui a examiné le résultat global de 19 patients atteints de KBS secondaire à une lésion cérébrale grave à la suite d’un accident de la circulation. À inclure dans Formisano et al.dans l’étude, les cas ont été comptés comme KBS s’ils présentaient deux des symptômes de KBS.38 Ceci est en contradiction avec la définition du SGC partiel, qui nécessite trois symptômes.6 Bien qu’aucune donnée sur les cas individuels n’ait été présentée, sur les 19 patients inclus dans le SGC, quatre n’ont pas retrouvé leur indépendance, six ont réussi à s’intégrer dans la famille et neuf ont réussi à s’intégrer au travail. En accord avec Formisano et al.résultats de la s38, les lésions des lobes temporaux étaient courantes dans les rapports de cas inclus dans la synthèse actuelle.
La nature et la localisation anatomique des lésions nécessaires à la production de KBS humains post-TBI n’ont pas été déterminées de manière définitive, en partie à cause des limites de l’imagerie structurelle courante actuelle. Les enquêteurs ont proposé un certain nombre d’hypothèses. Góscínski et coll.19,20 a proposé une lésion bilatérale du lobe temporal médiobasal à la suite d’un gonflement ou d’un œdème du cerveau et d’une compression des artères. Yoneoka et coll.25 a émis l’hypothèse que la symptomatologie du SGB pourrait refléter un dysfonctionnement transitoire induit par un œdème des lobes frontaux temporal et basal droit. Slaughter et coll.29 a proposé des combinaisons de défauts du lobe temporal frontal et antérieur postérieur, et de perturbations deginale et Changée23 a postulé des perturbations des voies reliant la thalmi dorsomédiale aux cortex préfrontaux et à d’autres zones limbiques. Il est à noter que l’étendue des déficits neurologiques n’était pas corrélée avec le niveau de troubles de la personnalité.27 Plus récemment, Caro et Jimenez7 ont proposé que le KBS résulte de lésions mésiotemporales ou d’autres modifications (éventuellement transitoires) conduisant à une hypofonctionnement de l’amygdale ou de ses projections, quelle que soit l’étiologie. Dans le cas du KBS transitoire, ils ont proposé que la disparition des symptômes du KBS suive une amélioration du dysfonctionnement neuronal localisé.
Un objectif secondaire de la revue actuelle était de comparer et de contraster les rapports de cas individuels décrivant la prise en charge pharmacologique des symptômes liés au KBS. Les directives françaises de la SOFMER sur les médicaments pour les troubles du comportement à la suite d’un TBI ont rapporté des preuves de niveau 4 de grade C pour l’utilisation de la carbamazépine.18 Cette étude était basée sur une seule série de cas de quatre patients traités par la carbamazépine.19,20 Aucune donnée sur la durée du traitement ou le moment auquel le traitement a été initié n’a été fournie. Aucune dose de carbamazépine n’a été rapportée pour le cas 1.
Les auteurs ont rapporté que les patients présentaient une amélioration, mesurée par l’échelle de résultats de Glasgow (GOS), à la sortie de l’hôpital, 3 mois et 6 mois après le traumatisme lorsqu’ils recevaient de la carbamazépine pendant l’hospitalisation et après la sortie.19,20 Le cas 2 n’a pas montré de changement dans le score GOS. La nature de l’amélioration n’a pas été décrite. Compte tenu de la complexité du syndrome, du fait que seuls deux cas peuvent être définitivement considérés comme un TBI, du manque d’informations pharmacologiques et du manque de rapports sur les symptômes qui se sont améliorés, les recommandations de directives basées sur cet article devraient au mieux être circonspectes.
Dix rapports de cas décrivant un traitement par la carbamazépine ont été inclus dans cette revue, et ils fournissent des preuves supplémentaires sur l’utilisation de la carbamazépine en relation avec le KBS. Une amélioration des symptômes a été observée dans les 3 semaines suivant le début de la carbamazépine,22 et dans un cas, une résolution complète des symptômes a été rapportée,34, mais aucun délai n’a été spécifié. D’autres cas ont signalé des améliorations générales des symptômes chez les patients prenant de la carbamazépine, mais, là encore, aucun délai n’a été mentionné pour les améliorations.23,27,34,35
La carbamazépine est un médicament antiépileptique dérivé de carboxamide avec une structure chimique similaire aux antidépresseurs tricycliques et est utilisée dans la prise en charge des troubles épileptiques, des douleurs neuropathiques et des troubles psychiatriques.39 L’efficacité de la carbamazépine en tant que médicament anticonvulsivant a été démontrée chez des patients atteints d’épilepsie du lobe temporal40 présentant des symptômes supplémentaires de nature similaire au KBS, ce qui pourrait être l’une des raisons de son utilisation. De plus, une rémission complète et partielle des symptômes après un traitement à la carbamazépine a été notée dans le KBS associé à une gamme d’étiologies autres que le TBI. Malheureusement, les rapports de cas de la présente étude n’ont pas indiqué en détail lequel des symptômes diagnostiques de KBS s’est amélioré. Des améliorations des symptômes comportementaux, hyperoraux et cognitifs ont été documentées.
Des 24 cas décrits dans cette revue systématique, 10 ont été traités par de la carbamazépine. Dans l’ensemble, les cas suggèrent que la carbamazépine peut être un traitement efficace pour certains symptômes du KBS. Parmi les cas traités par la carbamazépine, un taux résiduel sérique de carbamazépine > 6 µL/mL a été rapporté chez trois patients (plage thérapeutique optimale : 4-12 µL/mL). En raison de ses effets toxiques potentiellement graves (par exemple, ataxie, convulsions, réaction dystonique et même coma), il est crucial d’éviter une surdose de carbamazépine.39 Bien qu’une concentration minimale sérique de 6 µL/ml se situe toujours dans la plage recommandée, l’absence d’effet de la carbamazépine chez Slaughter et al.’s29 cas 1 peut-être associé à un niveau de creux sous-thérapeutique.
L’antipsychotique chlorpromazine présente généralement un effet sédatif élevé et un potentiel accru de symptômes extrapyramidaux. Dans le cas présenté par Hooshmand, la chlorpromazine 41 aurait pu être administrée en tant que traitement des symptômes psychotiques, et le traitement aurait alors pu être remplacé par la carbamazépine pour la gestion des crises à long terme.34 En termes d’efficacité, l’introduction précoce de la carbamazépine semble être importante, comme l’ont déclaré Góscínski et al.19,20
La prescription de plusieurs médicaments a été décrite dans quatre cas. Dans Slaughter et coll.dans le cas s29 2, le lorazépam et l’acide valproïque ont été prescrits. Le lorazépam est habituellement prescrit pour ses effets anxiolytiques, et son interaction pharmacocinétique rapportée avec l’acide valproïque pourrait entraîner des effets sédatifs encore aggravés.42 Dans Slaughter et coll.s29 cas 1, le patient a reçu plusieurs antidépresseurs, dont la sertraline et la trazodone. La sertraline a ensuite été substituée par la fluoxétine; les deux médicaments sont des ISRS. Certains symptômes de KBS présentent des caractéristiques de trouble obsessionnel-compulsif (TOC), et la sertraline à des doses plus élevées s’est avérée efficace avec le TOC.43 Cependant, la sertraline et la fluoxétine sont toutes deux métabolisées sur les voies communes du cytochrome P450, y compris le CYP2D6, et des interactions pharmacocinétiques peuvent être attendues dans le cas présent compte tenu de la succession rapide.44 L’antidépresseur trazodone, un puissant antagoniste des récepteurs de la sérotonine et de l’α1-adrénergique et un inhibiteur faible de la recapture de la sérotonine, a été administré avec la carbamazépine.45 La carbamazépine étant un inducteur connu du CYP3A4, des interactions potentielles pourraient être cliniquement pertinentes et exacerber la rémission des symptômes.46,47
Il est important de reconnaître que cet examen systématique est soumis à des restrictions qui sont une caractéristique des rapports de cas. Étant donné que les rapports de cas sont des études observationnelles rétrospectives, l’inférence causale ne peut pas être faite. Il existe un risque de biais de résultat positif, et on pourrait surinterpréter les caractéristiques de l’affaire en raison de l’importance différente accordée par les auteurs aux affaires. Pour l’examen en cours, les données manquaient pour certains des attributs collectés. La sous-déclaration du moment où les patients atteints de KBS ont été évalués pendant leur séjour à l’hôpital, pendant leur réadaptation et après leur sortie de l’hôpital limite l’interprétation de la durée des symptômes de KBS.
Comme il s’agit d’une expérience naturelle, le cas ne peut pas être répété et la prise en charge des patients atteints de SGC pourrait avoir changé au fil des ans. Étant donné que les articles évalués par des pairs sur KBS ne sont pas très courants, la stratégie de recherche n’incluait pas un large éventail de termes, et il est possible que des cas pertinents aient été manqués. Nous pensons que la probabilité de cela est faible compte tenu de la gamme de bases de données recherchées, du nombre de listes de références consultées et de la recherche de Google Scholar.
Malgré ces limites, les points forts de l’examen comprennent l’identification systématique des cas au moyen d’une stratégie de recherche spécifique et une évaluation critique de la qualité des rapports. De plus, aucune restriction de date ou de langue n’a été appliquée, et nous avons pu faire traduire trois études. L’examen rassemble 24 cas de KBS post-TBI, dont la moitié ont été traités par pharmacothérapie. Cette revue aidera les cliniciens à comprendre le spectre clinique du SGB post-IT et peut offrir des conseils sur la personnalisation des traitements en pratique clinique.
Conclusions
Cette revue systématique a identifié et synthétisé les preuves tirées de 24 rapports de cas de KBS post-IT. Les rapports de cas démontrent la présentation complexe des symptômes du SGC après le TCC. Le traitement par la carbamazépine a été associé à une amélioration des symptômes de KBS dans sept cas sur 10. Cependant, compte tenu de la qualité des preuves, il n’est pas possible de faire une recommandation de pratique dans la ligne directrice clinique en cours d’élaboration avec un certain degré de certitude. La mise à l’essai de cette intervention pour un patient dépend de la présentation clinique individuelle, de l’absence de réponse à d’autres traitements et de l’indication clinique.
Le professeur Hopwood a été consultant pour Bionomics, Eli Lilly, Lundbeck, Novartis et Servier et a reçu des subventions de recherche. Tous les autres auteurs ne font état d’aucune relation financière avec des intérêts commerciaux.
Soutenu par l’Institut de Recherche sur la Sécurité, la Compensation et le Rétablissement et l’Université Monash (par le biais de la stratégie de Neurotraumatisme, 2010-2015).
Les auteurs remercient leur spécialiste de l’information Farhad Shokraneh. Les auteurs remercient également Elena Pozzi pour la traduction de la langue.
1 Kluver H, Bucy P: Analyse préliminaire des fonctions des lobes temporaux chez le singe. Arch Neurol Psychiatry 1939; 42: 979-1000Crossref, Google Scholar
2 Hardy TL, Aldridge J: Syndrome traumatique transitoire de Klüver-Bucy. Surg Neurol 1981; 15:338-340Crossref, Medline, Google Scholar
3 Lanska DJ: Le syndrome de Klüver-Bucy. Avant Neurol Neurosci 2018; 41:77-89Crossref, Medline, Google Scholar
4 Trimble MR, Mendez MF, Cummings JL: Symptômes neuropsychiatriques des lobes temporolimbiques. J Neuropsychiatrie Clin Neurosci 1997; 9:429-438Link, Google Scholar
5 Shraberg D, Weisberg L: Le syndrome de Klüver-Bucy chez l’homme. J Nerv Ment Dis 1978; 166:130-134Crossref, Medline, Google Scholar
6 Lilly R, Cummings JL, Benson DF, et al.: Le syndrome de Klüver-Bucy humain. Neurologie 1983; 33: 1141–1145Crossref, Medline, Google Scholar
7 Caro MA, Jimenez XF: Déconnexion mésiotemporale et hypoactivité dans le syndrome de Kluver-Bucy: Série de cas et revue de la littérature. J Clin Psychiatrie 2016; 77:e982-e988Crossref, Medline, Google Scholar
8 Begum H, Nayek K, Khuntdar BK: Syndrome de Kluver-Bucy – une complication rare de l’encéphalite à herpès simplex. J Indian Med Assoc 2006; 104:637-638Medline, Google Scholar
9 Janati A: Syndrome de Kluver-Bucy dans la chorée de Huntington. J Nerv Ment Dis 1985; 173:632-635Crossref, Medline, Google Scholar
10 Kile SJ, Ellis WG, Olichney JM, et al.: Anomalies Alzheimer de l’amygdale avec symptômes du syndrome de Klüver-Bucy: variante amygdaloïde de la maladie d’Alzheimer. Arch Neurol 2009; 66:125-129Crossref, Medline, Google Scholar
11 Powers JM, Schaumburg HH, Gaffney CL: Syndrome de Klüver-Bucy causé par une adréno-leucodystrophie. Neurologie 1980; 30:1231–1232Crossref, Medline, Google Scholar
12 Pitt DC, Kriel RL, Wagner NC, et al.: Syndrome de Kluver-Bucy suite à un coup de chaleur chez une fille de 12 ans. Pediatr Neurol 1995; 13:73–76Crossref, Medline, Google Scholar
13 Jai KK, Singh SK, Kumar P, et al.: Syndrome partiel de Kluver-Bucy secondaire à une méningite tuberculeuse. Représentant du cas BMJ 2016; 2016:16Google Scholar
14 De Azevedo JPRPT, Vasques GL, Rocha CD, et al. Kluver-Bucy syndrome in a multiple sclerosis patient. J Neurological Sciences. 2013;1:e377–e378Crossref, Google Scholar
15 Devinsky O, Bear D: Klüver-Bucy syndrome in Pick’s disease. Neurology 1983; 33:957–959Crossref, Medline, Google Scholar
16 Varon D, Pritchard PB 3rd, Wagner MT, et al.: Transient Kluver-Bucy syndrome following complex partial status epilepticus. Epilepsy Behav 2003; 4:348–351Crossref, Medline, Google Scholar
17 Ozawa H, Sasaki M, Sugai K, et al.: Résultats de la tomodensitométrie à émission unique de photons et de la MR dans le syndrome de Klüver-Bucy après le syndrome de Reye. AJNR Am J Neuroradiol 1997; 18:540-542Medline, Google Scholar
18 Plantier D, Luauté J; Médicaments contre les troubles du comportement après lésion cérébrale traumatique: Revue systématique et consensus d’experts conduisant à des recommandations françaises de bonnes pratiques. Ann Phys Rehabilil Med 2016; 59:42-57Crossref, Medline, Google Scholar
19 Góscínski I, Kwiatkowski S, Polak J, et al.: Le syndrome de Kluver-Bucy. J Neurochirurgie Sci 1997; 41:269-272Medline, Google Scholar
20 Gościński I, Kwiatkowski S, Polak J, et al.: Le syndrome de Kluver-Bucy. Acta Neurochir (Vienne) 1997; 139:303–306Crossref, Medline, Google Scholar
21 Lippe S, Gonin-Flambois C, Jambaqué I: La neuropsychologie du syndrome de Klüver-Bucy chez l’enfant. Handb Clin Neurol 2013; 112: 1285-1288Crossref, Medline, Google Scholar
22 Bhat PS, Pardal PK, Das RC: Syndrome partiel de Kluver-Bucy en tant que manifestation retardée d’une blessure à la tête. Ind Psychiatrie J 2009;18:117–118Crossref, Medline, Google Scholar
23 Deginal A, Changty S: Post traumatic Kluver-Bucy syndrome: a case report. Ind J Neurotrauma. 2011; 8:41–42Crossref, Google Scholar
24 Aygun D, Guven H, Altintop L, et al.: Postcontusional Kluver-Bucy syndrome. Am J Emerg Med 2003; 21:246–247Crossref, Medline, Google Scholar
25 Yoneoka Y, Takeda N, Inoue A, et al.: Human Kluver-Bucy syndrome following acute subdural haematoma. Acta Neurochir (Wien) 2004; 146:1267–1270Crossref, Medline, Google Scholar
26 Fiume S, Fiume Garelli F: A case of Kluver Bucy syndrome probably caused by traumatic bitemporal injury. G Psichiatr Neuropatol 1968; 96:122–130Google Scholar
27 Kwiatkowski S, Starowicz A, Milczarek O, et al.: Neuropsychological characteristic of post-traumatic Kluver-Bucy syndrome. Arch Psychiatry Psychother 2011; 13:59–65Google Scholar
28 Moviat MAM, Janssen CLW, Jaeken D, et al.: Kluver-Bucy syndrome in brain injured children; neurological, neuroradiological, behavioural and neuropsychological findings. J Rehabil Sciences. 1995; 8:106-109Google Scholar
29 Slaughter J, Bobo W, Childers MK: Traitement sélectif des inhibiteurs de la recapture de la sérotonine du syndrome de Klüver-Bucy post-traumatique. Brain Inj 1999; 13: 59-62Crossref, Medline, Google Scholar
30 York HS, McCarter R: Syndrome de Kluver-Bucy après une blessure par balle faciale: un rapport de cas. PM R 2017; 9 (Supplément 1): S231Crossref, Medline, Google Scholar
31 Isern RD Jr: La violence familiale et le syndrome de Klüver-Bucy. Med Sud J 1987; 80:373-377Crossref, Medline, Google Scholar
32 Morcos N, Guirgis H: Un cas de syndrome de Kluver-Bucy partiel d’apparition aiguë chez un patient ayant des antécédents de lésion cérébrale traumatique. J Neuropsychiatrie Clin Neurosci 2014; 26: E10-E11Link, Google Scholar
33 Ak F, Yalcin Cakmakli G, Karakoc M, et al. Au-delà du syndrome de Kluver-Bucy: tableau clinique coloré de l’infarctus bilatéral de l’artère cérébrale antérieure. J Neurological Sciences 2013; 1: e648Crossref, Google Scholar
34 Hooshmand H, Sepdham T, Vries JK: Syndrome de Klüver-Bucy. Traitement réussi avec la carbamazépine. JAMA 1974; 229:1782Crossref, Medline, Google Scholar
35 Stewart JT: Carbamazepine treatment of a patient with Klüver-Bucy syndrome. J Clin Psychiatry 1985; 46:496–497Medline, Google Scholar
36 Smigielski JS, Boeve BF: Kluver-Bucy syndrome in traumatic brain injury: a case study. Arch Clin Neuropsychol 1997; 4:406Crossref, Google Scholar
37 Gerstenbrand F, Poewe W, Aichner F, et al.: Klüver-Bucy syndrome in man: experiences with posttraumatic cases. Neurosci Biobehav Rev 1983; 7:413–417Crossref, Medline, Google Scholar
38 Formisano R, Saltuari L, Gerstenbrand F: Présence du syndrome de Klùver-Bucy comme caractéristique pronostique positive pour la rémission des troubles traumatiques prolongés de la conscience. Acta Neurol Scand 1995; 91:54-57Crossref, Medline, Google Scholar
39 Patsalos PN, Berry DJ, Bourgeois BF, et al.: Antiépileptiques – lignes directrices sur les meilleures pratiques pour la surveillance des médicaments thérapeutiques: document de position de la Sous-Commission de la surveillance des Médicaments Thérapeutiques, Commission des Stratégies Thérapeutiques de l’ILAE. Epilepsia 2008; 49:1239-1276Crossref, Medline, Google Scholar
40 Goldenberg MM. Aperçu des médicaments utilisés pour l’épilepsie et les convulsions: étiologie, diagnostic et traitement. P T 2010; 35 (7): 392-415Medline, Google Scholar
41 Muench J, Hamer AM: Effets indésirables des médicaments antipsychotiques. Am Fam Physician 2010; 81:617-622Medline, Google Scholar
42 Anderson GD, Gidal BE, Kantor ED, et al.: Interaction lorazépam-valproate : études chez des sujets normaux et du foie de rat perfusé isolé. Epilepsia 1994; 35:221–225Crossref, Medline, Google Scholar
43 Ninan PT, Coran LM, Kiev A, et al.: Stratégie de sertraline à haute dose pour les non-réponses au traitement aigu du trouble obsessionnel-compulsif: un essai multicentrique en double aveugle. J Clin Psychiatry 2006; 67:15–22Crossref, Medline, Google Scholar
44 Spina E, Santoro V, D’Arrigo C: Interactions pharmacocinétiques cliniquement pertinentes avec les antidépresseurs de deuxième génération: une mise à jour. Clin Ther 2008; 30: 1206-1227Crossref, Medline, Google Scholar
45 Stahl SM: Mécanisme d’action de la trazodone: un médicament multifonctionnel. CNS Spectr 2009;14:536-546Crossref, Medline, Google Scholar
46 Sánchez-Romero A, Mayordomo-Aranda A, García-Delgado R, et al.: Interaction probable entre la trazodone et la carbamazépine. Pharmacopsychiatrie 2011; 44: 158–159Crossref, Medline, Google Scholar
47 Hachad H, Ragueneau-Majlessi I, Levy RH: Un outil utile pour l’évaluation des interactions médicamenteuses: Base de données sur les interactions médicamenteuses du métabolisme et du transport de l’Université de Washington. Hum Genomics 2010; 5:61-72Crossref, Medline, Google Scholar
48 Salim A, Kim KA, Kimbrell BJ, et al.: Syndrome de Klüver-Bucy à la suite d’un traumatisme crânien mineur. Med Sud J 2002; 95:929-931Crossref, Medline, Google Scholar