bioorganikus & Szerves Kémia
Hidroborációs-oxidációs reakció
a diborán cisz hozzáadása alkénkötéshez rendkívül hasznos hidratációs módszert biztosít. A diboránt nátrium-bórhidrid hozzáadásával állíthatjuk elő bór-trifluorid-éterát tetrahidrofuránban vagy éterben 0o-5oC-on. A diborán a borán dimerje (BH3) és stabil formája ennek a reagensnek (Scheme1).
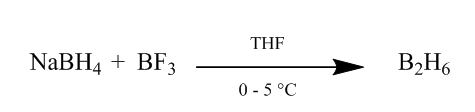
1. ábra a diborán nátrium-borohidridből történő kivonása
a diborán hozzáadása az alkénhez rendkívül gyors, és általában a reagens a kettő kevésbé akadályozott felületéből adódik. A cis-kiegészítést egy négyközpontú átmeneti állapot racionalizálta. A diborán alkénhez történő hozzáadásából származó boránkomplex a sztereokémia visszatartásával bázikus hidrogén-peroxiddal történő kezeléssel alkohollá alakul. Így az 1-metil-ciklohexén 1 A hidroboráció-oxidáció során transz-2-metil-ciklo-hexanol 2 képződéséhez vezet. A mechanisztikus utat a (2.séma). Az alkén alkohollá történő hidroborációs-oxidációs átalakításának módszerét számos természetes termék szintézisére alkalmazták. Az alábbiakban néhány példát mutatunk be.

2. ábra reakciómechanizmus transz-2-metil-ciklo-hexanollal való képződéshez 2
szintézise ( ~ ) junenol és ( ~ ) akalomon
a hidroborációs-oxidációs reakció alkalmazását figyelték meg Banerjee és munkatársai az eudesmone szeszkviterpének ( ~ ) junenol és ( ~ ) akalomon szintetizációja3 során. Ezen szeszkviterpének szintézisének elérése érdekében az alként 3, kiindulási anyagként választottuk ki, majd hidroborációs-oxidációnak vetettük alá, hogy 4 alkoholt kapjunk (3.reakcióvázlat). Az alkohol Jones-reagenssel történő oxidációjával nyert 5 ketont4 dietil-karbonáttal reagáltattuk. A kapott terméket metil-lítiummal kezeltük a 6 ketol előállításához, amelynek izopropil-ketonná történő átalakulását dehidratálással, illetve hidrogénezéssel végeztük. A keton fémhidrid redukciója, majd az ólom-tetraacetát5-tel történő oxidáció ciklohexánban 8 ciklikus étert eredményezett, amelyet krómsavval és ecetsavval történő oxidációval 9 ketoaciddá alakítottak át. Benzolban és piridinben ólom-tetraacetáttal végzett dekarboxilezés, majd 10% AgNO3-mal impregnált szilikagél feletti tisztítás, így az akolamon 10. Az akolamon 10 metanolban nátrium-borohidriddel történő redukciója, majd a kapott termék szublimációja junenol 11-et eredményezett.
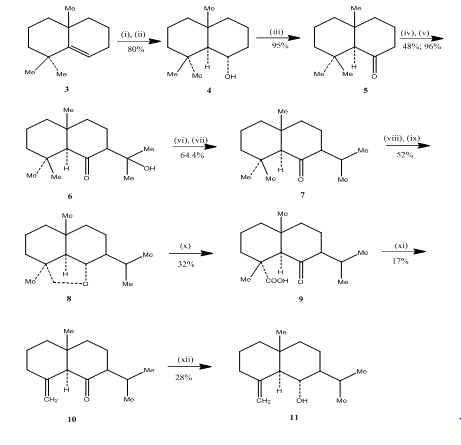
3. ábra az eudezmon-szeszkviterpének szintézise (6) junenol és (6) – akalomon
reagensek: I.BF3. Et2O, NaBH4, THF, 0-5 C; ii. NaOH (10%), H2O2 (30%); iii. CrO3/HMPT; iv. NaH, CO (OEt) 2, DME; v. MeLi, Et2O, reflux, 2H; vi. HCl(Conc), meoh; (VII) H2, pto2, meoh; (viii) Na, EtOH, reflux; (ix)Pb(OAc) 4, C6H12; (x) CrO3, AcOH; (xi)Pb(OAc) 4, C6H6, Py, reflux; (xii) NaBH4, EtOH.
a pisiferin sav szintézise
a hidroborációs oxidáció alkalmazását a pisiferin sav,6 a triciklusos diterpén szintézise során rögzítették, amely antibakteriális aktivitást mutat az összes vizsgált gram-pozitív baktérium ellen.7 a szintetikus útvonalat a 4. séma mutatja be. A 13 alkén hidroborációs-oxidációját, amelyet az ismert8 ketoalkoholból 12 készítettünk, jones-reagenssel oxidáltuk4, illetve fémhidriddel redukálva 14 alkoholt kaptunk. Oxidáció ólom-tetraacetát benzolban 250w volfrám lámpa adta a ciklikus éter 15. A ciklikus éter cinkkel, cink-jodiddal és ecetsavval való hasítása8 berendezett pisiferol 16. A pisiferol 17 észterré történő átalakulását hat lépésben értük el:
- metilezés dimetil-szulfáttal
- oxidáció jones reagenssel
- észterezés diazometánnal
- redukció nátrium-bórhidriddel
- Tozilezés
- Detozilezés
az L7 észtert alumínium-bromiddal és etán-tiollal történő hevítéssel 18 pisifersavvá alakítottuk át.
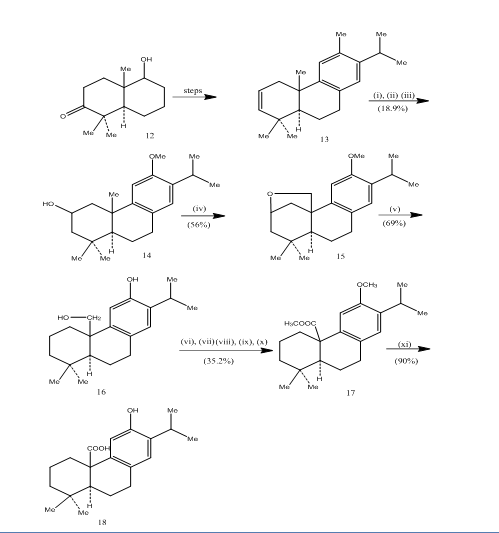
4. ábra 18 pisifersav szintézise
reagensek: (i) BF3.Et2O, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCrO4; (iii) LiAlH4, THF; (iv) Pb(OAc)4, CaCO3, C6H6, 250w volfrámlámpa; (v) Zn, ZnI, MeCOOH; (vi) Mezo4, Me2CO; (vii) H2SO4-HCrO4; (viii) CH2N2, Et2O; (ix) NaBH4, MeOH; (x) TsCl, Py; (xi) NaI, Zn por, DMF; (xii)AlBr3, (CH2SH) 2.
a hidroborációs-oxidációs reakciót alkalmaztuk a szintéziséhez ( ++ ) Eudes-4(14),7(11)-dién-8-on, 9 taxodion,10 norditerpén alkoholok11 és sok más terpén.12 Ezek a példák egyértelműen jelzik a bór-tifluorid-éterát alkalmazását az alkének alkoholokká történő átalakításában, majd ezek terpenoidvegyületekké történő átalakításában.
epoxidok hasítása
az epoxidok több reagenssel hasíthatók. A Lewis-sav-borontrifluorid-éterátot az epoxidok hasítására is alkalmazták, és sok esetben a kapott termék ketonná alakul át. Az epoxidok hasítását ciklizáció is kíséri. Ebben az áttekintésben megvitatták egyes epoxidok bór-trifluorid-éteráttal történő hasítását, valamint a kapott termékek felhasználását a természetes termékek szintézisében.
a 6-metoxi-2-tetralon szintézise
az epoxid bór-trifluorid-éteráttal történő hasítását használták13 a 6-metoxi-2-tetralone 20 szintéziséhez (5.reakcióvázlat), amely számos szerves vegyület szintézisének fontos kiválasztott kiindulási anyaga. Az alkén1319 epoxidálása, majd a nyerstermék diklór-metánban bór-trifluorid-éteráttal történő kezelése a 20 tetralont 36% – os hozammal eredményezte. Amikor a hasítást kénsavval próbáltuk, a teralone 20 hozama javult (39%), más másodlagos termékek képződésével együtt, így a kromatográfiás tisztítás nagyon fáradságos volt.
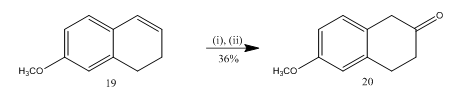
5. ábra 6-metoxi-2-tetralone 20
reagensek szintézise: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
a kuprán szintézise
az epoxidok bór-trifluorid-éterát általi átrendeződése nagyon hasznosnak bizonyult a szeszkviterpén-kuprán szintetizációja14 során. A szintetikus útvonalat a 6. séma írja le. A 6,6-dimetil-1-p-tolil-ciklohexén 21 az epoxidálás során jó hozammal biztosította a 22 epoxidot, amely a bór-trifluorid-éterát benzolban történő kezelésekor alacsony hozamú aldehid 23-at eredményezett. Az aldehid félkarbazonját kálium-hidroxiddal hevítettük, hogy elfogadható hozammal biztosítsuk a szeszkviterpén-kupránt 24. A szintézis vonzó a lépések rövidsége miatt. A 22 epoxid átrendezéséhez használt feltételek azért kritikusak, mert hajlamos a 25 ketonra való további átrendeződésre.
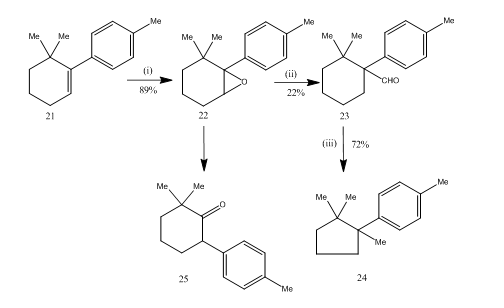
6. ábra a kuprán szintézise
reagensek: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
a karahana-éter
bór-trifluorid-éterát szintézisét az epoxid hasítására is alkalmazták15 a karahana-éter, egy Illékony monoterpén szintetizálása során, amelyet izoláltak16 Japán komló. A szintetikus útvonalat a 7. séma írja le. A 27 epoxid, amelyet a 26 diénből nyerünk, bór-trifluorid-éteráttal kezelve ciklizálódáson ment keresztül, így a 28 termék jött létre. A ciklizáció valószínűleg a 27 (i) köztiterméken keresztül történt. A fémhidrid redukció diolt eredményezett, amely a tozilezés során 29 karahanaether-t eredményezett. A hozam nincs meghatározva. Az epoxidok hasítását számos terpén,például rosenolactone,17 cyperolone, 18 maritimol szintézisére használták fel.19
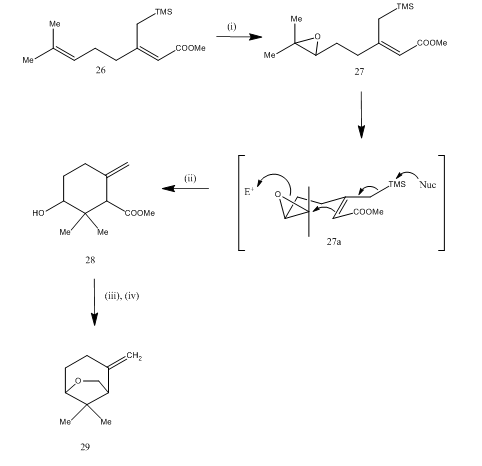
7. ábra a karahana-éter
reagensek szintézise: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
észterezés
észterezés gyakran használt reakció számos szerves vegyület szintéziséhez. A bór-trifluorid-éterát-alkohol nagyon kényelmes reagens számos p-amino-benzoesav, aromás, heterociklusos és telítetlen sav észterezésére.20 egyes észterezési reakciókban ennek a reagensnek a használata más reagensekhez képest jobb hozamot eredményezett. Néhány példa a 8. sémában található. A 30-32 savakat bór-trifluorid-éterát-alkohol reagenssel végzett kezelés során nagy hozammal 33-35 észterekké alakítottuk át. Marshall és munkatársai21 ugyanazt a reagenst használták a karbonsavak észterezéséhez. A Dymicky22 számos formátumot készített nagy hozammal hangyasavból és alkoholból katalitikus mennyiségű bór-trifluorid-metanol komplex jelenlétében. A többi katalizátor, például a kénsav, a p-toluol-szulfonsav nem volt olyan hatékony, mint a bór – trifluorid-metanol komplex.
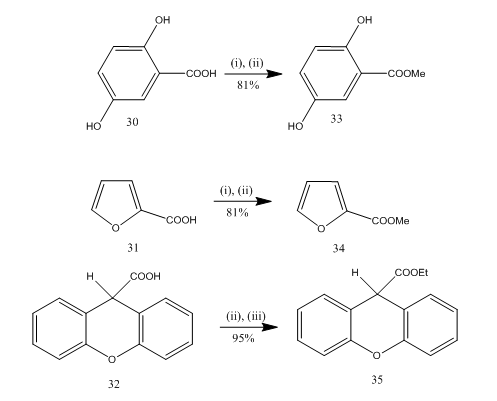
8. ábra savak észterezése 32-35
reagensek: (i) MeOH; (ii) BF3. Et2O; (iii) EtOH
Jackson és munkatársai23 hatékony módszert dolgoztak ki a 37-39 alkoholok és a 40-42 savak megfelelő hozamú, közvetlenül a megfelelő t-butil-származékokká történő átalakítására t-butil-triklór-acetidát 36 alkalmazásával, katalitikus mennyiségű bór-trifluorid-éterát jelenlétében, a 9.reakcióvázlat szerint. Ez a módszer jobban működik a savérzékeny csoportoknál, mint az izobutént alkalmazó hagyományos módszerek. A diol kevésbé akadályozott hidroxilcsoportja védhető, és kis léptékű munkára is alkalmas (elkerülve a gáznemű izobutén átadását). A t-butil-2,2,2-triklór-acetonitril 36 könnyen előállítható t-butanol triklór-acetonitril hozzáadásával. A legtöbb kísérletet diklór-metán és ciklohexán keverékének jelenlétében végeztük. Ecetsavanhidrid bór-trifluorid-éterát jelenlétében használtuk a hidroxilcsoport acetilezéséhez.24

9. ábra alkoholok és savak átalakítása t-butilszármazékokból.
reagensek: 36, (i) BF3.Et2O, (ii) CH2Cl2, C6H12
Ciklizálás
a bór-trifluorid-éterát fontos szerepet játszott számos karbonsav, allén stb. A következő néhány példa bemutatja a bór-trifluorid-éterát ciklizáló szerként betöltött szerepét. A 49 sav-kloridot és az 50 alként kondenzáltuk, hogy divinil-ketone25 51-t kapjunk, amely Nazarov-ciklizáláson ment keresztül26,27 az 52 ciklikus ketont berendezve, amelyet szeszkviterpén-trichodiénné alakítottunk át 53 (10.reakcióvázlat).
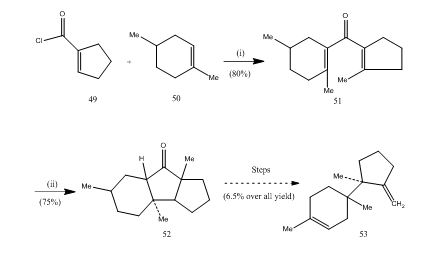
10. ábra szeszkviterpén-trichodién szintézise 53
reagensek: (i) SnCl4, NaOMe; (ii) BF3Et2O
számos allenil-aril-keton ciklizálódik bór-trifluorid-éteráttal, így metilén-benzociklopentenon új 5-endo-módú ciklizálással.28 Az 54-56 ketonok 57-59 benzociklopentenonokat adtak (11. reakcióvázlat). Valószínűleg az átalakulás az 54 allenil-aril-keton 57-re történő ciklizálásával történt. Megfigyelhető, hogy a szubsztituens csoportok jelenléte az aromás gyűrűben meghatározza a ciklizált termék hozamát. Kos és Loewenthal28 beszámoltak a 60 sav bór-trifluorid-éteráttal történő ciklizálásáról a 61 ketonra, amelyet három lépésben gibberone 62-re alakítottak át (12. reakcióvázlat) :
- Ketalizáció
- Huang-Minlon redukció és
- savas hidrolízis. A fent említett példák bór-trifluorid-éterát alkalmazását mutatják be szerves vegyületek ciklizálásában
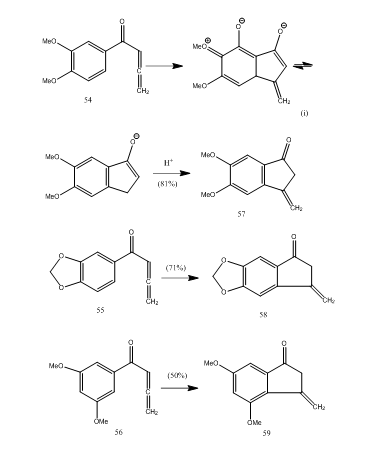
11. ábra Ciklopentenonok szintézise

12. ábra szintézis gibberonra
reagensek: i.BF3. Et2O; ii. a) C2H6O2; b) fok, N2H4, KOH, 190-200 C; C) H+