cikk
John Plante*, Chelsea Eason, Alan Snyder, Dirk Elston
Bőrgyógyászati és bőrgyógyászati sebészeti Tanszék, Dél-Karolinai Orvostudományi Egyetem, Charleston, Dél-Karolina
a Lichen planopilaris (LPP) egy elsődleges cicatricialis alopecia, amelyet a következő tünetek jellemeznek: pruritus, érzékenység, follikuláris tüskék és erythema az aktív Fázisban1-3. Bár a pontos etiológia nem ismert, a patogenezis krónikus, limfocita által közvetített gyulladást foglal magában,amely végül visszafordíthatatlan, hegesedő hajhulláshoz vezethet a szőrtüsző szelektív megsemmisítésén keresztül1, 2. Az LPP három változata létezik, és a klasszikus forma, a frontális fibrosing alopecia (FFA) és a Graham-Little-Piccardi-Lassueur szindróma (a fejbőr, a hónalj, a szemöldök és a pubis progresszív alopecia)2. Az LPP gyakran refrakternek bizonyul a standard terápiákkal szemben, és kiszámíthatatlan, visszaeső lefolyást követ, ami gyakran súlyosan csökkent életminőséghez vezet1, 2, 4, 5. Itt tovább tárgyaljuk a tofacitinib alkalmazásával kapcsolatos közelmúltbeli tanulmányunkat az ellenszenves LPP6 kezelésében.
számos terápiát alkalmaztak az LPP kezelésére változó sikerrel 1-3,5,7-9. Mivel a jelenleg rendelkezésre álló kezelések általában nem vezetnek a haj regrowth-hoz, a kezelés a hajhullás mértékének csökkentésére, a tünetek kezelésére és a gyulladás csökkentésére irányul2,9. Az első vonalbeli terápiák közé tartoznak az intralesionális és nagy hatékonyságú lokális kortikoszteroidok, de ezek fejbőr atrófiát eredményezhetnek, és veszélyeztethetik a jövőbeni hajátültetés sikerét. Egyéb lokális szerek esetében kisebb az atrophia kockázata, és ezek közé tartoznak a kalcineurin inhibitorok, a takrolimusz és a pimekrolimusz2. Bár nem szabályozza a mögöttes gyulladásos folyamatot,mind a helyi, mind az orális minoxidil felhasználható a haj regrowth maximalizálására azoknál a betegeknél, akik szintén öröklött mintázatú alopeciában szenvednek – a lakosság közel 50% – A9, 10. További szisztémás terápiák közé tartozik a hidroxiklorokin, a mikofenolát-mofetil, a ciklosporin, a metotrexát, a talidomid, a doxiciklin, a retinoidok, a pioglitazon, az 5-alfa-reduktáz inhibitorok és a rövid távú prednizolone1,2,9. A legújabb tanulmányok szerint az alacsony dózisú orális naltrexon, a vérlemezkékben gazdag plazma injekciók és a nem farmakológiai beavatkozások, például az excimer lézer, de egyik sem volt egységesen hatékony5, 7, 8. Bár a hajszálak és a hajhosszabbítások növelhetik a térfogatot, és alopeciás területeket fedhetnek le, óvatosan kell eljárni a vontatás elkerülése érdekében9.
egy nemrégiben közzétett tanulmányban a tofacitinib6 helyi és orális (szisztémás) formuláinak potenciálját vizsgáltuk. A tofacitinib egy Janus kináz (JAK) 1/3 inhibitor, amely számos immunmediált dermatológiai állapot ellen hatásos, beleértve az atópiás dermatitist, az alopecia areata-t és a vitiligo11-14-et. Immunmoduláló aktivitását a JAK/STAT jelátviteli út gátlása közvetíti 12, 13. Az LPP – ben az interferonok szerepet játszottak a lymphocytás toborzás elősegítésében és a kidudorodó hámsejtek immunválaszának elvesztésében1. A tofacitinib jak/STAT útvonalra gyakorolt hatása révén ez az interferon által közvetített gyulladás csökkenthető,ezáltal javítva a tüneteket és megelőzve a további follikuláris destrukciót1, 11-13.
feltártuk a tofacitinib terápiás potenciálját a refrakter LPP kezelésében egy retrospektív diagram áttekintésén6 keresztül. A szerzők tudomása szerint ez a második tanulmány, amely a tofacitinib alkalmazását vizsgálja az LPP kezelésében1. Vizsgálatunkban kilenc olyan beteg vett részt, akik más terápiában kudarcot vallottak – három helyi, öt szájon át alkalmazott, egy pedig mindkét készítményt alkalmazta.
egy beteg kivételével minden betegnél kedvező kezdeti választ sikerült elérni. A fennmaradó alany rosszul reagált a helyi kezelésre, de javult a szisztémás tofacitinib terápiával. Bár a betegek abszolút száma kicsi, a szisztémás kezelésben részesülőknél a jobb klinikai válasz irányába mutató tendencia volt, mint a helyi terápiában részesülőknél. A kedvező válasz kialakulásáig eltelt idő 1-7 hónap volt, 5 és 8 beteg esetében a kezelés első 3, illetve 5 hónapjában javulás mutatkozott.
jelenlegi gyakorlati mintánk a gyorsan progresszív betegség rövid prednizonnal vagy ciklosporinnal történő kezelése, majd lehetőség szerint próbáljon áttérni a helyi kalcineurin inhibitor terápiára (1.ábra). A betegek egy alcsoportja a napi 15-45 mg-os pioglitazon adagokkal a betegség remisszióját fogja elérni. A betegeket tájékoztatni kell a jelzett javallatról, a hatásosságra vonatkozó vegyes adatokról, valamint a hosszan tartó alkalmazás esetén a húgyhólyagrák dobozos figyelmeztetéséről. Gyakorlatunk az, hogy legfeljebb 9 hónap elteltével ne folytassuk a pioglitazont növekvő dózisokkal, lépésekben. A kiegészítő szerek közé tartozik a naltrexon napi 5 mg-os dózisa és az N-acetilcisztein napi háromszor 600-1200 mg-os dózisa. Excimer lézer, kézi keskeny sávú UVB vagy alacsony intenzitású lézer sapka terápiát gyakran alkalmaznak kiegészítő terápiaként azoknál, akik részleges választ kapnak. A hidroxi-klorokin alkalmanként előnyös lehet, de a klinikánkra utalt betegek többsége már kudarcot vallott a hidroxi-klorokin terápiában. Azok, akik nem reagálnak, metotrexát -, mikofenolát-mofetil-vagy tofacitinib-kezelést igényelhetnek. Legutóbbi tanulmányunk eredményei további támogatást nyújtanak ahhoz az elképzeléshez, hogy mind a helyi, mind a szisztémás tofacitinib életképes kiegészítő kezelési módok lehetnek refrakter esetekben. A hajbetegségek gyakran lassan reagálnak, és 3 hónapos időközönként újraértékeljük, hogy meghatározzuk a terápiára adott választ és az eszkaláció szükségességét.
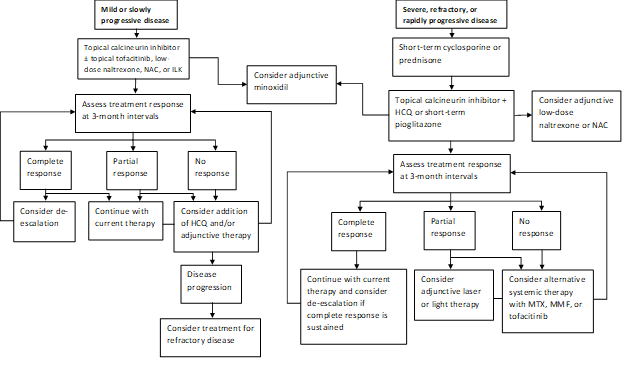
1. ábra: lépésenkénti kezelési algoritmus LPP
NAC, N-acetilcisztein; ILK, intralesionális kortikoszteroidok; HCQ, hidroxiklorokin; MTX, metotrexát, MMF, mikofenolát-mofetil
a tofacitinib gyakorlati alkalmazásának mérlegelésekor a szakembereknek egyensúlyba kell hozniuk a gyógyszer előnyeit annak kockázataival. Kohorszunk csak kisebb laboratóriumi rendellenességeket tapasztalt (egyet lokális, kettőt szisztémás terápián), amelyek nem igényeltek beavatkozást. A szolgáltatóknak azonban tisztában kell lenniük a gyógyszer felírásakor jelentkező lehetséges mellékhatásokkal, beleértve a fertőzés fokozott kockázatát, a citopéniákat, a hiperlipidémiát, a máj-és veseműködési rendellenességeket, valamint a tromboembóliás események lehetőségét14-16. Míg a lokális gyógyszerforma alacsonyabb plazmakoncentrációt mutatott, mint szisztémás megfelelője, a lokális kezelés során továbbra is jelentettek kisebb mellékhatásokat és laboratóriumi eltéréseket 13.
bár eredményeink ígéretesek, azokat több korlátozás mérlegelése után kell értelmezni. Retrospektív vizsgálati tervet használtunk, és nem tudtuk alkalmazni a betegség súlyosságának validált mértékét, például a Lichen Planopilaris aktivitási indexet (LPPAI)1,3. Az LPPAI alkalmas prospektív tanulmányokra, és szabványosított eszközt biztosít, amellyel a szolgáltatók közvetlenül összehasonlíthatják az eredményeket a különböző kezelési módok között. A terápiás válasz értékeléséhez olyan jeleket és tüneteket használtak, mint az erythema, az érzékenység, a follikuláris tüskék jelenléte és az érintett terület, de a jövőbeni vizsgálatoknak tartalmazniuk kell az életminőség mérését is. A megfigyelő elfogultságának lehetősége nem zárható ki, mivel Vizsgálatunk vak és nem randomizált volt.
ezenkívül a teljes kohorszunk a tofacitinibet kiegészítő módon alkalmazta, megnehezítve a gyógyszer független hozzájárulásának értékelését. Egy korábbi vizsgálatban a kohorsz egy része (N=5) monoterápiaként alkalmazta a tofacitinibet, és a legtöbb alany kedvező eredményeket ért el, de ezt a vizsgálatot a kis mintaméret és a retrospektív kialakítás is korlátozta1.
a jelenlegi tanulmányokat kis mintaméretük és retrospektív vizsgálati terveik korlátozzák, és a jól megtervezett prospektív vizsgálatokra nagy szükség van. Javasoljuk a terápia fokozatos megközelítését a káros hatások kockázatának minimalizálása érdekében. A maradandó hegesedés kockázatát mérlegelni kell a súlyos nemkívánatos események kockázatával szemben, figyelembe véve az egyes betegtényezőket és társbetegségeket, és a betegeknek aktív partnereknek kell lenniük a döntéshozatalban. A hajátültetés megfontolható, ha a betegség kontrollját sikerült elérni és a gyulladás alábbhagyott. Fontos megjegyezni, hogy agresszív terápiára, például prednizonra vagy ciklosporinra általában a transzplantációt követő hetekben van szükség a betegség fellángolásának elkerülése érdekében. Az átültetett szőrszálak fokozatos kopása még a sikeres transzplantáció után is várható, de az adatok arra utalnak, hogy a betegek általában elégedettek az eredményekkel, és úgy találják, hogy a transzplantáció javítja az életminőséget.
rövidítések
LPP, lichen planopilaris; FFA, frontális fibrosing alopecia; JAK, Janus kináz; STAT, transzkripciós fehérjék jelátalakítója és aktivátora; LPPAI, Lichen Planopilaris aktivitási Index.
összeférhetetlenség
a szerzők nem nyilatkoznak összeférhetetlenségről.
- Yang CC, Khanna T, Sallee B, et al. Tofacitinib a lichen planopilaris kezelésére: esetsorozat. Dermatol Ther. 2018; 31(6): e12656. doi:10.1111 / dth.12656
- Babahosseini H, Tavakolpour S, Mahmoudi H, et al. Lichen planopilaris: retrospektív vizsgálat 291 beteg jellemzőiről és kezeléséről. J Dermatolog Kezelésére. 2019; 30(6): 598–604. doi:10.1080/09546634.2018.1542480
- Chiang C, Sah D, Cho BK, et al. Hidroxiklorokin és lichen planopilaris: a Lichen Planopilaris aktivitási Index pontozási rendszer hatékonysága és bevezetése. J Am Acad Dermatol. 2010; 62(3): 387-392. doi: 10.1016 / j. jaad.2009.08.054
- Alirezaei P, Ahmadpanah M, Rezanejad a, et al. A kontrollokhoz képest a Lichen Planopilaris-ban szenvedő egyéneknél nagyobb a depresszió, alacsonyabb az önbecsülés és alacsonyabb az életminőség. Neuropszichobiológia. 2019; 78(2): 95-103. doi:10.1159/000499135
- Jha AK. Vérlemezkében gazdag plazma kiegészítő kezelésként a lichen planopilaris – ban. J Am Acad Dermatol. 2019; 80(5): e109-e110. doi: 10.1016 / j. jaad.2018.09.013
- Plante J, Eason C, Snyder a, et al. Tofacitinib a lichen planopilaris kezelésében: retrospektív áttekintés . J Am Acad Dermatol. 2020; S0190-9622(20) 30979-8. doi:10.1016 / j. jaad.2020.05.104
- Lajevardi V, Salarvand F, Ghiasi M, et al. Az alacsony dózisú orális naltrexon hatásossága és biztonságossága a placebóhoz képest lichen planopilaris-ban szenvedő betegeknél: randomizált, kontrollos klinikai vizsgálat . J Dermatolog Kezelésére. 2020; 1-5. doi:10.1080/09546634.2020.1774488
- Lee B, Elston DM. A naltrexon alkalmazása dermatológiai körülmények között. J Am Acad Dermatol. 2019; 80(6): 1746-1752. doi: 10.1016 / j. jaad.2018.12.031
- Bolduc C, Sperling LC, Shapiro J. elsődleges cicatricialis alopecia: Lymphocytás primer cicatricialis alopecia, beleértve a krónikus bőr lupus erythematosus, lichen planopilaris, frontális fibrosing alopecia és Graham-Little szindróma. J Am Acad Dermatol. 2016; 75(6): 1081-1099.
- Vano-Galvan S, Trindade De Carvalho L, Saceda-Corralo D, et al. Az orális minoxidil javítja a háttér hajvastagságát a lichen planopilaris – ban . J Am Acad Dermatol. 2020; S0190-9622(20) 30566-1. doi: 10.1016 / j. jaad.2020.04.026
- Tegtmeyer K, Zhao J, Maloney NJ, et al. Off-label vizsgálatok a tofacitinibről a bőrgyógyászatban: áttekintés . J Dermatolog Kezelésére. 2019; 1–11. doi:10.1080/09546634.2019.1673877
- Montilla AM, Gomez-Garcia F, Gomez-Arias PJ, et al. Az atópiás dermatitiszben, vitiligóban és Alopecia Areata-ban a Jak/STAT útvonalat célzó gyógyszerek használatának átfogó áttekintése. Dermatol Ther (Heidelb). 2019; 9(4): 655–683. doi: 10.1007 / s13555-019-00329-y
- Hosking AM, Juhasz M, Mesinkovska NA. Helyi Janus kináz inhibitorok: a bőrgyógyászatban alkalmazott alkalmazások áttekintése. J Am Acad Dermatol. 2018; 79(3): 535–544. doi: 10.1016 / j. jaad.2018.04.018
- Shreberk-Hassidim R, Ramot Y, Zlotogorski A. Janus kináz inhibitorok a bőrgyógyászatban: szisztematikus áttekintés. J Am Acad Dermatol. 2017; 76(4): 745-753.e19. doi: 10.1016 / j. jaad.2016.12.004
- Xeljanz/Xeljanz XR (tofacitinib) . New York, NY: a Pfizer Inc. Pfizer Laboratories részlege. https://labeling.pfizer.com/showlabeling.aspx?id=959; 2019. Hozzáférés 7.Július 2020-Én.
- FDA. Biztonsági vizsgálat megállapítja a vérrögök kockázatát a tüdőben és a halál magasabb dózisú tofacitinib (Xeljanz, Xeljanz XR) rheumatoid arthritisben szenvedő betegeknél; FDA vizsgálni. https://www.fda.gov/drugs/drug-safety-and-availability/safety-trial-finds-risk-blood-clots-lungs-and-death-higher-dose-tofacitinib-xeljanz-xeljanz-xr; 2019. Hozzáférés Július 6, 2020.