kálium-kromát
kálium-kromát kémiai tulajdonságai,felhasználása,előállítása
szervetlen vegyület
kálium-kromát, közismert nevén tarapacaite, egy szervetlen vegyület, amely sárga ortorombikus vagy hatszögletű kristály szobahőmérsékleten. A relatív sűrűség 2,732, olvadáspontja 968 C. mérgező, vízben feloldódhat, alkáli kromátion hidrolízis oldatot képezve. Alkoholban és éterben nem oldódik. Sav hozzáadása után a kálium-kromát sárga oldata narancssárgává válik, amely a dikromát színe. Egyensúly van a kromát és a dikromát átalakulása között az oldatban: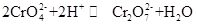
amikor a savat hozzáadjuk a kálium-kromát oldathoz, az egyensúly a kálium-dikromát előállításának irányába tolódik el, és amikor az alkálifémet hozzáadjuk a kálium-dikromát oldathoz, az egyensúly a kálium-kromát előállításának irányába tolódik el. A kálium-kromát oxidatív tulajdonságokkal rendelkezik, és lúgos közegben reagálhat a redukálószerrel Cr(OH)4-(nevezetesen CrO2 -) képződésre. Ha a kálium-kromát oldathoz különböző báriumion -, ólomion-és ezüstion-oldatokat adunk, a megfelelő oldhatatlan kromátot kapjuk: bárium-kromát BaCrO4 (sárga), ólom-kromát pbCrO4(Sárga), Ezüst-kromát Ag2CrO4 (téglavörös). A kromátionok jelenléte ezen oldhatatlan kromátok jellegzetes színével is kimutatható. A kálium-kromát analitikai reagensként, oxidálószerként, marószerként, fém rozsda-gátlóként használható, és bárium-és ezüstnyomelemzéshez használható. Azt is fel lehet használni, mint a nyersanyagok a cserzés és a gyógyszeripar és más krómvegyületek. A kromit Fe (CrO2)2 por nyersanyagként használható, kálium-hidroxiddal, mészkővel (dolomit) kalcinálva a levegőben, majd kálium-szulfát oldattal extrahálva kálium-kromátot kapunk.
a fenti információkat Xiao Nan, a Chemicalbook szerkesztette.
kálium-kromát indikátor módszer
kálium-kromát indikátor módszer, más néven Moore (Mohr), egy Csapadék titrálási módszer (ezüst módszer), amely kálium-kromátot (K2CrO4) használ indikátorként és ezüst-nitrátot (AgNO3) standard megoldásként. Ezt a módszert elsősorban klórion (Cl-) vagy bromidion (Br -) meghatározására használják. Adjon hozzá egy kis mennyiségű K2CrO4-et indikátorként, mielőtt meghatározná a meghatározást, majd titrálja AgNO3 standard oldattal. A titrálás megkezdése után először fehér (ezüst-klorid) vagy halványsárga (ezüst-bromid) Csapadék kicsapódik. Amikor a CL-vagy Br-mennyiségileg kicsapódik, egy kis felesleges ezüst-nitrát oldat az Ag+ koncentrációját hirtelen növeli, hogy azonnal téglavörös ezüst-kromát (Ag2CrO4) kicsapódást generáljon, jelezve a titrálási végpontot. A titrálási módszer két fő problémája az indikátor mennyisége és az oldat savassága. Ha a K2CrO4 koncentráció túl magas, a titrálási oldat színe túl mély lesz ahhoz, hogy a végén akadályozza az Ag2CrO4 Csapadék színének megfigyelését; ha a K2CrO4 koncentráció túl alacsony, akkor az ezüsthalogenid mennyiségi kicsapódása után túlzottan jelentős mennyiségű ezüst-nitrát oldatra lesz szükség az ezüst-kromát kicsapódásának előállításához a titrálási végpont utasítására, ami a titrálási hiba növekedését eredményezi. Amikor a 0,1 mol/l AgNO3 oldatot használjuk a 0 titrálásához.1mol / l halogenid, ha a k2cro4 koncentrációja 5 60-3 mol / l, akkor a végponthiba csak +0,06%, ami feltételezhető, hogy az elemzési eredmény pontosságát ez nem befolyásolja. A K2CrO4 indikátor módszer nem hajtható végre savas vagy lúgos oldatban, mert a K2CrO4 kis pH-értéken kálium-dikromáttá (K2Cr2O7) alakul át, az Ag+ pedig ezüst-oxid (Ag2O) formájában csapódik le, ha a pH túl magas. Általában a megfelelő savassági tartomány pH = 6,5~ 10,5, de ha ammóniumsók vannak oldatban, akkor az oldat savassága pH = 6,5~7,2 megfelelő.
a kálium-kromát indikátor módszer csak a Cl-vagy Br-ionok közvetlen titrálására használható, és a titrálási eredmény az összes együttélés esetén. Ez a módszer nem alkalmas jodidion (I-) vagy tiocianátion (SCN -) meghatározására, mivel az ülepítés során túl könnyen felszívódnak, és a végpont nem egyértelmű. Ez a módszer szintén nem alkalmas Ag+ titrálására Cl-, de az Ag+ meghatározható a hátsó titrálással, nevezetesen túlzott mennyiségű NaCl standard oldatot adunk a vizsgálati oldatba, majd AgNO3 standard oldatot használunk a felesleges Cl-ionok titrálására. Az oldatban az összes kation, amely csapadékot képezhet Cro-val2-4 vagy az anionok, amelyek kicsapódhatnak Ag-val+ zavarja a meghatározást. A kálium-kromát indikátor módszert elsősorban a nagyon híg oldatban lévő Cl-ionok meghatározására használják, például az ivóvízben és az ipari termékek szennyeződéseinek meghatározására.
kálium-dikromát
a kálium-dikromát, más néven vörös alumínium-kálium, narancsvörös triklin kristály vagy tűszerű kristály. A sűrűség 2,676 g / cm3. Az olvadási hőmérséklet 398 C. Vízben oldódik, etanolban nem oldódik. Erős oxidáló tulajdonsággal rendelkezik, és bomlik 1300 kb C.
a termelés során a kálium-dikromátot mindig króm bevezetésére használják, hogy olvadáskor a zománc színeződjön. Ez a színezőanyag színes titán tej sárga máz és titán sárga máz, és a használt dózis általában 0,06%~0,12%. A kálium-dikromát és a réz-oxid is keverhető-zöld, bambusz zöld, gyümölcs zöld és más színű mázhoz. Ezek a színes mázak azonban a kromát hatása miatt általában kevésbé fényesek.
a króm-oxidból vagy kálium – (nátrium) – dikromátból nyert színes máz gyakran sárga-zöld, mivel az olvasztási folyamat során a krómionok vegyértékváltozása következik be. Kálium-dikromát is gyakran használják, hogy a különböző zöld pigmentek és rózsaszín pigmentek.
a kálium-dikromátnak meg kell felelnie az előírt célértékeknek: kálium-dikromát-tartalom 99%, klorid-tartalom (CL) 0,08%, vízben oldhatatlan 0,05%.
a fenti információkat Yaoyao, a Chemicalbook összeállította.
Oldhatóság vízben (g/100 ml)
oldott gramm / 100 ml víz különböző hőmérsékleteken (C):
60 g/10 °C; a 63,7 g/20 °C; 66.7 g/30 °C; 67.8 g/40 °C
70.1 g/60 °C; 74.5 g/90 °C
Toxicitás
Lásd nátrium-kromát
Kémiai tulajdonságok
citromsárga orthorhombic kristály; vízben Oldódik; alkoholban nem oldódó
Alkalmazás
Használt analitikai reagens, antioxidáns, mordant fém rozsda gátló;gyártásához használt kromát,használni, mint antioxidáns, valamint mordant a nyomtatás, festés. Használt tinta, festék, zománc, fém korrózió és így tovább, elsősorban a gyártás kémiai reagensek és pigmentek.
előkészítés
semlegesítési módszer: Oldjuk fel a kálium-dikromátot az anyalúgban és a vízben, majd adjuk hozzá a keveréket a reaktorhoz. Ezután keverés közben adjunk hozzá kálium-hidroxidot a semlegesítési reakció elvégzéséhez. Az előállított kálium-kromát gyengén lúgos, majd koncentráció céljából elpárologtatjuk, kristályosítás céljából lehűtjük, elválasztjuk és szárítjuk, hogy a kész kálium-kromáttermékeket kapjuk.
K2Cr2O7 + 2koh ~ 2k2cro4 + H2O
az elválasztott anyalúg visszakerül az oldási lépésbe a kálium-dikromát feloldásához.
kémiai tulajdonságok
citromsárga kristályok
kémiai tulajdonságok
a kálium-kromát(VI) sárga kristályos szilárd anyag.
használ
kálium-kromát (K2CrO4) vízben oldódik, és használják, hogy világos sárga tintákés festék pigmentek. Kémiai laboratóriumokban reagensként, valamint marószerként használják a színezékek színes textíliákban történő” rögzítésére”.
használ
oxidálószerként használják.
használ
van egy korlátozott alkalmazás zománcok, befejező bőr, Rozsdamentesítő Fémek, helyébe a nátriumsó; reagensként analitikai kémia.
meghatározás
ChEBI:2: 1 arányban kálium-és kromátionokból álló káliumsó.
meghatározás
az ioncro-t tartalmazó só42 -.
meghatározás
kálium-kromát: élénksárga kristályos szilárd anyag, K2CrO4, vízben oldódó, alkoholban nem oldódó; rombos; r.d. 2,73; m.p. 968,3 C; forrás nélkül bomlik. Iparilag porított kromitérc kálium-hidroxiddal és mészkővel történő pörkölésével állítják elő, majd a keletkező salak forró kálium-szulfát oldattal történő kimosásával. A káliumkromátot a bőrben használjákbefejező, mint Textil marószer, valamint inenamelek és pigmentek. A laboratóriumbanés indikátorként használják. Mintmás króm (III) vegyületek eztoxikus lenyelés vagy belélegzés esetén.
Általános leírás
a kálium-kromát sárga kristályos szilárd anyag. A kálium-kromát vízben oldódik. Az elsődleges veszély a környezetet fenyegető veszély. Azonnali lépéseket kell tenni a környezetre való terjedésének korlátozása érdekében. A kálium-kromátot kémiai analízisben, festékek és tinták pigmentjeinek előállításában, gombaölő szerként és más krómvegyületek előállításához használják.
levegő & víz reakciók
vízben oldódik.
reaktivitási profil
az oxidálószerek, mint például a kálium-kromát , reakcióba léphetnek a redukálószerekkel, hogy hőt és gáznemű termékeket termeljenek (ami zárt tartályok nyomás alá helyezését okozza). A termékek maguk is képesek lehetnek további reakciókra (például a levegőben történő égésre). Az ebbe a csoportba tartozó anyagok kémiai redukciója gyors vagy akár robbanásveszélyes is lehet, de gyakran iniciálást igényel (hő, szikra, katalizátor, oldószer hozzáadása). Szervetlen oxidálószerek robbanásveszélyes keverékei redukálószerekkel gyakran hosszú ideig változatlanul maradnak, ha az iniciáció megakadályozható. Az ilyen rendszerek jellemzően szilárd anyagok keverékei, de a fizikai állapotok bármilyen kombinációját magukban foglalhatják. Néhány szervetlen oxidálószer a vízben oldódó fémek sói; az oldódás hígítja, de nem semmisíti meg az ilyen anyagok oxidáló erejét. A szerves vegyületek általában redukáló erővel rendelkeznek, és elvileg képesek reagálni az ebbe az osztályba tartozó vegyületekkel. A tényleges reaktivitás nagymértékben változik a szerves vegyület azonosságától függően. A szervetlen oxidálószerek hevesen reagálhatnak aktív fémekkel, cianidokkal, észterekkel és tiocianátokkal.
veszély
Lenyelve és belélegezve mérgező.
egészségügyi veszély
a belégzés a nyálkahártyák helyi irritációját okozza; a folyamatos orrirritáció az orrszeptum perforációját eredményezheti. Lenyelés heves gastroenteritist, keringési összeomlást, vertigo-t, kómát és toxikus nephritist okozhat; túlzott mennyiségek lenyelése végzetes lehet. A szembejutást okoz súlyos irritáció, kötőhártya-gyulladás. Ismétlődő vagy hosszabb expozíció por, köd, vagy azokat a megoldásokat, bőrgyulladást okozhat; kapcsolat megszakad, a bőr okozhat `chrome sebek” jelennek meg, mint a lassú gyógyulás, nehéz keretes fekély, amely hagyja el a területet téve a fertőzés.
tűzveszélyes
Viselkedés Tűz: növelheti intenzitása tüzet, ha érintkező éghető anyagok. Hűtsük le a tartályokat és a kiömlött anyagot bő vízzel.
biztonságossági profil
megerősített karcinogénkísérleti tumorigéniás adatokkal. Méreg lenyeléssel, intravénásan, szubkután ésintramuszkuláris úton. Egy kísérleti teratogén. Egyéb kísérleti reproduktívhatásokat. Emberi mutációs adatok jelentettek. Erős oxidálószer. Melegítvekompozíció mérgező füstöket bocsát ki a K2O-ból.a gyapjú marószerként használják, oxidálóés színezékek kezelése az anyagokon. Lásd mégkrómvegyületek.
potenciális expozíció
kálium-kromátot használnak a nyomtatásban: fotomechanikus feldolgozás; króm pigment előállítása; és gyapjú tartósító módszerek; színezékek, pigmentek, festékek és zománcok készítéséhez; oxidálószerként; analitikai reagens; galvanizálásban; robbanóanyagok.
szállítás
UN1479 oxidáló szilárd anyag, m.o. s., veszélyességi osztály: 5.1; címkék: 5.1-oxidálószer, MŰSZAKI megnevezés szükséges. UN3288 mérgező szilárd anyagok, szervetlen, n.o. s., veszélyességi osztály: 6.1; címkék: 6.1-mérgező anyagok, Műszaki megnevezés szükséges
tisztítási módszerek
Kristályosítsa ki vezetőképes vízből (0,6 g/mL 20o-nál), és szárítsa meg 135o és 170o között.
Inkompatibilitások
erős oxidálószer. Erőszakos reakciók éghető anyagokkal, szerves anyagokkal, porított fémekkel; vagy könnyen oxidálható anyagok. A hidroxilaminnal való érintkezés, a hidrazin robbanást okoz.