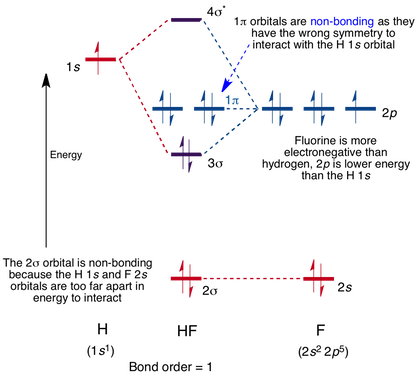
MO for HF
molekuláris pályák heterogén Diatómiás molekulák számára
a heterogén diatómás molekulák molekulapálya (Mo) elméletének egyszerű megközelítése az energiaszint diagram bemutatása. A MO energiaszintek a következő lépésekkel dolgozhatók ki:
emlékezzünk arra, hogy az n kvantumszám \(E_n\) energiája egy atomos elemhez tartozik Z megközelítőleg
\
A Z helyett a \(z_{eff}\) – t használjuk, ami azt jelenti, hogy módosítanunk kell az atomszámot, hogy hatékony atomtöltést kapjunk a mag számára. Mivel közelítő értékekkel van dolgunk, közvetlenül használhatjuk a Z-t. Az 1s orbitális energiaszint -13,6 eV hidrogénatomok esetében, ionizációs energiaként mérve H.
így a kvantumszám esetében n = 1, az 1s energiaszintje he megközelítőleg – 54 eV. Hasonlóképpen, az F 1S energiaszintje – 1101 eV. A He 2s és 2P energiaszintje körülbelül-13,6 eV, ami megegyezik az 1s h orbitális pályájával.
így a Li 2S energiaszintje körülbelül -6 eV. A többelektronos atomok esetében azonban a P-alhéj és az s-alhéj különböző energiákkal rendelkezik a penetráció miatt. Ezen a szinten nem lehetünk pontosak, hanem egyszerűen azt gondoljuk, hogy a 2p pályák nagyobb energiájúak, mint a 2s pálya. Általában az egymáshoz hasonló energiaszintű atompályák átfedik egymást, hogy molekuláris pályákat képezzenek. Így megfeleltetjük az atompályák energiaszintjét, majd kötési és anti-kötési Mo-kat készítünk belőlük.
Ha azonban az atompálya energiaszintje nagyon eltérő, akkor a hiányos alhéj atompályáit használjuk MOs.
a
HF molekula molekulapálya-diagramja kölcsönhatás lép fel a hidrogénen lévő 1s pálya és a fluorban lévő 2P pálya között, ami szigmakötő és szigmaellenes molekulapálya kialakulását eredményezi, az alábbiak szerint.