Molekuláris szerkezete feltárja, hogy az antibiotikum Streptomycin működik / BNL Newsroom
molekuláris szerkezete feltárja, hogyan működik az antibiotikum Streptomycin
szeptember 5, 2013
Streptomycin volt az első antibiotikum kifejlesztett tuberkulózis kezelésére még egészen a közelmúltig, a tudósok nem teljesen értem, hogyan működik a molekuláris szinten. Tudták, hogy a sztreptomicin blokkolja a kritikus folyamatot, a fehérjék riboszómákkal történő szintézisét, ami bakteriális sejthalálhoz vezet, de az interakció bizonyos részleteit nem fedezték fel. A Brookhaven Nemzeti Laboratórium Nemzeti szinkrotron Fényforrásánál a kutatók röntgenkristályográfiát használtak a kép elkészítéséhez.
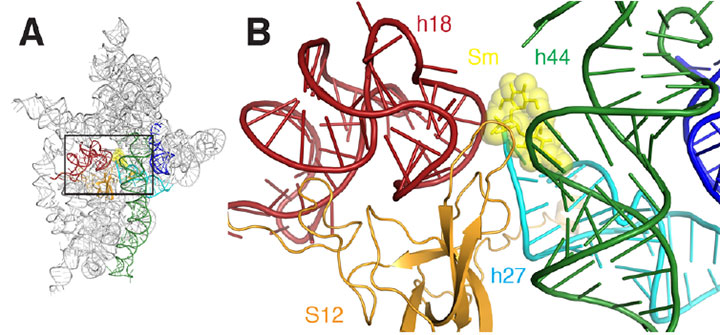
A) a riboszóma sztreptomicin kötőhelyének szalagdiagramja. B) egy közeli kép a téglalap alakú terület vázolt A. Streptomycin képviselteti magát, mint a sárga sHcks és gömbök, hélixek piros színű, sötétzöld, Cián, Narancs, és kék.
a sztreptomicin egy olyan antibiotikum család tagja, amely megszakítja a baktériumsejtek riboszómáinak működését, az összetett molekuláris gépeket, amelyek fehérjéket hoznak létre az aminosavak összekapcsolásával. A riboszómák, amelyek a fehérjék szintézisének gátlásával működő antibiotikumok egyik fő célpontja, két fő részből vagy “alegységből” állnak.”
a nagyobb alegység végzi a fehérjeépítést, amelyet a messenger RNS (mRNS) nevű RNS-típus vezérel, amely kötődik hozzá. A kis alegység “leolvassa” az mRNS-t, és kiválasztja a megfelelő transzfer RNS (tRNS) molekulát, amely kiválasztja és szállítja a következő aminosavat a riboszómához. Itt játszik szerepet a sztreptomicin. A kis alegységhez közel kötődik, ami súlyosan félreérti a szekvenciát. Ez véletlenszerű fehérjék szintézisét eredményezi, amely végül megöli a baktériumokat. De hogy ez a félreolvasás történt, rejtély maradt, amíg a Brown Egyetem kutatói és az Argonne Nemzeti Laboratórium (a Cornell Egyetem) több intézményes Northeastern Collaborative Access csapata nemrégiben végzett tanulmánya nem történt meg.
a sztreptomicin jelenlétében mRNS – hez kötött kis riboszomális alegység kristályának – azonos egységek rendezett szerkezetének-létrehozásával a kutatók több részletes “pillanatfelvételt” készítettek, amelyek feltárták az interakció kulcsfontosságú molekuláris szintű részleteit, végül megmutatva, hogy a sztreptomicin hogyan rontja az alegység működését. Az NSLS beamline X25-nél egy röntgenkristályográfiának nevezett technikát alkalmaztak, amelyben egy röntgensugár a kristályra irányul, kölcsönhatásba lép a molekulákkal, és bonyolult diffrakciós mintázatot eredményez. A mintából számítógépes szoftver segítségével a csoport felépítette az alegység-mRNS-sztreptomicin komplex vizuális ábrázolását.
röviden: A kutatók először “láthatták” azokat a finom módszereket, amelyekkel a sztreptomicin torzítja az alegység dekódolási helyének szerkezetét, ami miatt helytelenül olvassa az mRNS-t. Például a sztreptomicin-kötés csökkenti az alegység molekuláris szerkezetét alkotó sok spirál közül kettő közötti távolságot. Ez azért különösen fontos, mert ezek a hélixek alkotják a tényleges dekódolási helyet, és a dekódolás csak akkor történik meg megfelelően, ha ezek az elemek pontosan az mRNS-hez és a kiválasztott tRNS-hez igazodnak. A sztreptomicin-kötődés megváltoztatja a két hélix és a harmadik hélix közötti kapcsolatot is, aminek következtében az egyik visszahúzódik a másiktól, vagy ” kiold.”
mindezen apró változások végeredménye az, hogy a sztreptomicin destabilizálja az alegység és a “helyes” tRNS közötti kötődést, miközben egyidejűleg stabilizálja az alegység kötődését a “rossz” tRNS-hez, ezáltal hatékonyan megszünteti a helyes és a rossz tRNS közötti megkülönböztetést. Ez pusztítást okoz a baktériumok ellátási láncában az új fehérjék számára, megzavarva a baktériumok szaporodását és életciklusát.
“strukturális vizsgálataink kimutatták, hogy a sztreptomicin meglepően nagy torzulásokat idéz elő a bakteriális riboszómában, ami segít megérteni, hogy ez az antibiotikum hogyan befolyásolja a baktériumok fehérjeszintézisét” – mondta Gerwald Jogl vezető kutató, a Brown molekuláris biológiájának biológiaprofesszora, sejtbiológia & biokémiai osztály. “Folytatva a jelenlegi eredményeinket, most azt vizsgáljuk, hogy a bakteriális riboszómák mutációi hogyan ellensúlyozhatják ezeket a szerkezeti átrendeződéseket, és lehetővé teszik a baktériumok számára, hogy túléljék a sztreptomicin egyébként halálos hatását.”
ezt a kutatást a Nature Communications január 15, 2013 kiadásában tették közzé “a genetikai kód sztreptomicin által kiváltott téves olvasásának strukturális alapja” címmel.”A támogatás a Nemzeti Egészségügyi intézetektől és az Energiaügyi Minisztériumtól érkezett.
2013-4251 / INT / EXT / Newsroom