16.10: Addizione elettrofila: 1,2 – Versus 1,4-Addizione
Le reazioni di addizione di dieni isolati procedono più o meno come previsto dal comportamento degli alcheni semplici. Pertanto, se un equivalente molare di 1,5-esadiene viene trattato con un equivalente di bromo, si ottiene una miscela di 5,6-dibromo-1-esene, 1,2,5,6-tetrabromoesano e diene non reagito, con il composto dibromo che è il prodotto principale (circa il 50%)
fig
Reazioni simili di dieni coniugati, d’altra parte, spesso danno prodotti inaspettati. L’aggiunta di bromo a 1,3-butadiene è un esempio. Come mostrato di seguito, si ottiene una miscela approssimativamente 50:50 di 3,4-dibromo-1-butene (il prodotto atteso) e 1,4-dibromo-2-butene (principalmente l’isomero E). Quest’ultimo composto è notevole in quanto il doppio legame rimanente si trova in una posizione in cui non vi era alcun doppio legame nel reagente. Questo trasferimento interessante richiede una spiegazione.
CH2=CH-CH=CH2 + Br2  |
BrCH2CHBr-CH=CH2 + | BrCH2CH=CHCH2Br |
| 3,4-dibromo-1-butene | 1,4-dibromo-2-butene |
Le attese oltre che di prodotti da reazioni di questo genere è il risultato di 1,2-oltre, cioè il legame con l’adiacente atomi di carbonio del doppio legame. Il prodotto inaspettato proviene dall’aggiunta 1,4, cioè dal legame agli atomi di carbonio terminali di un diene coniugato con uno spostamento del doppio legame rimanente nella posizione 2,3. (Questi numeri si riferiscono ai quattro carboni del diene coniugato e non sono numeri di nomenclatura IUPAC.) Le composizioni del prodotto sono spesso dipendenti dalla temperatura: a 40 oC, l ‘ 85% della miscela di prodotto nella reazione di addizione sopra è il prodotto 1,4, mentre a 0 oC, solo il 30% circa è il prodotto 1,4.
Il legame di un atomo o gruppo elettrofilo con uno degli atomi di carbonio terminali di un diene coniugato (carbonio #1 nella figura seguente) genera un intermedio cationico allilico. Tali cationi sono stabilizzati dalla delocalizzazione della carica, ed è questa delocalizzazione che rappresenta il prodotto 1,4-addition prodotto in tali reazioni di addizione. Come mostrato nel diagramma, la carica positiva è distribuita sui carboni # 2 e # 4, quindi è in questi siti che i legami dei componenti nucleofili. Si noti che la stabilizzazione di risonanza del catione allilico è maggiore della stabilizzazione comparabile di 1,3-butadiene, perché la carica è delocalizzata nel primo, ma creata e separata nel secondo.
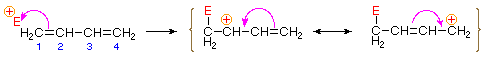
Una spiegazione per l’influenza della temperatura è mostrata nel seguente diagramma di energia per l’aggiunta di HBr a 1,3-butadiene. Il passo iniziale in cui un protone si lega al carbonio #1 è il passo che determina la velocità, come indicato dalla grande energia di attivazione (freccia grigio chiaro). Il secondo passo più veloce è il prodotto che determina passo, e ci sono due percorsi di reazione (colorato blu per 1,2-addizione e magenta per 1,4-addizione). L’aggiunta di 1,2 ha un’energia di attivazione minore rispetto all’aggiunta di 1,4-si verifica più velocemente dell’aggiunta di 1,4, perché il nucleofilo di bromuro è più vicino al carbonio #2 quindi al carbonio #4. Tuttavia, il prodotto 1,4 è più stabile del prodotto 1,2. A basse temperature, i prodotti si formano irreversibilmente e riflettono i tassi relativi delle due reazioni concorrenti. Questo è chiamato controllo cinetico. A temperature più elevate, si stabilisce l’equilibrio tra i prodotti e domina il prodotto 1,4 favorito termodinamicamente.
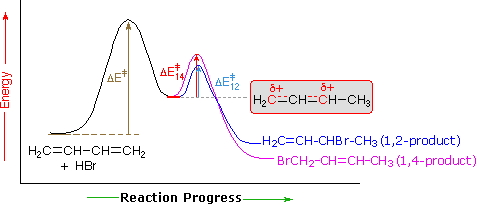
Quando un diene coniugato viene attaccato da un elettrofilo, i prodotti risultanti sono una miscela di isomeri 1,2 e 1,4. Cinetica e termodinamica controllano una reazione quando ci sono due prodotti in condizioni di reazione diverse. Il prodotto cinetico (Prodotto A) si formerà velocemente e il prodotto termodinamico (Prodotto B) si formerà più lentamente. Di solito il primo prodotto formato è il prodotto favorito più stabile, ma in questo caso, il prodotto più lento formato è il prodotto più stabile; Prodotto B.
Introduzione
Come i dieni non coniugati, i dieni coniugati sono soggetti ad attacchi da parte di elettrofili. Infatti, gli elettrofili coniugati sperimentano una reattività cinetica relativamente maggiore quando reagiscono con gli elettrofili rispetto ai dieni non coniugati. Dopo l’aggiunta elettrofila, il diene coniugato forma una miscela di due prodotti—il prodotto cinetico e il prodotto termodinamico—il cui rapporto è determinato dalle condizioni di reazione. Una reazione che produce più prodotto termodinamico è sotto controllo termodinamico, e allo stesso modo, una reazione che produce più prodotto cinetico è sotto controllo cinetico.
Reazione Base
Meccanismo Dettagliato
Conclusione
La reattività dei dieni coniugati (idrocarburi che contengono doppi legami) varia a seconda della posizione dei doppi legami e la temperatura di reazione.Queste reazioni possono produrre sia prodotti termodinamici che cinetici. I doppi legami isolati forniscono dieni con minore stabilità termodinamicamente rispetto ai dieni coniugati. Tuttavia, sono più reattivi cineticamente in presenza di elettrofili e altri reagenti. Questo è il risultato di Markovnikov oltre a uno dei doppi legami. Una carbocation si forma dopo l’apertura di un doppio legame. Questo carbocation ha due strutture di risonanza e l’aggiunta può accadere ad uno dei carboni positivi.
Problemi di pratica
- Scrivi i prodotti dell’aggiunta 1,2 e dell’aggiunta 1,4 di a) HBr e Br. b) DBr a 1,3-ciclo-esadiene. Cosa c’è di insolito nei prodotti di 1,2 – e 1,4 – aggiunta di HX a 1,3-dieni ciclici non sostituiti?
- Il prodotto 1,2-addition si forma più rapidamente a temperature più elevate, anche se è il prodotto 1,4-addition che predomina in queste condizioni?
- Perché il prodotto 1,4-addition è il prodotto termodinamicamente più stabile?
- Dei seguenti cationi radicali quale non è una struttura di risonanza ragionevole?
5. L’aggiunta di 1 equivalente di bromo a 2,4-esadiene a 0 gradi C dà 4,5-dibromo-2-esene più un isomero. Quale dei seguenti è quell’isomero:
- 5,5-dibromo-2-esene
- 2,5-dibromo-3-esene
- 2,2-dibromo-3-esene
- 2,3-dibromo-4-esene
6. Quale dei seguenti sarà il prodotto cineticamente favorito dalla reazione raffigurata?
7. L’aggiunta di HBr a 2,3-dimetil-1,3-cicloesadiene può verificarsi in assenza o presenza di perossidi. In ogni caso si ottengono due prodotti isomerici C8H13Br. Quale dei seguenti è un prodotto comune da entrambe le reazioni?
8. e 9.
8. Il prodotto cineticamente controllato nella reazione di cui sopra è:
- 3-Cloro-1-Butene
- 1-Cloro-2-Butene
9. Per la reazione in questione 8, quale è il risultato di 1,4-addizione?
- 3-Cloro-1-Butene
- 1-Cloro-2-Butene
Risposte ai problemi
1. A) Stesso prodotto per entrambe le modalità di aggiunta.
B) Si formeranno sia isomeri cis che trans.
L’aggiunta dell’HX a cicloalka-1,3-dieni non sostituiti in modo 1,2 o 1,4 dà lo stesso prodotto becasuse di simmetria.
2. Sì. il Prodotto cinetico si formerà ancora più velocemente ma in questo caso ci sarà abbastanza energia per formare il prodotto termodinamico perché il prodotto termodinamico è ancora più stabile.
3. Il prodotto 1,4 è più termodinamicamente stabile perché ci sono due gruppi alchilici su ciascun lato del doppio legame. Questa forma offre stabilità alla struttura complessiva.
4. Tutti questi isomeri sono vitali.
5. D
6. C
7. D
8. A
9. B
Collaboratori
-
William Reusch, Professore emerito (Michigan State U.), Libro di testo virtuale di chimica organica
-
Jim Clark (Chemguide.co.uk)
- Natasha Singh