ATrain Education
Anche se stiamo imparando di più ogni giorno sulla fisiopatologia della malattia di Parkinson, è ancora considerato in gran parte idiopatica (di causa sconosciuta). Probabilmente comporta l’interazione della suscettibilità dell’ospite e dei fattori ambientali. Una piccola percentuale di casi è geneticamente collegata e i fattori genetici vengono intensamente studiati.
Fisiologicamente, i sintomi associati alla malattia di Parkinson sono il risultato della perdita di un certo numero di neurotrasmettitori, in particolare la dopamina. I sintomi peggiorano nel tempo poiché sempre più cellule colpite dalla malattia vengono perse. Il decorso della malattia è molto variabile, con alcuni pazienti che presentano pochissimi sintomi man mano che invecchiano e altri i cui sintomi progrediscono rapidamente.
Il Parkinson è sempre più visto come una malattia neurodegenerativa complessa con una sequenza di progressione. Ci sono forti prove che colpisce prima il nucleo motorio dorsale del nervo vago e i bulbi e il nucleo olfattivo, poi il locus coeruleus e infine la substantia nigra. Le aree corticali del cervello sono interessate in una fase successiva. I danni a questi vari sistemi neuronali rappresentano i cambiamenti patofisiologici sfaccettati che causano menomazioni non solo al sistema motorio ma anche ai sistemi cognitivi e neuropsicologici (Kwan & Whitehill, 2011).
Il ruolo della dopamina
La dopamina, come altri neurotrasmettitori, trasmette messaggi chimici da una cellula nervosa all’altra attraverso la sinapsi, uno spazio tra la cellula presinaptica e il recettore postsinaptico. La dopamina è secreta nella sinapsi dalle vescicole di stoccaggio della membrana nella membrana presinaptica. Attraversa la sinapsi e si lega alla membrana postsinaptica, dove attiva i recettori della dopamina. La dopamina inutilizzata che rimane nella sinapsi viene assorbita nuovamente nella cellula presinaptica; una volta tornata nella cellula presinaptica, la dopamina in eccesso viene riconfezionata in vescicole di stoccaggio e rilasciata nuovamente nella sinapsi.
All’interno della sinapsi, mentre la dopamina viaggia da una cellula all’altra, può essere scomposta e resa inattiva da due enzimi, MAO (monoamino ossidasi) e COMT (catecol-O-metil transferasi). Una strategia terapeutica introduce un inibitore MAO nella sinapsi, che interrompe l’azione dell’enzima MAO e previene la rottura della dopamina. Ciò consente a più dopamina di rimanere nella sinapsi e aumenta la probabilità che si leghi alla membrana postsinaptica.
Trasmissione sinaptica chimica
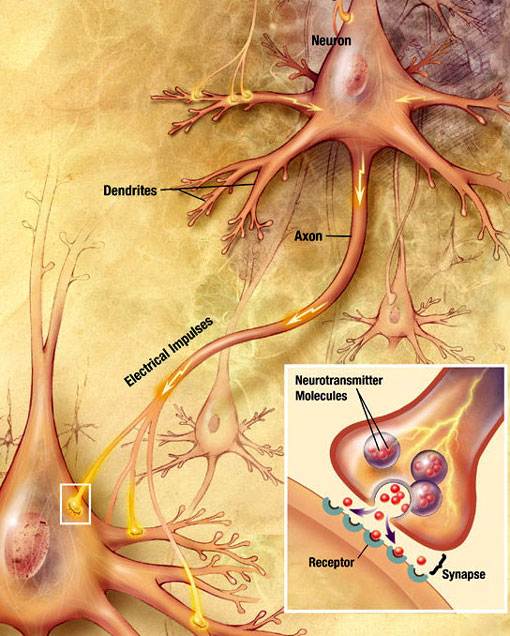
Un’onda elettrochimica chiamata potenziale d’azione viaggia lungo l’assone di un neurone. Quando il potenziale d’azione raggiunge il terminale presinaptico, provoca il rilascio di una piccola quantità di molecole di neurotrasmettitore, che si legano a molecole di recettori chimici situate nella membrana del neurone postsinaptico, sul lato opposto della fessura sinaptica. Fonte: Wikimedia Commons.
Perdita progressiva di dopamina
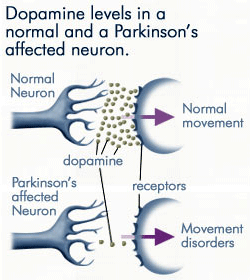
Poiché sempre meno dopamina viene prodotta dai neuroni affetti dalla malattia di Parkinson, è disponibile molta meno dopamina per legarsi ai recettori della dopamina sulla membrana post-sinaptica. Fonte: anti-agingfirewalls.com.
Sebbene la perdita di cellule della dopamina non possa essere misurata direttamente, le misurazioni in persone neurologicamente normali e in primati non umani rivelano una lenta perdita progressiva di dopamina con l’età. Nella malattia di Parkinson la perdita si verifica ad un tasso molto maggiore e sia le misure biochimiche che gli studi di imaging suggeriscono che vi è una significativa diminuzione della dopamina nel momento in cui compaiono i sintomi motori. In questa visione, la malattia di Parkinson è una versione accelerata della morte cellulare osservata con l’invecchiamento normale (Cookson, 2009). Questo è illustrato nel grafico sottostante, che mostra il declino dei neuroni dopaminergici durante il normale invecchiamento, nella PD idiopatica, nella PD causata da fattori ambientali o genetici e nella PD ad esordio precoce.
l’Evoluzione del Deplezione di Dopamina nella Malattia di Parkinson
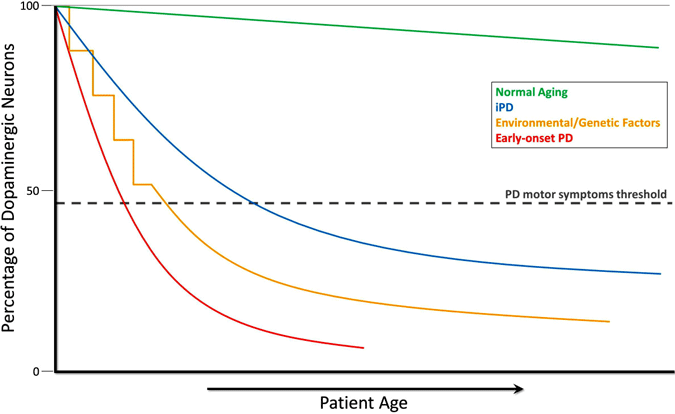
Durante il corso di invecchiamento normale (linea verde), piccolo ma lenta degenerazione dopaminergica si verifica senza sintomi motori. La PD idiopatica (IPD, linea blu) è di origine sconosciuta ma si pensa che si sviluppi gradualmente, con una lenta degenerazione dei neuroni dopaminergici che porta ai classici sintomi motori PD più tardi nella vita. Un altro modello di neurodegenerazione della dopamina che porta a sintomi motori PD comporta l’esposizione ripetuta a sostanze tossiche ambientali nel tempo in combinazione con una predisposizione genetica alla perdita di neuroni dopaminergici (linea gialla). La PD ad esordio precoce (linea rossa), causata da mutazioni nel gene PARKIN, comporta un precipitoso declino dei neuroni dopaminergici e i sintomi motori della PD possono presentare decenni prima di quelli della PD idiopatica. Un altro scenario (non mostrato) dello sviluppo dei sintomi motori del PD coinvolge possibili tossici ambientali in utero o fattori genetici che portano a un numero atipicamente basso di neuroni dopaminergici alla nascita e ad una maggiore suscettibilità allo sviluppo del PD (Haas et al., 2012).
La degenerazione dei neuroni della dopamina è particolarmente evidente in una parte della substantia nigra chiamata pars compacta. Significativamente, la perdita di dopamina nella pars compacta aumenta l’unità eccitatoria complessiva nei gangli della base, * interrompendo il controllo motorio volontario e causando i sintomi caratteristici della PD. La normalizzazione della funzione motoria è vista inizialmente con il trattamento con levodopa (Gasparini et al., 2013).
* I componenti principali dei gangli basali sono lo striato (nucleo caudato e putamen), il globus pallidus, la substantia nigra, il nucleo accumbens e il nucleo subtalamico.
Con l’aumentare della gravità della PD, l’esaurimento della dopamina porta a ulteriori cambiamenti nelle vie dei gangli della base, inclusa la funzione alterata di altri neurotrasmettitori dei gangli della base come glutammato, GABA e serotonina (Gasparini et al., 2013). Sebbene vi sia una relativa vulnerabilità dei neuroni produttori di dopamina nella substantia nigra, non tutte le cellule della dopamina sono colpite nella malattia di Parkinson; in alcune parti del cervello i neuroni produttori di dopamina sono relativamente risparmiati (Cookson, 2009).
La via nigrostriatale
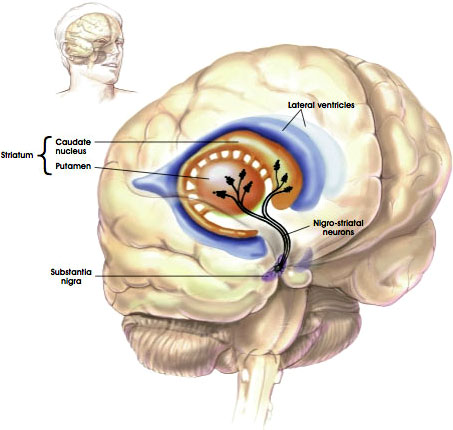
Fonte: NIH, n. d.
Corpi di Lewy e Alfa-sinucleina
Corpi di Lewy sono aggregati anormali e inclusioni di proteine che si sviluppano all’interno delle cellule nervose nelle persone con malattia di Parkinson. Le aggregazioni consistono solitamente degli aggregati fibrillari insolubili che contengono le proteine misfolded. Un gran numero di molecole sono state identificate nei corpi di Lewy, ma una proteina chiamata alfa-sinucleina è il componente principale.
Corpi di Lewy (inclusioni di alfa-sinucleina)
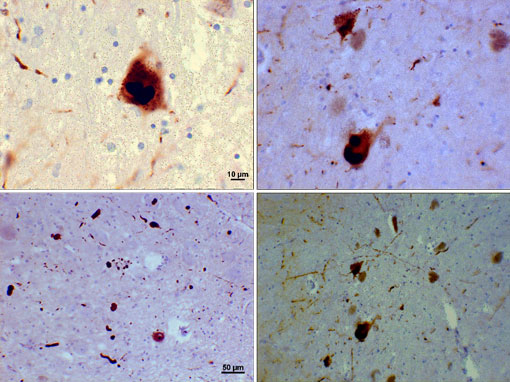
Fotomicrografo di regioni di substantia nigra in un paziente di Parkinson che mostra corpi di Lewy e neuriti di Lewy in vari ingrandimenti. I pannelli superiori mostrano un ingrandimento 60x delle inclusioni intraneuronali alfa-sinucleina aggregate per formare corpi di Lewy. I pannelli inferiori sono immagini di ingrandimento 20× che mostrano neuriti Lewy simili a fili e corpi Lewy arrotondati di varie dimensioni. Immagini per gentile concessione di Suraj Rajan.
La patologia di Lewy comprende molte regioni del cervello e alcuni rapporti hanno suggerito che la substantia nigra non è il primo luogo in cui i corpi di Lewy si formano nella malattia di Parkinson. Inclusioni e aggregati probabilmente simboleggiano la fase finale di una cascata di eventi complicati. Una fase precedente può essere più direttamente legata alla patogenesi del disturbo rispetto alle inclusioni stesse, che possono o non possono rappresentare segni distintivi diagnostici.
I corpi di Lewy sono anche visti in “demenza con corpi di Lewy”, suggerendo che queste condizioni sono correlate l’una all’altra da patologia condivisa e possibilmente da eziologia condivisa. Né la perdita cellulare né la formazione di corpi di Lewy sono assolutamente specifici per la PD, ma entrambi sono necessari per una diagnosi di PD secondo le definizioni attuali (Cookson, 2009).
I disturbi neurodegenerativi come il morbo di Alzheimer, la degenerazione frontale-temporale, la malattia da prioni, la corea di Huntington e le malattie del motoneurone si stanno sempre più realizzando per avere meccanismi cellulari e molecolari comuni, tra cui l’aggregazione proteica e la formazione del corpo di inclusione in alcune aree del sistema nervoso (Jellinger, 2011).
Infiammazione e risposta immunitaria
L’innesco della degenerazione dopaminergica sembra essere multifattoriale—influenzato da elementi sia endogeni che ambientali. L’infiammazione e le risposte immunitarie sono sempre più considerate come importanti mediatori della degenerazione dopaminergica. Ampi studi sulla popolazione hanno suggerito che gli individui che assumono farmaci antinfiammatori non steroidei (FANS) hanno meno rischio di sviluppare PD idiopatico, il che suggerisce che i farmaci antinfiammatori possono essere un promettente trattamento che modifica la malattia per i pazienti parkinsoniani (Barcia, 2013).
Nuove fasi di sperimentazione hanno coinvolto trattamenti anti-infiammatori—in particolare alla ricerca di un biomarcatore oggettivo in trattamenti volti a ridurre i cambiamenti infiammatori nei pazienti con PD. I ricercatori stanno utilizzando strumenti di neuroimaging per sviluppare un biomarcatore rilevante con l’intenzione di testare questo in grandi studi di imaging clinico. L’esito di questi studi fornirà dati per testare e monitorare la progressione dei trattamenti anti-infiammatori per la PD e aiuterà a identificare la finestra terapeutica tempestiva per fermare, o almeno rallentare, la degenerazione dopaminergica mediata dall’infiammazione (Barcia, 2013).
Parkinsonismo
Il parkinsonismo, noto anche come “Parkinson atipico”, “Parkinson secondario” o “sindrome di Parkinson”, è una sindrome neurologica in cui un paziente presenta alcuni dei sintomi associati alla malattia di Parkinson—tremore, rigidità, bradicinesia e instabilità posturale. Ma il parkinsonismo non è la malattia di Parkinson. Il parkinsonismo non è pensato per essere causato dalla malattia del Parkinson ed i pazienti rispondono tipicamente male ad intervento farmacologico. Il parkinsonismo ha spesso una causa identificabile, come l’esposizione a tossine, metanfetamina, traumi, ictus multipli, altri disturbi del sistema nervoso o malattie. Generalmente, i corpi di Lewy non sono visti nel parkinsonismo.
Il termine parkinsonismo è anche associato a disturbi come paralisi sopranucleare progressiva, atrofia del sistema multiplo, demenza del corpo di Lewy, degenerazione corticobasale, parkinsonismo vascolare, parkinsonismo indotto da farmaci e parkinsonismo secondario all’infezione e ad altre cause (Hohler et al., 2012). Una forma di parkinsonismo reversibile può verificarsi dall’uso di alcuni farmaci neurolettici, in particolare reserpina, antipsicotici (aloperidolo) e metoclopramide. L’esposizione a determinate tossine, grave avvelenamento da monossido di carbonio e avvelenamento da mercurio può anche portare al parkinsonismo.
La comparsa nei primi anni 1980 dei sintomi del parkinsonismo in un gruppo di tossicodipendenti che avevano consumato un lotto contaminato di un oppiaceo sintetico ha portato alla scoperta del MPTP chimico come agente che causa la sindrome del parkinsonismo nei primati non umani e negli esseri umani. MPTP può essere prodotto quando si effettua una forma di eroina (MPTP viene convertito in una neurotossina che distrugge selettivamente le cellule della dopamina nella substantia nigra). Questi casi sono rari e hanno colpito soprattutto i consumatori di droga a lungo termine.
L’abuso di metanfetamine è stato anche collegato al parkinsonismo. Negli animali da esperimento, l’esposizione alla metanfetamina danneggia le fibre dopaminergiche nello striato* così come i corpi cellulari nella substantia nigra, facendo eco alla degenerazione osservata nei pazienti umani con PD. Il danno selettivo ai terminali dopaminergici nello striato è stato osservato anche negli utenti umani di metamfetamina, sebbene non vi siano prove finora che l’abuso di metamfetamina danneggi i corpi delle cellule dopaminergiche nella substantia nigra (Granado et al., 2013).
* Il nucleo più grande dei gangli della base, lo striato è costituito dal nucleo caudato e dal putamen.
È stato ipotizzato che l’uso di metanfetamina possa predisporre gli utenti allo sviluppo futuro della PD. Questa ipotesi è stata supportata da recenti lavori epidemiologici che indicano che gli utenti di metanfetamine hanno un aumentato rischio di sviluppare PD. Ciò è coerente con gli effetti neurotossici persistenti della metanfetamina negli animali da esperimento (Granado et al., 2013).
I pazienti con parkinsonismo sono spesso difficili da gestire come pazienti ambulatoriali. La complessità dei loro sintomi, i deficit cognitivi e autonomici aggiunti, la scarsa risposta alla maggior parte dei farmaci PD e il declino relativamente rapido dello stato contribuiscono alle sfide nella gestione di questi pazienti, in particolare con il progredire della malattia (Hohler et al., 2012).