Bioorganic & Organic Chemistry
Hydroboration–oxidation reaction
L’aggiunta di cis di diborane ad un legame alchenico fornisce un metodo estremamente utile di idratazione. Il diborano può essere generato dall’aggiunta di boroidruro di sodio all’eterato di trifluoruro di boro in tetraidrofurano o etere a 0o-5oC. Il diborano è il dimero del borano (BH3) ed è la forma stabile di questo reagente (Scheme1).
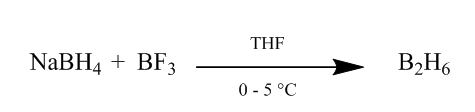
Figura 1 Obtention di Diborane da boroidruro di sodio
L’aggiunta di diborano all’alchene è estremamente rapida e generalmente, il reagente si aggiunge dal meno ostacolato delle due facce del sistema π. L’aggiunta cis è stata razionalizzata da uno stato di transizione a quattro centri. Il complesso borano risultante dall’aggiunta di diborano ad un alchene viene convertito, con ritenzione di stereochimica, in un alcool mediante trattamento con perossido di idrogeno basico. Così 1-metilcicloesene 1 su idroborazione-ossidazione porta alla formazione di trans-2-metilciclo-esanolo 2. Il percorso meccanicistico è stato descritto in (Schema 2). Il metodo per la conversione dell’alchene in alcol mediante idroborazione-ossidazione è stato applicato per la sintesi di molti prodotti naturali. Alcuni esempi sono illustrati di seguito.

Figura 2 meccanismo di Reazione per la formazione di trans-2-methylcyclohexanol 2
Sintesi di (±) junenol e (±) acalomone
L’uso di hydroboration-reazione di ossidazione è stato osservato da Banerjee e colleghi durante il synthesis3 di eudesmone sesquiterpeni (±) junenol e (±) acalomone. Al fine di ottenere la sintesi di questi sesquiterpeni l’alchene 3, è stato selezionato come materiale di partenza e sottoposto a idroborazione-ossidazione per produrre l’alcol 4 (Schema 3). Il chetone 5, ottenuto dall’ossidazione dell’alcool con il reagente di Jones 4 è stato fatto reagire con il carbonato dietilico. Il prodotto risultante è stato trattato con litio metilico per ottenere il ketol 6 la cui conversione all’isopropilchetone 7 è stata effettuata rispettivamente mediante disidratazione e idrogenazione. La riduzione dell’idruro metallico del chetone seguita dall’ossidazione con tetraacetato5 di piombo nel cicloesano ha permesso l’etere ciclico 8, che è stato convertito in chetoacido 9 mediante ossidazione con acido cromico e acido acetico. Decarbossilazione con tetraacetato di piombo in benzene e piridina seguita da purificazione oltre il 10% di gel di silice impregnato di AgNO3 offerto ( ± ) acolamone 10. La riduzione di acolamone 10 con boroidruro di sodio in metanolo, seguita dalla sublimazione del prodotto risultante ha prodotto junenol 11.
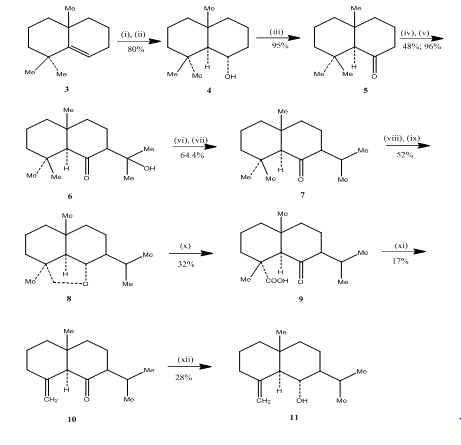
Figura 3 Sintesi dei eudesmone sesquiterpeni (±) junenol e (±)-acalomone
Reagenti: (i) BF3.Et2O, NaBH4, THF, 0-5°C; (ii) di idrossido di sodio (10%), H2O2(30%); (iii) CrO3/HMPT; (iv) NaH, CO(OEt)2, DME; (v) MeLi, Et2O, reflusso, 2h; (vi) HCl(conc), MeOH; (vii) H2, PtO2, MeOH; (viii) Na, EtOH, reflusso; (ix)Pb(OAc) 4, C6H12; (x) CrO3, AcOH; (xi)Pb(OAc) 4, C6H6, Py, reflusso; (xii) NaBH4, EtOH.
Sintesi di acido pisiferico
L’uso di idroborazione-ossidazione è stato registrato durante la sintesi di acido pisiferico, 6 un diterpene triciclico che mostra attività antibatteriche contro tutti i batteri gram-positivi testati.7 Il percorso sintetico è stato descritto nello schema 4. Idroborazione-ossidazione dell’alchene 13, preparato dal noto8 ketoalcohol 12, è stato ossidato con il reagente di jones 4 e ridotto rispettivamente con idruro metallico per dare alcol 14. Ossidazione con tetraacetato di piombo in benzene con lampada al tungsteno 250W ha dato l’etere ciclico 15. La scissione dell’etere ciclico con zinco, ioduro di zinco e acido acetico8 fornito pisiferolo 16. La trasformazione del pisiferolo all’estere 17 è stata raggiunta in sei fasi:
- Metilazione con dimetil solfato
- Ossidazione con jones reagente
- Esterificazione con diazometano
- Riduzione con sodio boroidruro
- Tosylation
- Detosylation
L’estere l7 è stato convertito in pisiferic acido 18 da riscaldamento con bromuro di alluminio ed etano tiolo.
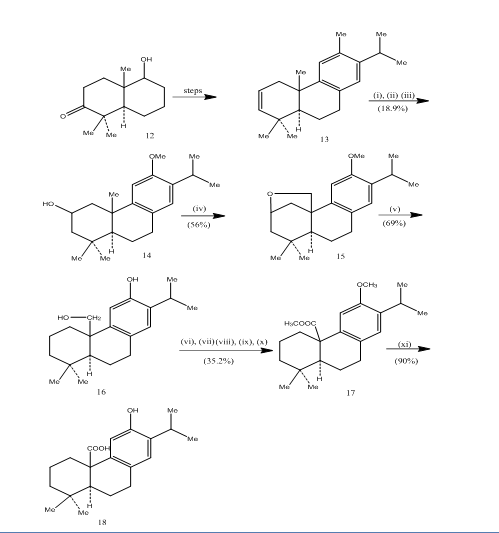
Figura 4 Sintesi di acido pisiferico 18
Reagenti: (i) BF3.Et2O, NaBH4; (ii) NaOH (10%), H2O2 (30%), H2SO4-HCO4; (iii) LiAlH4, THF; (iv) Pb (OAc)4, CaCO3, C6H6, 250 w lampada al tungsteno; (v) Zn, ZnI, MeCOOH; vi) MeSO4, Me2CO; vii) H2SO4-HCrO4; viii) CH2N2, Et2O; ix) NaBH4, MeOH; x) TsCl, Py; xi) NaI, Zn dust, DMF; xii)AlBr3, (CH2SH) 2.
La reazione di idroborazione-ossidazione è stata applicata per la sintesi di ( ± ) eudes-4(14),7(11)-diene-8-one,9 taxodione,10 alcoli norditerpenici11 e molti altri terpeni.12 Questi esempi indicano chiaramente l’uso dell’eterato tifluoruro di boro nella conversione degli alcheni in alcoli e successivamente nelle loro trasformazioni nei composti terpenoidi.
Scissione di epossidi
Gli epossidi possono essere scissi da diversi reagenti. L’eterato di borontrifluoruro di acido di Lewis è stato utilizzato anche per la scissione degli epossidi e in molti casi il prodotto risultante si riorganizza in chetone. La scissione degli epossidi è anche accompagnata dalla ciclizzazione. In questa recensione sono state discusse la scissione di alcuni epossidi con eterato di trifluoruro di boro e l’uso dei prodotti risultanti nella sintesi di prodotti naturali.
Sintesi del 6-metossi-2-tetralone
La scissione dell’epossido con l’eterato di trifluoruro di boro è stata utilizzata13 per la sintesi del 6-metossi-2-tetralone 20 (Schema 5), un importante materiale di partenza selezionato per la sintesi di molti composti organici. L’epossidazione dell’alchene13 19 seguita dal trattamento del prodotto grezzo in diclorometano con eterato di trifluoruro di boro ha consentito al tetralone 20 una resa del 36%. Quando la scissione è stata provata con acido solforico la resa del teralone 20 è stata migliorata (39%) insieme alla formazione di altri prodotti secondari e quindi la purificazione cromatografica è stata molto laboriosa.
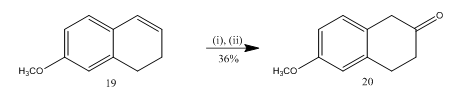
Figura 5 Sintesi di 6-metossi-2-tetralone 20
Reagenti: (i) MCPBA, CH2Cl2; (ii) BF3OEt2
Sintesi di cuprane
Il riarrangiamento di epossidi da etherate di trifluoruro di boro si è dimostrato molto utile durante il synthesis14 di sesquiterpene cuprane. Il percorso sintetico è descritto nello schema 6. il 6,6-dimetil-1-p-tolilcicloesene 21 su epossidazione ha permesso all’epossido 22 di ottenere una buona resa, che al trattamento con trifluoruro di boro eterato in benzene ha prodotto l’aldeide 23 a bassa resa. Il semicarbazone dell’aldeide è stato riscaldato con idrossido di potassio per fornire il sesquiterpene cuprane 24 in resa accettabile. La sintesi è attraente per la sua brevità nei passaggi. Le condizioni utilizzate per il riarrangiamento dell’epossido 22 sono critiche perché ha la tendenza a subire un ulteriore riarrangiamento al chetone 25.
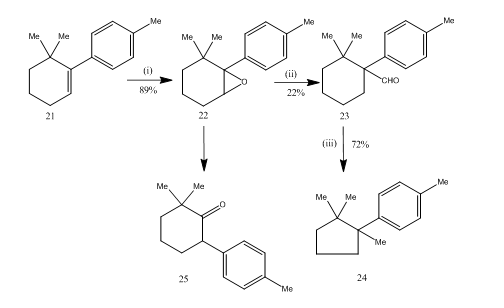
Figura 6 Sintesi di cuprane
Reagenti: (i) PhCO3H, CHCl3; (ii) C6H6, BF3Et2O; (iii) NH2NHCONH2, KOH
Sintesi di (±) karahana etere
etherate di trifluoruro di Boro è stato utilizzato anche per la scissione di epossido durante il synthesis15 di karahana etere, un volatile monoterpene che era isolated16 dal Giapponese luppolo. Il percorso sintetico è descritto nello schema 7. L’epossido 27, ottenuto dal diene 26, dopo essere stato trattato con eterato di trifluoruro di boro ha subito una ciclizzazione producendo il prodotto 28. La ciclizzazione probabilmente è avvenuta attraverso l’intermedio 27 (i). La riduzione dell’idruro metallico ha permesso il diolo che sulla tosilazione ha prodotto karahanaether 29. La resa non è specificata. La scissione degli epossidi è stata utilizzata per la sintesi di molti terpeni come rosenolattone,17 cyperolone,18 maritimol.19
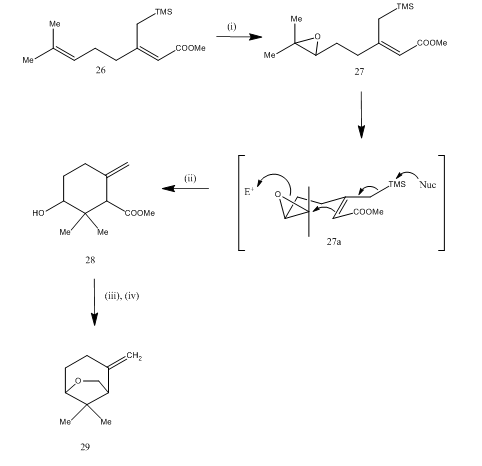
Figura 7 Sintesi di (±) Karahana etere
Reagenti: (i) MCPBA; (ii) BF3Et2O; (iii) LiAlH4; (iv) TsCl, Py
Esterificazione
Esterificazione è un usato di frequente reazione per la sintesi di numerosi composti organici. L’eterato di trifluoruro di boro è un reagente molto conveniente per l’esterificazione di molti acidi benzoici p-amminici, acidi aromatici, eterociclici e insaturi.20 In alcune reazioni di esterificazione l’uso di questo reagente ha fornito una resa superiore rispetto ad altri reagenti. Alcuni esempi sono riportati nello schema 8. Gli acidi 30-32 sono stati convertiti negli esteri 33-35 rispettivamente in alta resa su trattamento con il reagente dell’eterato-alcool del trifluoruro del boro. Marshall e collaboratori21 hanno utilizzato lo stesso reagente per l’esterificazione degli acidi carbossilici. Dymicky22 preparato diversi formati ad alta resa da acido formico e alcool in presenza di una quantità catalitica di complesso trifluoruro di boro-metanolo. Gli altri catalizzatori, ad esempio acido solforico, acido p-toluene solfonico, non erano così efficienti come il complesso trifluoruro di boro-metanolo.
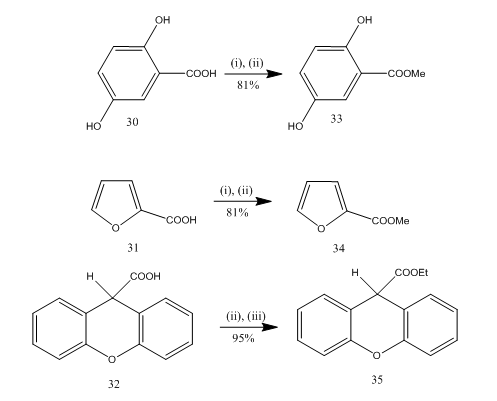
Figura 8 Esterificazione degli acidi 32-35
Reagenti: i) MeOH; ii) BF3. Et2O; (iii) EtOH
Jackson e collaborators23 hanno sviluppato un metodo efficiente per la conversione di alcoli 37-39 e acidi 40-42 direttamente al corrispondente t-butil derivati in buona resa utilizzando il t-butil trichloroacetimidate 36 in presenza di una quantità catalitica di etherate di trifluoruro di boro come esposto nello Schema 9. Questo metodo funziona meglio con i gruppi sensibili agli acidi rispetto ai metodi tradizionali che utilizzano isobutene. Il gruppo idrossile meno ostacolato di un diolo può essere protetto ed è anche suscettibile di lavori su piccola scala (evitando la consegna di isobutene gassoso). Il t-butil 2,2,2-tricloroacetimidato 36 è facilmente preparato mediante l’aggiunta di t-butanolo a tricloroacetonitrile. La maggior parte degli esperimenti sono stati condotti in presenza di una miscela di diclorometano e cicloesano. L’anidride acetica in presenza di eterato di trifluoruro di boro è stata utilizzata per l’acetilazione del gruppo idrossilico.24

Figura 9 Conversione di alcoli e acidi da derivati t-butilici.
Reagenti: 36, i) BF3.Et2O, ii) CH2Cl2, C6H12
Ciclizzazione
L’eterato di trifluoruro di boro ha svolto un ruolo importante nella ciclizzazione di molti acidi carbossilici, alleni ecc. I seguenti esempi illustreranno il ruolo dell’eterato di trifluoruro di boro come agente ciclizzante. Il cloruro acido 49 e l’alchene 50 sono stati condensati per produrre il chetone divinil25 51 che è stato sottoposto alla ciclizzazione nazarov26, 27 fornendo il chetone ciclico 52 che è stato convertito nel sesquiterpene tricodiene 53 (Schema 10).
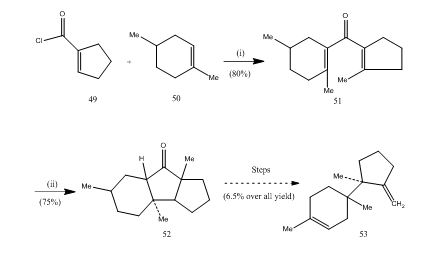
Figura 10 Sintesi di sesquiterpene tricodiene 53
Reagenti: (i) SnCl4, NaOMe; (ii) BF3Et2O
Diversi allenil aril chetoni subiscono ciclizzazione con trifluoruro di boro eterato offrendo metilene benzociclopentenone attraverso una nuova ciclizzazione 5-end-mode.28 I chetoni 54-56 offrivano rispettivamente benzociclopentenoni 57-59 (Schema 11). Probabilmente la trasformazione si è verificata come mostrato nella ciclizzazione di allenil aril chetone 54 in 57. Si può osservare che la presenza di gruppi sostituenti nell’anello aromatico determina la resa del prodotto ciclizzato. Kos e Loewenthal28 hanno riportato la ciclizzazione dell’acido 60 con trifluoruro di boro eterato al chetone 61 che è stato convertito gibberone 62 (Schema 12) in tre fasi:
- Chetalizzazione
- Riduzione di Huang-Minlon e
- Idrolisi acida. I sopra citati esempi mostrano l’uso di etherate di trifluoruro di boro nella ciclizzazione di composti organici
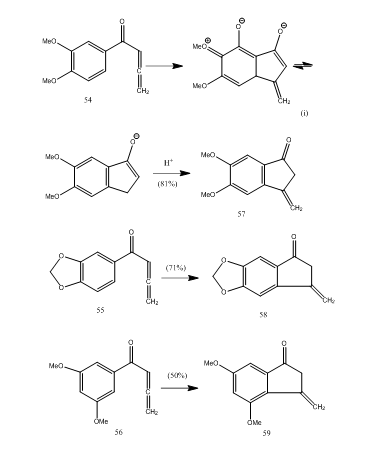
Figura 11 Sintesi di Cyclopentenones

Figura 12 Sintesi di gibberone
Reagenti: (i) BF3.Et2O; (ii) (a) C2H6O2; (b) DEG, N2H4, KOH, 190-200°C; (c) H+