Cromato di potassio
Cromato di potassio Proprietà chimiche, usi, produzione
Composto inorganico
Il cromato di potassio, comunemente noto come tarapacaite, è un composto inorganico, che è giallo ortorombico o cristallo esagonale a temperatura ambiente. La densità relativa è 2,732 ed il punto di fusione è 968 °C. È tossico e può disolve in acqua per formare la soluzione alcalina di idrolisi dello chrom del cromato. Ed è insolubile in alcool ed etere. Dopo l’acido aggiunto, la soluzione gialla del cromato di potassio diventerà arancione, che è il colore del dicromato. C’è un equilibrio tra la conversione di cromato e bicromato nella soluzione: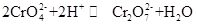
Quando l’acido viene aggiunto il potassio cromato soluzione, l’equilibrio si sposterà verso la direzione di generazione di bicromato di potassio, e quando alcali viene aggiunto alla soluzione di bicromato di potassio, l’equilibrio si sposterà nella direzione di generare potassio cromato. Il cromato di potassio ha proprietà ossidative e può reagire con l’agente riducente in mezzo alcalino per formare Cr(OH)4-(vale a dire CrO2-). L’aggiunta di diverse soluzioni contenenti rispettivamente ioni di bario, ioni di piombo e ioni d’argento alla soluzione di cromato di potassio formerà il corrispondente cromato insolubile: cromato di bario BaCrO4 (giallo), cromato di piombo pbCrO4 (giallo), cromato d’argento Ag2CrO4(rosso mattone). E la presenza di ioni cromati può essere dimostrata dal colore caratteristico di questi cromati insolubili. Il cromato di potassio può essere utilizzato come reagente analitico, ossidante, mordente, antiruggine metallico e utilizzato per l’analisi delle tracce di bario e argento. Può anche essere usato come materie prime dell’industria conciaria e della medicina e di altri composti di cromo. La polvere di cromite Fe (CrO2) 2 può essere utilizzata come materia prima e calcinata con idrossido di potassio, calcare (dolomite) nell’aria e quindi estratta con soluzione di solfato di potassio per ottenere il cromato di potassio.
Le informazioni di cui sopra è a cura di Xiao Nan di Chemicalbook.
Metodo dell’indicatore del cromato di potassio
Il metodo dell’indicatore del cromato di potassio, noto anche come Moore (Mohr), è un metodo di titolazione della precipitazione (metodo dell’argento) che utilizza il cromato di potassio (K2CrO4) come indicatore e il nitrato d’argento (AgNO3) come soluzione standard. Questo metodo viene utilizzato principalmente per la determinazione dello chlorine cloro (Cl-) o dello brom bromuro (Br-). Aggiungere una piccola quantità di K2CrO4 come indicatore prima di dichiarare la determinazione, quindi titolare con la soluzione standard AgNO3. Dopo l’inizio della titolazione, il precipitato di bianco (cloruro d’argento) o giallo pallido (bromuro d’argento) precipita per primo. Quando Cl-o Br-precipita quantitativamente, una piccola soluzione di nitrato d’argento in eccesso causerà la concentrazione di Ag+ improvvisamente aumentando per generare immediatamente brick red silver chromate (Ag2CrO4) precipitazione, indicando l’endpoint di titolazione. La quantità di indicatore e l’acidità della soluzione sono due problemi principali di questo metodo di titolazione. Se il K2CrO4 concentrazione è troppo alta, il colore della titolazione della soluzione sarà troppo profonda per ostacolare l’osservazione di Ag2CrO4 precipitazione colore alla fine; se il K2CrO4 concentrazione è troppo bassa, troppo notevole quantità di soluzione di nitrato d’argento saranno necessarie dopo il quantitativo di precipitazione di alogenuro di argento per generare cromato d’argento di precipitazione per indicare il punto di fine titolazione, che è il risultato della titolazione di errore in aumento. Quando la soluzione 0.1 mol/l AgNO3 viene utilizzata per titolare lo 0.1mol / l alogenuri, se la concentrazione di K2CrO4 è 5× 10-3mol/l, il punto finale errore è solo +0.06%, che può essere pensato che la precisione del risultato dell’analisi non è influenzato. Il metodo dell’indicatore K2CrO4 non può essere effettuato in soluzione acida o alcalina, perché K2CrO4 sarà convertito in dicromato di potassio (K2Cr2O7) ad un piccolo valore di pH e Ag+ precipiterà sotto forma di ossido d’argento (Ag2O) quando il pH è troppo alto. Comunemente, l’intervallo di acidità adatto è pH = 6,5~ 10,5, ma quando ci sono sali di ammonio in soluzione, l’acidità della soluzione pH = 6,5~7,2 è appropriata.
Il metodo dell’indicatore del cromato di potassio può essere utilizzato solo per la titolazione diretta degli ioni Cl o Br e il risultato della titolazione è il loro totale quando coesistono. Questo metodo non è adatto per la determinazione dello ion ioduro (I-) o dello ion tiocianato (SCN-), perché sono troppo facilmente assorbiti dalla sedimentazione e il punto finale non è chiaro. Questo metodo inoltre non è adatto a titolazione Ag + con Cl -, ma Ag + può essere determinato facendo uso della titolazione posteriore, vale a dire aggiunge una quantità eccessiva di soluzione standard di NaCl nella soluzione della prova e poi usa la soluzione standard AgNO3 per titolare gli Cl-ioni in eccesso. Nella soluzione, tutti i cationi che possono formare precipitati con CrO2-4 o gli anioni che possono precipitare con Ag+ interferiranno con la determinazione. Il metodo dell’indicatore del cromato di potassio pricipalmente è utilizzato per la determinazione degli Cl-ioni in soluzione molto diluita, quale la determinazione di Cl-in acqua potabile ed impurità dei prodotti industriali.
Dicromato di potassio
Il dicromato di potassio, noto anche come potassio di allume rosso, è cristallo triclinico rosso arancio o cristallo aghiforme. La densità è 2,676 g / cm3. La temperatura di fusione è 398 °C. È solubile in acqua e insolubile in etanolo. Ha una forte proprietà ossidante e si decompone a 1300 °C.
In produzione, il dicromato di potassio viene sempre utilizzato per introdurre il cromo per colorare lo smalto durante la fusione. È l’agente colorante della glassa gialla del latte di titanio colorato e della glassa gialla di titanio ed il dosaggio usato è generalmente 0.06% ~ 0.12%. Il dicromato di potassio e l’ossido di rame possono anche essere miscelati per ottenere smalto verde, verde bambù, verde frutta e altri colori. Tuttavia, questi smalti colorati sono generalmente meno lucidi a causa dell’influenza del cromato.
Lo smalto di colore ottenuto dall’ossido di cromo o dal bicromato di potassio (sodio) è spesso giallo-verde a causa del cambiamento di valenza degli ioni cromo nel processo di fusione. Il dicromato di potassio è anche comunemente usato per produrre vari pigmenti verdi e pigmenti rosa.
Il dicromato di potassio deve soddisfare gli obiettivi richiesti: contenuto di dicromato di potassio ≥ 99%, contenuto di cloruro (Cl) ≤ 0,08%, insolubile in acqua ≤ 0,05%.
Le informazioni di cui sopra sono compilate da Yaoyao di Chemicalbook.
Solubilità in acqua (g / 100ml)
Grammi disciolti per 100 ml di acqua a diverse temperature (°C):
60 g/10 °C; 63.7 g/20 °C; il 66,7 g/30 °C; 67.8 g/40 °C
70.1 g/60 °C; 74.5 g/90 °C
Tossicità
Vedere sodio cromato
proprietà Chimiche
giallo Limone ortorombico cristallina, Solubile in acqua, insolubile in alcool
Applicazione
Utilizzato come reagente analitico, ossidante, mordente e metallo antiruggine;utilizzati per la fabbricazione di cromo,utilizzato come ossidante e fissante di stampa e di tintura. Utilizzato per inchiostro, vernice, smalto, corrosione del metallo e così via,utilizzato principalmente nella produzione di reagenti chimici e pigmenti.
Preparazione
Metodo di neutralizzazione: Sciogliere il dicromato di potassio nel liquore madre e nell’acqua, quindi aggiungere la miscela al reattore. Successivamente aggiungere idrossido di potassio sotto agitazione per effettuare la reazione di neutralizzazione. Il cromato di potassio prodotto è debolmente alcalino e quindi evaporato per la concentrazione, raffreddato per la cristallizzazione, separato ed essiccato per ottenere i prodotti finiti del cromato di potassio.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Il liquore madre separato verrà restituito alla fase di dissoluzione per sciogliere il bicromato di potassio.
Proprietà chimiche
cristalli giallo limone
Proprietà chimiche
Il cromato di potassio(VI) è un solido cristallino giallo.
Usi
Il cromato di potassio (K2CrO4) è solubile in acqua e viene utilizzato per produrre inchiostri gialli brillanti e pigmenti di vernice. Viene anche usato come reagente nei laboratori chimici e come mordente per”fissare” i coloranti nei tessuti colorati.
Usi
È usato come agente ossidante.
Usi
Ha una limitata applicazione in smalti, finitura cuoio, antiruggine dei metalli, essendo sostituito dal sale di sodio; come reagente in chimica analitica.
Definizione
ChEBI: Un sale di potassio costituito da ioni potassio e cromato in un rapporto 2:1.
Definizione
Un sale contenente lo ionCrO42 -.
Definizione
cromato di potassio: un solido giallo cristallino brillante, K2CrO4, solubilein acqua e insolubile in alcool; rombico; r. d. 2.73; m. p. 968.3°C; si decompone senza bollire. Viene prodotto industrialmente arrostendo minerale di cromite in polvere con idrossido di potassio e calcare e lisciviando la cenere risultante con soluzione di solfato di potassio caldo. Potassiumchromate è usato in pellefinitura, come mordente tessile, e inenamels e pigmenti. Nel laboratorioè usato come analiticoagente e come indicatore. Come altri composti di cromo(III) è tossico se ingerito o inalato.
Descrizione generale
Il cromato di potassio è un solido cristallino giallo. Il cromato di potassio è solubile in acqua. Il pericolo principale è la minaccia per l’ambiente. Dovrebbero essere prese misure immediate per limitare la sua diffusione nell’ambiente. Il cromato di potassio viene utilizzato nell’analisi chimica, nella produzione di pigmenti per vernici e inchiostri, come fungicida e per produrre altri composti di cromo.
Aria& Reazioni dell’acqua
Solubile in acqua.
Profilo di reattività
Gli agenti ossidanti , come il cromato di potassio, possono reagire con agenti riducenti per generare calore e prodotti che possono essere gassosi (causando la pressurizzazione di contenitori chiusi). I prodotti possono essere essi stessi in grado di ulteriori reazioni (come la combustione nell’aria). La riduzione chimica dei materiali in questo gruppo può essere rapida o addirittura esplosiva, ma spesso richiede l’iniziazione (calore, scintilla, catalizzatore, aggiunta di un solvente). Le miscele esplosive di agenti ossidanti inorganici con agenti riducenti spesso persistono immutate per lunghi periodi se l’inizio è impedito. Tali sistemi sono tipicamente miscele di solidi, ma possono coinvolgere qualsiasi combinazione di stati fisici. Alcuni agenti ossidanti inorganici sono sali di metalli solubili in acqua; la dissoluzione diluisce ma non annulla il potere ossidante di tali materiali. I composti organici, in generale, hanno un certo potere riducente e possono in linea di principio reagire con i composti di questa classe. La reattività effettiva varia notevolmente con l’identità del composto organico. Gli agenti ossidanti inorganici possono reagire violentemente con metalli attivi, cianuri, esteri e tiocianati.
Pericolo
Tossico per ingestione e inalazione.
Pericolo per la salute
L’inalazione provoca irritazione locale delle mucose; continuare l’irritazione del naso può provocare la perforazione del setto nasale. L’ingestione può causare gastroenterite violenta, collasso circolatorio, vertigini, coma e nefrite tossica; l’ingestione di quantità eccessive può essere fatale. Il contatto con gli occhi provoca gravi irritazioni e congiuntivite. L’esposizione ripetuta o prolungata a polvere, nebbia o soluzioni può causare dermatiti; il contatto con le rotture della pelle può causare `piaghe cromate” che appaiono come ulcere a lenta guarigione e con la montatura dura che lasciano l’area vulnerabile alle infezioni.
Pericolo di incendio
Comportamento nel fuoco: può aumentare l’intensità del fuoco se a contatto con materiali combustibili. Raffreddare i contenitori e versare il materiale con abbondante acqua.
Profilo di sicurezza
Cancerogeno confermato con dati sperimentali di origine tumorale. Veleno per ingestione, per via endovenosa, sottocutanea e vie intramuscolari. Un teratogeno sperimentale. Altri effetti riproduttivi sperimentali. Dati sulla mutazione umana riportati. Un potente ossidante. Quando viene riscaldato per la composizione emette fumi tossici di K2O. Utilizzato come mordente per la lana, nell’ossidazione e nel trattamento dei coloranti sui materiali. Vedi ANCHECOMPOSTI DI CROMIO.
Esposizione potenziale
Il cromato di potassio viene utilizzato nella stampa: elaborazione fotomeccanica; cromo-pigmento di produzione; e lana conservante metodi; per fare coloranti, pigmenti, inchiostri e smalti; come un agente ossidante; reagente analitico; in galvanotecnica; esplosivi.
Spedizione
UN1479 Solido ossidante, n.a. s., Classe di pericolo: 5.1; Etichette: 5.1-Ossidante, Nome tecnico richiesto. UN3288 Solidi tossici, inorganici, n.a.s., Classe di pericolo: 6.1; Etichette: 6.1-Materiali velenosi, Nome tecnico richiesto
Metodi di purificazione
Cristallizzarlo dall’acqua di conduttività (0,6 g/mL a 20o) e asciugarlo tra 135o e 170o.
Incompatibilità
Un potente ossidante. Reazioni violente con combustibili, sostanze organiche, metalli in polvere; o sostanze facilmente ossidabili. Il contatto con idrossilammina, idrazina provoca esplosione.