l’Articolo
Giovanni Plante*, Chelsea Eason, Alan Snyder, Dirk Elston
Dipartimento di Dermatologia e Chirurgia Dermatologica, Università di Carolina del Sud, Charleston, Sud Carolina
Lichen planopilaris (LPP) è una primaria cicatriziale alopecia caratterizzata da prurito, tenerezza, follicolare spine e eritema in attivo fase1-3. Sebbene l’eziologia precisa sia sconosciuta, la patogenesi comprende l’infiammazione cronica e linfocitaria-mediata che può infine condurre alla perdita irreversibile e cicatrizzante dei capelli con la sua distruzione selettiva del follicolo pilario1, 2. Esistono tre varianti di LPP e includono la forma classica, l’alopecia fibrosante frontale (FFA)e la sindrome di Graham-Little-Piccardi-Lassueur (alopecia progressiva del cuoio capelluto, ascelle, sopracciglia e pube) 2. LPP spesso si dimostra refrattario alle terapie standard e segue un corso imprevedibile e recidivante, portando spesso a una qualità della vita gravemente diminuita1, 2, 4, 5. Qui discutiamo ulteriormente il nostro recente studio sull’uso di tofacitinib nel trattamento di LPP6 recalcitrante.
Numerose terapie sono state utilizzate per trattare LPP con successo variabile1-3,5,7-9. Poiché i trattamenti attualmente disponibili non portano in genere alla ricrescita dei capelli, la gestione è diretta verso la diminuzione del tasso di perdita dei capelli, il controllo dei sintomi e la riduzione dell’infiammazione2,9. Le terapie di prima linea includono corticosteroidi topici intralesionali e ad alta potenza, ma questi possono causare atrofia del cuoio capelluto e compromettere il successo del futuro trapianto di capelli. Altri agenti topici hanno meno rischio di atrofia e comprendono gli inibitori della calcineurina tacrolimus e pimecrolimus2. Sebbene non controlli il processo infiammatorio sottostante, sia il minoxidil topico che quello orale possono anche essere usati per massimizzare la ricrescita dei capelli in pazienti che soffrono anche di alopecia ereditaria-quasi il 50% della popolazione9,10. Ulteriori terapie sistemiche includono idrossiclorochina, micofenolato mofetile, ciclosporina, metotrexato, talidomide, doxiciclina, retinoidi, pioglitazone, inibitori della 5-alfa reduttasi e prednisolone a breve termine1,2,9. Studi recenti hanno suggerito il potenziale di naltrexone orale a basso dosaggio, iniezioni di plasma ricche di piastrine e interventi non farmacologici come il laser ad eccimeri,ma nessuno è stato uniformemente efficace5,7, 8. Mentre i pezzi di capelli e le estensioni possono aumentare il volume e coprire le aree alopeciche, deve essere esercitata cautela per evitare la traction9.
In uno studio recentemente pubblicato, abbiamo studiato il potenziale delle formulazioni topiche e orali (sistemiche) di tofacitinib6. Tofacitinib è un inibitore di Janus chinasi (JAK) 1/3 con efficacia contro diverse condizioni dermatologiche immuno-mediate, tra cui dermatite atopica, alopecia areata e vitiligine11-14. La sua attività immunomodulante è mediata attraverso l’inibizione del percorso di segnalazione JAK/STAT12, 13. Nella LPP, gli interferoni sono stati implicati nel facilitare il reclutamento linfocitario e la perdita del privilegio immunitario delle cellule epiteliali rigonfiate1. Attraverso gli effetti di tofacitinib sulla via JAK / STAT, questa infiammazione mediata da interferone può essere ridotta, migliorando così i sintomi e prevenendo un’ulteriore distruzione follicolare1,11-13.
Abbiamo esplorato il potenziale terapeutico di tofacitinib nel trattamento della LPP refrattaria attraverso una revisione retrospettiva della carta6. A conoscenza degli autori, questo è il secondo studio che studia l’uso di tofacitinib nella gestione LPP1. Il nostro studio ha incluso nove pazienti che avevano fallito altra terapia-tre usato topico, cinque usato orale, e uno usato entrambe le formulazioni.
È stata raggiunta una risposta iniziale favorevole in tutti i pazienti tranne uno. Il restante soggetto ha risposto male alla terapia topica, ma è migliorato con la terapia sistemica con tofacitinib. Sebbene il numero assoluto di pazienti sia piccolo, c’è stata una tendenza verso una migliore risposta clinica in quelli sistemici rispetto a quelli in terapia topica. Il tempo per una risposta favorevole variava da 1 a 7 mesi, con 5 e 8 pazienti che dimostravano un miglioramento rispettivamente entro i primi 3 e 5 mesi di trattamento.
Il nostro modello di pratica attuale è quello di trattare la malattia rapidamente progressiva con un breve ciclo di prednisone o ciclosporina e quindi provare a passare alla terapia topica inibitore della calcineurina quando possibile (Figura 1). Un sottogruppo di pazienti otterrà la remissione della malattia con pioglitazone a dosi di 15-45 mg al giorno. I pazienti devono essere informati dell’indicazione marcata, dei dati misti riguardanti l’efficacia e dell’avvertenza in scatola sul cancro della vescica con l’uso prolungato. La nostra pratica è di non continuare pioglitazone dopo un massimo di 9 mesi con dosi crescenti in incrementi. Gli agenti aggiuntivi includono naltrexone alla dose di 5 mg al giorno e N-acetilcisteina alle dosi di 600-1200 mg tre volte al giorno. Laser ad eccimeri, tenuto in mano a banda stretta UVB, o bassa intensità laser cap terapia è spesso usato come terapia aggiuntiva in quelli con una risposta parziale. L’idrossiclorochina può occasionalmente essere di beneficio, ma la maggior parte dei pazienti indirizzati alla nostra clinica ha già fallito la terapia con idrossiclorochina. Coloro che non rispondono possono richiedere un trattamento con metotrexato, micofenolato mofetile o tofacitinib. I risultati del nostro recente studio forniscono un ulteriore supporto all’idea che sia tofacitinib topico che sistemico possano essere modalità di trattamento aggiuntive praticabili nei casi refrattari. I disturbi dei capelli spesso rispondono lentamente e rivalutiamo a intervalli di 3 mesi per determinare la risposta alla terapia e la necessità di escalation.
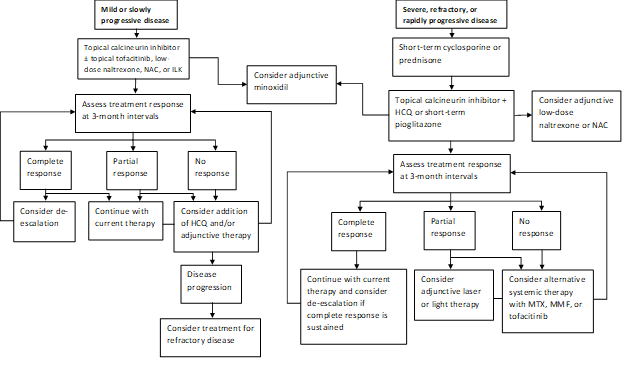
Figura 1: Algoritmo di trattamento graduale per LPP
NAC, N-acetilcisteina; ILK, corticosteroidi intralesionali; HCQ, idrossiclorochina; MTX, metotrexato, MMF, micofenolato mofetile
Quando si considera l’uso di tofacitinib nella pratica, i professionisti devono bilanciare i benefici di questo farmaco con i suoi rischi. La nostra coorte ha avuto solo anomalie di laboratorio minori (una sulla terapia topica e due sulla terapia sistemica) che non hanno richiesto un intervento. Tuttavia, i fornitori devono essere consapevoli dei potenziali effetti collaterali quando prescrivono questo farmaco, tra cui un aumentato rischio di infezione, citopenie, iperlipidemia, anomalie epatiche e renali, nonché il potenziale per eventi tromboembolici14-16. Sebbene la formulazione topica abbia dimostrato concentrazioni plasmatiche inferiori rispetto alla sua controparte sistemica, eventi avversi minori e anomalie di laboratorio sono ancora stati riportati con la terapia topica13.
Mentre i nostri risultati sono promettenti, devono essere interpretati dopo aver considerato diverse limitazioni. Abbiamo utilizzato un progetto di studio retrospettivo e non siamo stati in grado di impiegare una misura convalidata della gravità della malattia come il Lichen Planopilaris Activity Index (LPPAI)1,3. Il LPPAI è adatto per studi prospettici e fornisce uno strumento standardizzato con cui i fornitori possono confrontare direttamente i risultati attraverso varie modalità di trattamento. Segni e sintomi come eritema, dolorabilità, presenza di spine follicolari e area interessata sono stati utilizzati per valutare la risposta terapeutica, ma studi futuri dovrebbero includere anche una misura della qualità della vita. La possibilità di polarizzazione dell’osservatore non può essere esclusa in quanto il nostro studio è stato non cieco e non randomizzato.
Inoltre, la nostra intera coorte utilizzava facitinib in modo aggiuntivo, rendendo difficile valutare il contributo indipendente del farmaco. In uno studio precedente, una porzione (N=5) della coorte ha usato tofacitinib come monoterapia e la maggior parte dei soggetti ha raggiunto risultati favorevoli, ma questo studio è stato anche limitato dalla sua piccola dimensione del campione e dal design retrospettivo 1.
Gli studi attuali sono limitati dalle loro piccole dimensioni del campione e dai disegni di studi retrospettivi, e gli studi prospettici ben progettati sono assolutamente necessari. Consigliamo un approccio graduale alla terapia per ridurre al minimo il rischio di effetti avversi. Il rischio di cicatrici permanenti deve essere valutato rispetto al rischio di eventi avversi gravi alla luce dei fattori individuali del paziente e delle comorbidità, e i pazienti devono essere partner attivi nel processo decisionale. Il trapianto di capelli può essere preso in considerazione una volta che il controllo della malattia è stato raggiunto e l’infiammazione è diminuita. È importante notare che la terapia aggressiva quale prednisone o ciclosporina è necessaria tipicamente durante le settimane che seguono il trapianto per evitare i razzi della malattia. Ci si deve aspettare un graduale logoramento dei peli trapiantati, anche dopo un trapianto riuscito, ma i dati suggeriscono che i pazienti sono generalmente soddisfatti dei risultati e scoprono che il trapianto migliora la qualità della vita.
Abbreviazioni
LPP, lichen planopilaris; FFA, alopecia fibrosante frontale; JAK, Janus chinasi; STAT, trasduttore di segnale e attivatore delle proteine di trascrizione; LPPAI, Lichen Planopilaris Activity Index.
Conflitti di interesse
Gli autori non dichiarano conflitti di interesse.
- Yang CC, Khanna T, Sallee B, et al. Tofacitinib per il trattamento del lichene planopilaris: una serie di casi. Dermatol Ther. 2018; 31(6): e12656. doi: 10.1111 / dth.12656
- Babahosseini H, Tavakolpour S, Mahmoudi H, et al. Lichen planopilaris: studio retrospettivo sulle caratteristiche e il trattamento di 291 pazienti. J Dermatolog trattare. 2019; 30(6): 598–604. doi:10.1080/09546634.2018.1542480
- Chiang C, Sah D, Cho BK, et al. Idrossiclorochina e lichen planopilaris: efficacia e introduzione del sistema di punteggio dell’indice di attività del Lichen Planopilaris. J Am Acad Dermatol. 2010; 62(3): 387-392. doi: 10.1016 / j.jaad.2009.08.054
- Alirezaei P, Ahmadpanah M, Rezanejad A, et al. Rispetto ai controlli, gli individui con Lichen Planopilaris hanno più depressione, una minore autostima e una minore qualità della vita. Neuropsicobiologia. 2019; 78(2): 95-103. doi:10.1159/000499135
- Gai AK. Plasma ricco di piastrine come trattamento aggiuntivo in lichen planopilaris. J Am Acad Dermatol. 2019; 80(5): e109-e110. doi: 10.1016 / j.jaad.2018.09.013
- Plante J, Eason C, Snyder A, et al. Tofacitinib nel trattamento del lichene planopilaris: una revisione retrospettiva . J Am Acad Dermatol. 2020; S0190-9622(20) 30979-8. doi:10.1016 / j.jaad.2020.05.104
- Lajevardi V, Salarvand F, Ghiasi M, et al. L’efficacia e la sicurezza di naltrexone orale a basso dosaggio verso placebo nei pazienti con lichen planopilaris: uno studio clinico randomizzato controllato . J Dermatolog trattare. 2020; 1-5. doi:10.1080/09546634.2020.1774488
- Lee B, Elston DM. Gli usi di naltrexone nelle circostanze dermatologiche. J Am Acad Dermatol. 2019; 80(6): 1746-1752. doi: 10.1016 / j.jaad.2018.12.031
- Bolduc C, Sperling LC, Shapiro J. Alopecia cicatriziale primaria: Alopecia cicatriziale primaria linfocitica, tra cui lupus eritematoso cutaneo cronico, lichen planopilaris, alopecia fibrosante frontale e sindrome di Graham-Little. J Am Acad Dermatol. 2016; 75(6): 1081-1099.
- Vano-Galvan S, Trindade de Carvalho L, Saceda-Corralo D, et al. Minoxidil orale migliora lo spessore dei capelli di fondo in lichen planopilaris . J Am Acad Dermatol. 2020; S0190-9622(20)30566-1. doi: 10.1016 / j.jaad.2020.04.026
- Tegtmeyer K, Zhao J, Maloney NJ, et al. Studi off-label su tofacitinib in dermatologia: una recensione . J Dermatolog trattare. 2019; 1–11. doi: 10.1080/09546634.2019.1673877
- Montilla AM, Gomez-Garcia F, Gomez-Arias PJ, et al. Scoping Review sull’uso di farmaci mirati JAK / STAT Pathway nella dermatite atopica, vitiligine, e alopecia Areata. Dermatol Ther (Heidelb). 2019; 9(4): 655–683. doi:10.1007 / s13555-019-00329-y
- Hosking AM, Juhasz M, Mesinkovska NA. Inibitori topici della chinasi di Janus: una revisione delle applicazioni in dermatologia. J Am Acad Dermatol. 2018; 79(3): 535–544. doi: 10.1016 / j.jaad.2018.04.018
- Shreberk-Hassidim R, Ramot Y, Zlotogorski A. Janus inibitori della chinasi in dermatologia: una revisione sistematica. J Am Acad Dermatol. 2017; 76(4): 745-753.e19. doi: 10.1016 / j.jaad.2016.12.004
- Xeljanz/Xeljanz XR (tofacitinib). New York, NY: Divisione Pfizer Laboratories di Pfizer Inc. https://labeling.pfizer.com/showlabeling.aspx?id=959; 2019. Accesso al 7 luglio 2020.
- FDA. La prova di sicurezza trova il rischio di coaguli di sangue nei polmoni e morte con una dose più elevata di tofacitinib (Xeljanz, Xeljanz XR) nei pazienti con artrite reumatoide; FDA per indagare. https://www.fda.gov/drugs/drug-safety-and-availability/safety-trial-finds-risk-blood-clots-lungs-and-death-higher-dose-tofacitinib-xeljanz-xeljanz-xr; 2019. Accesso al 6 luglio 2020.