MO per HF
Orbitali molecolari per molecole diatomiche eterogenee
Un semplice approccio alla teoria degli orbitali molecolari (MO) per molecole diatomiche eterogenee è quello di mostrare il diagramma del livello di energia. Il MO livelli di energia può essere elaborato la seguente procedura:
Ricordiamo che l’energia \(E_n\) per il numero quantico n è un elemento atomico Z è di circa
\
utilizziamo \(Z_{eff}\) invece di Z per dire che dobbiamo modificare il numero atomico per ottenere una efficace carica atomica per il nucleo. Poiché abbiamo a che fare con valori approssimativi, si può usare direttamente Z. Il livello di energia orbitale 1s è -13,6 eV per gli atomi di idrogeno, misurato come l’energia di ionizzazione di H.
Quindi, per il numero quantico n = 1, il livello di energia per 1s di He è approssimativamente – 54 eV. Allo stesso modo, il livello di energia 1s per F è – 1101 eV. I livelli di energia 2s e 2p per He sono approssimativamente – 13,6 eV, che è simlar a quello dell’orbitale 1s di H.
Quindi, il livello di energia 2s per Li è approssimativamente -6 eV. Tuttavia, per gli atomi multi-elettrone, la subshell p e la subshell s hanno energie diverse a causa della penetrazione. A questo livello, non possiamo essere precisi su di esso, ma semplicemente pensare che gli orbitali 2p siano ad energia più alta dell’orbitale 2s. Di solito, orbitali atomici con livelli di energia simili tra loro si sovrappongono per formare orbitali molecolari. Quindi, abbiniamo i livelli di energia degli orbitali atomici, e quindi facciamo il legame e il MOS anti-legame di loro.
Tuttavia, nel caso in cui il livello di energia orbitale atomica sia molto diverso, usiamo orbitali atomici della subshell incompleta per formare MOS.
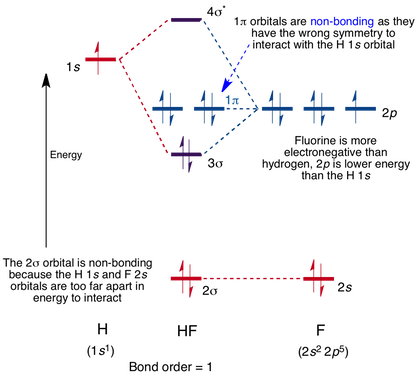
Diagramma orbitale molecolare per la molecola HF
L’interazione avviene tra l’orbitale 1s sull’idrogeno e l’orbitale 2p nel fluoro causando la formazione di un orbitale molecolare sigma-bonding e sigma-antibonding, come mostrato di seguito.