No, gli scienziati non saranno mai in grado di rimuovere lo Spazio vuoto dagli atomi
Se dovessi prendere qualsiasi oggetto nell’Universo fatto di materia normale — qualsiasi cosa un essere umano possa toccare, vedere o altrimenti rilevare un’interazione con l’uso dei nostri corpi — scopriresti che potresti suddividerlo in componenti sempre più piccoli. Un intero corpo umano può essere suddiviso in organi, che a loro volta sono costituiti da cellule. Ogni cellula è costituita da organelli, che sono strutture più piccole con funzioni specializzate, e gli organelli dipendono dalle interazioni che si verificano a livello molecolare.
A comporre l’intera suite di molecole sono gli atomi: il componente più piccolo della materia normale che conserva il carattere individuale e le proprietà dell’elemento in questione. Gli elementi sono definiti dal numero di protoni nel nucleo di ciascun atomo, dove un atomo è costituito da elettroni che orbitano attorno a quel nucleo. Ma nonostante il fatto che gli atomi siano per lo più spazio vuoto all’interno, non c’è modo di rimuovere quello spazio. Ecco la storia del perché.

Un atomo, al livello più elementare, è costituito da un nucleo atomico di carica positiva che è estremamente piccolo in volume. Per ogni protone nel nucleo atomico, c’è un quantum di carica uguale e opposto che orbita attorno ad esso, creando un sistema neutro globale: l’elettrone.
Tuttavia, mentre il nucleo atomico è limitato a un volume estremamente piccolo — il diametro di un protone è di circa 1 femtometro, o 10^-15 m — gli elettroni orbitanti, che sono essi stessi particelle puntiformi, occupano un volume che è approssimativamente 1 ångstrom (10^-10 m) in tutte e tre le dimensioni.
Il primo esperimento che ha dimostrato questa enorme differenza risale a più di un secolo fa, quando il fisico Ernest Rutherford bombardò un sottile foglio di lamina d’oro con particelle radioattive.
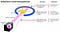
Quello che Rutherford ha fatto è stato semplice e diretto. L’esperimento è iniziato con un apparato a forma di anello progettato per rilevare particelle che lo incontrano da qualsiasi direzione. Al centro dell’anello, lamina d’oro finemente martellato è stato posto di uno spessore così piccolo che non poteva essere misurata con strumenti del primo-20 ° secolo: probabilmente solo poche centinaia o migliaia di atomi attraverso.
Al di fuori sia dell’anello che della lamina, è stata posizionata una fonte radioattiva, in modo da bombardare la lamina d’oro da una particolare direzione. L’aspettativa era che le particelle radioattive emesse avrebbero visto la lamina d’oro molto come un elefante in carica avrebbe visto un pezzo di carta velina: avrebbero semplicemente attraversato come se la lamina non fosse affatto lì.
Ma questo si è rivelato vero solo per la maggior parte delle particelle radioattive. Alcuni di loro — piccoli in numero ma di vitale importanza-si sono comportati come se rimbalzassero da qualcosa di duro e immobile.

Alcuni di loro si sparpagliarono da una parte o dall’altra, mentre altri sembravano rimbalzare verso la loro direzione di origine. Questo primo esperimento fornì la prima prova che l’interno di un atomo non era una struttura solida come precedentemente immaginato, ma piuttosto consisteva in un nucleo estremamente denso e piccolo e una struttura esterna molto più diffusa. Come Rutherford stesso ha osservato, guardando indietro decenni dopo,
“È stato l’evento più incredibile che mi sia mai successo in vita mia. È stato quasi incredibile come se avessi sparato un guscio da 15 pollici a un pezzo di carta velina e fosse tornato indietro e ti avesse colpito.”
Questo tipo di esperimento, in cui si spara una particella bassa, media o ad alta energia su una particella composita, è noto come scattering anelastico profondo, e rimane il nostro metodo migliore per sondare la struttura interna di qualsiasi sistema di particelle.

Per l’atomo, da uno semplice come l’idrogeno a uno complesso come l’oro, il piombo o l’uranio, gli elettroni possono essere trovati ben oltre l’estensione del nucleo atomico. Mentre un nucleo atomico è limitato a un volume di circa 1 femtometro cubico (10^-15 metri su ciascun lato), un elettrone può essere trovato distribuito probabilisticamente su un volume che è approssimativamente un quadrilione (101 times) volte più grande. Questa proprietà è indipendente da quale elemento consideriamo, dal numero di elettroni presenti (purché sia almeno uno) o dal metodo che usiamo per misurare l’elettrone o il nucleo.
Il fatto che gli atomi siano per lo più spazi vuoti è noto, oggi, anche alla maggior parte degli scolari, che apprendono questo fatto all’incirca nello stesso momento in cui apprendono la struttura degli atomi. Dopo aver appreso questo, molti di loro si chiedono — come sono sicuro che molti di voi si chiedono-perché non si può semplicemente rimuovere quello spazio vuoto e compattare gli atomi su scale molto più piccole, come le dimensioni di un nucleo atomico?

Nel mondo classico, dove la natura gioca secondo regole che conosciamo e che corrispondono a ciò che la nostra intuizione prevede, è molto facile controllare le posizioni delle particelle. Ma a livello quantistico, c’è una limitazione fondamentale stabilita dalle regole della natura: il principio di indeterminazione di Heisenberg.
Anche se sai tutto quello che c’è da sapere su un elettrone in orbita attorno a un nucleo atomico, tra cui:
- quale livello di energia occupa,
- qual è il suo stato quantico,
- e quanti altri elettroni ci sono nei livelli di energia circostanti,
rimarrà ancora un certo numero di proprietà che sono intrinsecamente incerte. In particolare, una delle proprietà intrinsecamente incerte è la posizione dell’elettrone; possiamo solo tracciare la distribuzione di probabilità di dove è probabile che l’elettrone sia.
La ragione di ciò è l’incertezza quantistica intrinseca tra posizione e quantità di moto. Il momento di un elettrone, che possiamo pensare come l’unità di movimento che qualsiasi particella avrà, può essere conosciuto con una certa precisione eseguendo una misura specifica.
Tuttavia, più precisa è la misurazione che rivela la quantità di moto, maggiore è l’incertezza intrinseca che l’atto di misurarla conferirà alla posizione dell’elettrone. Al contrario, più precisamente si tenta di misurare la posizione dell’elettrone, maggiore sarà l’incertezza che si induce nella quantità di moto dell’elettrone. Puoi conoscere queste due quantità — posizione e quantità di moto-con una precisione limitata allo stesso tempo, poiché misurarne una più precisamente creerà un’incertezza intrinsecamente più grande in quella che non misuri.

L’elettrone occupa naturalmente il grande volume che ci aspettiamo attorno al nucleo atomico per due motivi.
- La dimensione della nuvola di probabilità che l’elettrone occupa dipende dal rapporto carica-massa dell’elettrone. Con la stessa carica di magnitudine del protone ma solo 1/1836 della massa, anche la forza elettromagnetica ultra-forte non può limitare l’elettrone a un volume più piccolo di quello che vediamo.
- La forza esterna che comprime un elettrone su un nucleo atomico, limitando i componenti esterni della nube di probabilità, è estremamente piccola anche per gli atomi legati insieme in un reticolo ultra-forte. Le forze tra gli elettroni in due atomi diversi, anche in atomi che sono legati insieme, è molto piccola rispetto alla forza tra il nucleo atomico e un elettrone.
Ognuno di questi motivi ci dà una speranza per una soluzione che funziona nella pratica, ma con applicabilità limitata.

Puoi sostituire l’elettrone con una particella più massiccia con la stessa carica elettrica. Ci sono due particelle simili agli elettroni che esistono nel modello standard con la stessa carica dell’elettrone: il muone e il tau. Il muone è circa 200 volte più massiccio di un elettrone, e quindi un atomo di idrogeno muonico (con un protone per un nucleo ma un muone invece di un elettrone che lo orbita) è circa 200 volte più piccolo dell’idrogeno standard.
Se si lega l’idrogeno muonico a un certo numero di altri atomi, essi fungeranno da catalizzatore per la fusione nucleare, permettendogli di procedere con temperature ed energie molto più basse rispetto alla fusione standard. Tuttavia, i muoni vivono solo per ~ 2 microsecondi prima di decadere, e il tau più massiccio vive per meno di un picosecondo. Questi atomi esotici sono troppo transitori per rimanere utili a lungo.

In alternativa, è possibile aumentare enormemente la pressione sugli atomi accumulando quantità incredibili di massa in un’unica posizione nello spazio. Un singolo atomo isolato potrebbe essere solo un ångstrom di dimensioni, ma se si accumula il materiale di una stella attorno ad esso, quell’atomo sentirà una pressione esterna che “schiaccia” l’elettrone per occupare un volume molto più limitato.
Maggiore è la pressione, più gli elettroni sono confinati e più piccoli sono gli atomi in termini di estensione fisica. C’è un limite alla pressione esterna che gli atomi possono sopportare prima che si verifichi la stessa catastrofe di prima: i nuclei atomici si avvicinano così tanto che le loro funzioni d’onda si sovrappongono e può verificarsi la fusione nucleare. In una nana bianca, questa soglia si verifica a circa 1,4 masse solari; superarla, e finirai per iniziare una reazione di fusione in fuga, che si traduce in questo caso in una supernova di tipo Ia.

Potrebbe essere un delizioso sogno di fantascienza rimuovere lo spazio vuoto dagli atomi, diminuendo il volume che la materia occupa da fattori di milioni, trilioni o anche di più. Tuttavia, non è che gli elettroni che orbitano attorno al nucleo occupino intrinsecamente un volume estremamente grande di spazio, ma piuttosto che le proprietà quantistiche inerenti alle particelle — masse, cariche, forza di interazione e incertezza quantistica — si combinano per creare gli atomi che esistono nel nostro Universo.
Anche se avessimo una controparte stabile e più pesante dell’elettrone, o la capacità di comprimere la materia in stati arbitrariamente densi, ci imbatteremmo in una soglia quantistica in cui i nuclei atomici ai centri degli atomi si fonderebbero spontaneamente, impedendo che configurazioni stabili di più atomi esistano del tutto. Il fatto che i nostri atomi siano per lo più spazio vuoto consente l’esistenza di molecole, chimica e vita.
Rimuovere lo spazio vuoto dagli atomi potrebbe essere un divertente esperimento mentale, ma gli atomi sono le dimensioni che sono a causa delle regole dell’Universo. La nostra esistenza dipende dal fatto che lo spazio vuoto sia presente, ma con le costanti della natura che hanno i valori che fanno, non preoccuparti. Non può essere altro modo.