Struttura molecolare Rivela Come l’Antibiotico Streptomicina Opere | BNL Redazione
Struttura Molecolare Rivela Come l’Antibiotico Streptomicina Opere
5 settembre 2013
Streptomicina è stato il primo antibiotico sviluppato per il trattamento della tubercolosi ancora fino a poco tempo fa, gli scienziati non hanno capito perfettamente come funziona a livello molecolare. Sapevano che la streptomicina blocca un processo critico, la sintesi delle proteine da parte dei ribosomi che porta alla morte delle cellule batteriche, ma alcuni dettagli dell’interazione sono rimasti sconosciuti. Alla sorgente luminosa di sincrotrone nazionale del Brookhaven National Laboratory, i ricercatori hanno utilizzato la cristallografia a raggi X per completare il quadro.
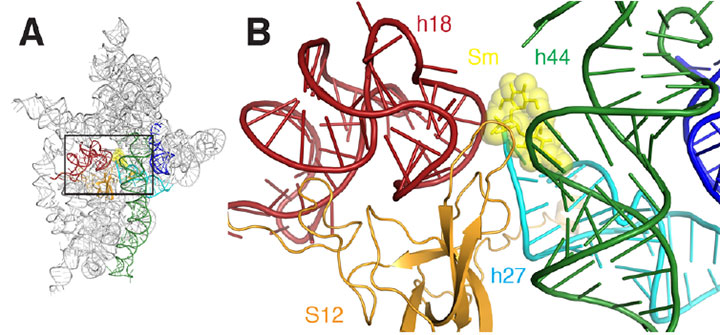
A) Un diagramma a nastro del sito di legame della streptomicina del ribosoma. B) Un primo piano dell’area rettangolare delineata in A. La streptomicina è rappresentata come SHCK e sfere gialle, le eliche sono colorate di rosso, verde scuro, ciano, arancione e blu.
La streptomicina è un membro di una famiglia di antibiotici che lavorano interrompendo la funzione dei ribosomi delle cellule batteriche, le complesse macchine molecolari che creano proteine collegando gli amminoacidi insieme. I ribosomi, un obiettivo principale per gli antibiotici che funzionano inibendo la sintesi delle proteine, hanno due parti principali o “subunità.”
La subunità più grande fa la costruzione della proteina, guidata da un tipo di RNA chiamato RNA messaggero (mRNA), che si lega ad esso. La piccola subunità “legge” l’mRNA e seleziona la molecola corrispondente dell’RNA di trasferimento (tRNA), che seleziona e consegna l’amminoacido successivo al ribosoma. Questo è dove la streptomicina svolge un ruolo. Si lega vicino alla piccola subunità, causando un grave errore di lettura della sequenza. Ciò si traduce nella sintesi di proteine casuali, che alla fine uccide i batteri. Ma come questa lettura errata si è verificato è rimasto un mistero, fino a quando un recente studio condotto da ricercatori della Brown University e il multi-istituzione Northeastern Collaborative Access Team presso Argonne National Laboratory (gestito dalla Cornell University).
Creando un cristallo-una struttura ordinata di unità identiche-della piccola subunità ribosomiale legata all’mRNA in presenza di streptomicina, i ricercatori hanno generato diverse “istantanee” dettagliate che hanno rivelato dettagli chiave a livello molecolare dell’interazione, mostrando infine come la streptomicina comprometta la funzione della subunità. Alla NSLS beamline X25, hanno usato una tecnica chiamata cristallografia a raggi X, in cui un fascio di raggi X è rivolto al cristallo, interagisce con le molecole e produce un intricato modello di diffrazione. Dal modello, con l’aiuto del software per computer, il gruppo ha costruito rappresentazioni visive della subunità-complesso mRNA-streptomicina.
In breve, i ricercatori hanno potuto “vedere” per la prima volta i modi sottili in cui la streptomicina distorce la struttura del sito di decodifica della subunità, causando una lettura errata dell’mRNA. Ad esempio, il legame con la streptomicina riduce la distanza tra due delle molte eliche che compongono la struttura molecolare della subunità. Ciò è particolarmente significativo perché queste eliche formano il sito di decodifica effettivo e la decodifica avviene correttamente solo se questi elementi sono orientati esattamente a destra rispetto all’mRNA e al tRNA selezionato. Streptomicina legame induce anche un cambiamento nel rapporto tra una di queste due eliche e una terza elica, causando uno a ritrarsi dall’altro o “disimpegnarsi.”
Il risultato finale di tutte queste lievi alterazioni è che la streptomicina destabilizza il legame tra la subunità e il tRNA “corretto” e contemporaneamente stabilizza il legame della subunità al tRNA “sbagliato”, eliminando così efficacemente la discriminazione tra il tRNA corretto e il tRNA sbagliato. Ciò provoca il caos nella catena di approvvigionamento batterica per nuove proteine, interrompendo la riproduzione dei batteri e il ciclo di vita.
“il Nostro strutturali studi hanno rivelato che la streptomicina induce sorprendentemente grandi distorsioni nel ribosoma batterico, che ci aiutano a capire come questo antibiotico interferisce con la sintesi proteica nei batteri,” ha detto il ricercatore scientifico gerwald Jogl, un professore associato di biologia in Marrone, Biologia Molecolare, Biologia Cellulare & Reparto di Biochimica. “Continuando dai nostri risultati attuali, stiamo ora studiando come le mutazioni nei ribosomi batterici possono contrastare questi riarrangiamenti strutturali e consentire ai batteri di sopravvivere all’azione altrimenti letale della streptomicina.”
Questa ricerca è stata pubblicata nell’edizione del 15 gennaio 2013 di Nature Communications, con il titolo “A structural basis for streptomycin-induced misreading of the genetic code.”Il sostegno è venuto dal National Institutes of Health e dal Dipartimento dell’Energia.
2013-4251 / INT / EXT / Newsroom